МКОУ «Кужникская СОШ»
Теория и практика ЕГЭ по теме
«Строение вещества»
Автор: учитель химии и биологии
Махмудов Абдулла Махмудович
2023 г.
ХИМИЧЕСКАЯ СВЯЗЬ.
Химическая связь - это взаимодействие атомов, обуславливающее устойчивость молекулы или кристалла как целого. Химическую связь можно представить как электронно-ядерные взаимодействия между различными атомами.
| Обменный | Донорно-акцепторный (в комплексных соединениях) |
|
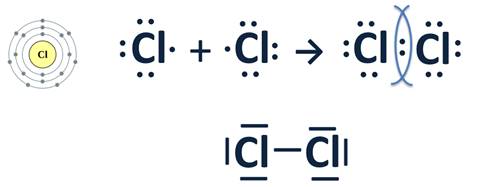
| 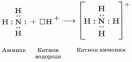
атом азота – донор электронной пары ион водорода – акцептор электронной пары
|
Примеры образования связи по донорно-акцепторному механизму:
– в молекуле угарного газа CO одна связь образована по донорно-акцепторному механизму: C≡O;
– в ионе аммония NH4+ , фосфония РH4+ и в ионах органических аминов CH3-NH2+;
– в комплексных соединениях, между центральным атомом и группами лигандов, например, в тетрагидроксоцинкате натрия Na2[Zn(OH)4] две связи между цинком и гидроксид-ионами; ионы типа AlCl-4, BF-4 и др.
– в азотной кислоте и ее солях — нитратах: HNO3, КNO3, в некоторых других соединениях азота: NO2, N2O5…
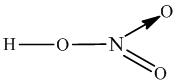
– в молекуле озона O3.
| Одинарные | H―H |
| Двойные | O = O |
| Тройные | 
|
Необходимо уметь составлять структурные формулы простых веществ и соединений.
| 
|

|
|
| ―→ ―→ ―→ Полярность связи возрастает (возрастает разница в зарядах).
| Данные молекулы образованы ковалентной полярной связью, но в целом они неполярные, так как симметрично расположенные связи компенсируют друг друга. |
|
Длина связи зависит от радиуса атомов, чем он больше, тем длиннее связь. | HF
| 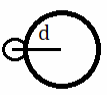
|
| HCl
| 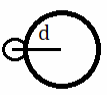
|
| HBr
| 
|
| HI
| 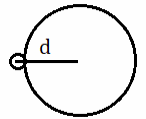
|
Можно привести бесконечное число примеров с разными видами связи. Необходимо уметь составлять структурные формулы веществ и уметь анализировать.
- Соли и щелочи. Между атомами внутри сложного иона связь ковалентная полярная, а между самими ионами - ионная.
| Сульфат бария 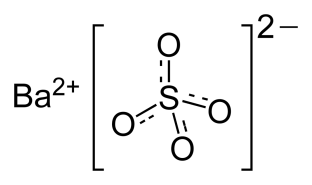
↗ ↖ ионная связь ковалентная полярная связь
| гидроксид натрия Na+ [O―H]- ↗ ↖ ионная связь ковалентная полярная связь
|
| нитрат аммония 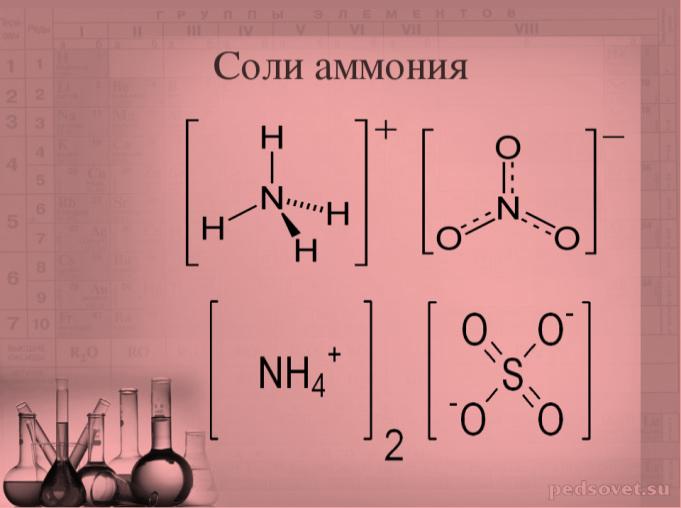
|
|
- Пероксиды и ацетилениды. Ионная и ковалентная неполярная связи.
| Пероксид натрия Na+ [O―O]2- Na+ ↗ ↑ ↖ ионная связь ков. непол. ионная связь
|
 ацетиленид серебра (I) ацетиленид серебра (I)
|
карбид кальция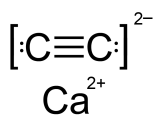
|
|  Пирит Пирит
|
- Пероксид водорода, этилен, ацетилен, бензол. Ковалентная полярная и неполярная
Пероксид водорода
H→O―O←H
↗ ↑ ↖
полярная связь ков. непол. полярная связь
↘ ↓ ↙
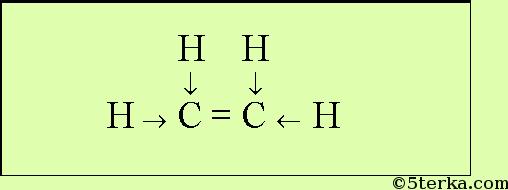
Этилен
Бензол 
Ковалентная неполяная связь имеется только в случае симметричного расположения атомов и групп относительно химической связи. Например, в молекулах пропана или пропилена нет неполярных связей:
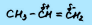
Также в большинстве оксидов отсутствуют неполярные связи. Атомы элемента в оксидах связаны через кислород:
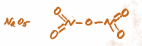
Но как исключение можно привести формулу, здесь одна связь ковалентная неполярная:

-
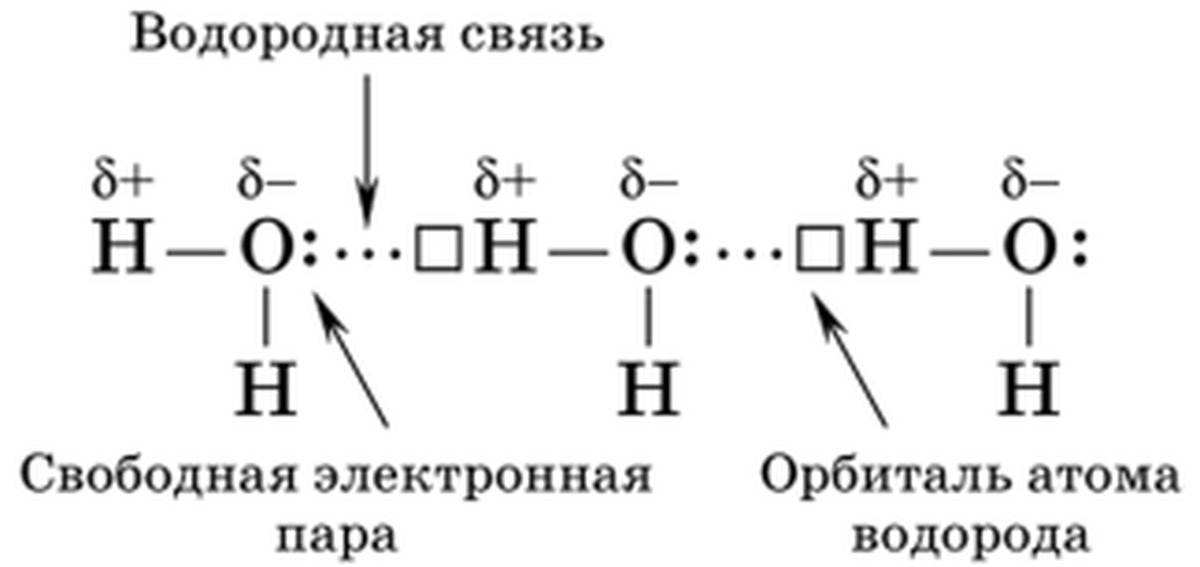
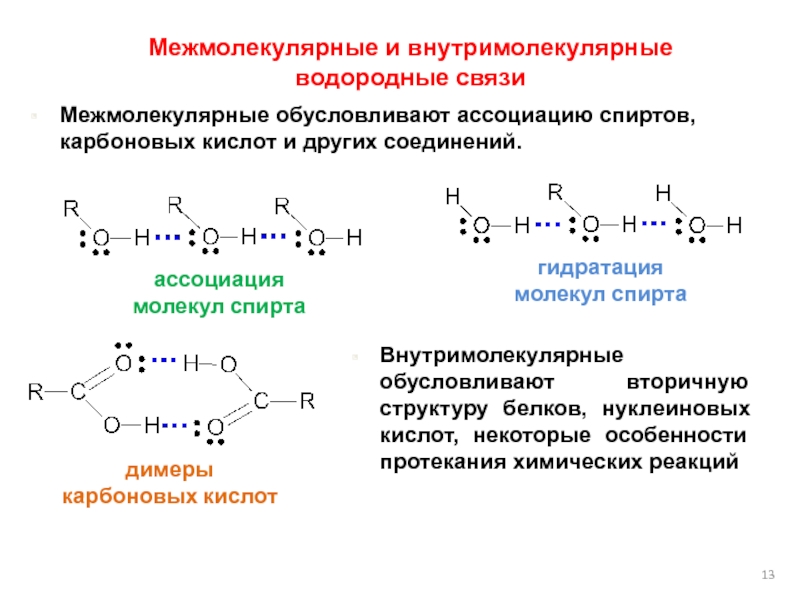
Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильнополярные ковалентные связи — H-F, H-O или H-N.
Водородные связи во много раз слабее, чем обычные ковалентные, но сильнее, чем простые взаимодействия между молекулами.
Водородные связи о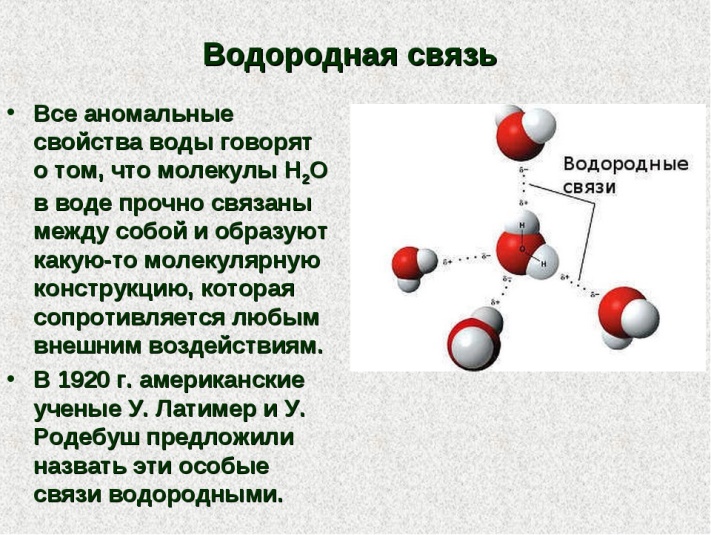 бразуются между молекулами воды, аммиака, фтороводорода, спиртов и фенолов, альдегидов с водой (но не между молекулами альдегидов), кабоновых кислот, внутри белков и нуклеиновых кислот.
бразуются между молекулами воды, аммиака, фтороводорода, спиртов и фенолов, альдегидов с водой (но не между молекулами альдегидов), кабоновых кислот, внутри белков и нуклеиновых кислот.
ТИПЫ СТРОЕНИЯ ВЕЩЕСТВ.
| ВЕЩЕСТВА |
|
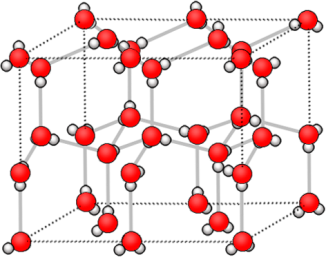
Молекулярные
|
Немолекулярные |
| Имеют постоянный состав | не имеют постоянного состава |
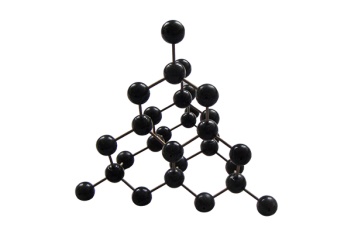
| атомные | ионные | металлические |
| состоят из молекул | состоят из атомов, связанных ковалентными связями | состоят из ионов | состоят из атом-ионов, связанных общими электронами |
| 
| 
| 
| 
|
| Имеют низкие tпл, жидкости, газы, хрупкие твердые вещества из-за того, что молекулы между собой связаны слабыми взаимодействиями. | Твердые, тугоплавкие вещества. Часто алмазоподобные. Атомы в кристалле связаны прочными ковалентными связями. | Твердые, чаще всего тугоплавкие, растворимые в воде. | Обладают металли-ческим блеском, электро- и теплопроводностью. |
| 1. Простые вещества с ковалентной неполярной связью: H2, Br2 O2, Cl2 N2, I2 F2, O3 P4, S8, С60 2. Сложные вещества с ковалентной полярной связью: -большинство органических соединений (за исключением солей) CH3OH, C2H4 и т. д. - кислоты, -оксиды, H2O, NO2, SO3, P2O5 и т. д. -летучие водородные соединения: HCl, NH3, PH3 и т. д. -и др. SF6, CS2, PCl3, H2O2, N2H4 …
|
1.Простые вещества с ковалентной неполярной связью: С – алмаз и графит, Si, Ge, B и т. д.
Графит мягкий из-за слоистого строения
2. Некоторые сложные вещества с ковалентной полярной связью: SiO2 - кремнезем, SiC - карборунд, Al2O3 – корунд Некоторые сульфиды: Al2S3, FeS
Нитрид бора BN Карбид алюминия Al4C3 | Это вещества, в которых присутствует ионная связь:
1.Соли (в том числе органические).
2.Щелочи.
3.Оксиды, нитриды, фосфиды, пероксиды, карбиды, ацетилениды и др. соединения активных металлов. |
Металлы и сплавы |
-
Какие два из приведенных веществ имеют немолекулярное строение?
-
Литий
-
Этанол
-
Ацетат натрия
-
Хлор
-
Хлороводород
-
Выберите два вещества молекулярного строения.
-
Cl2O
-
CaO
-
Sr(OH)2
-
C2H2
-
Au
-
Выберите два вещества с атомной кристаллической решеткой.
-
SH4
-
SiO2
-
Na2SiO3
-
Sin
-
SiF6
-
В каких двух веществах присутствует ионная связь?
-
Сульфид свинца
-
Графит
-
Оксид азота (II)
-
Иодид калия
-
Гидроксид натрия
-
Выберите два вещества молекулярного строения, в которых содержится ковалентная неполярная связь.
-
I2
-
Cl2O
-
MgCl2
-
С2H2
-
Sin
-
Выберите два вещества молекулярного строения c ковалентной полярной связью.
-
Кислород
-
Оксид углерода (IV)
-
Серная кислота
-
Оксид кремния (IV)
-
Магний
-
Выберите два вещества немолекулярного строения, в которых содержится ковалентная полярная связь.
-
Хлорид магния
-
Сульфат натрия
-
Бромид аммония
-
Фосфорная кислота
-
Этилен
-
Выберите два вещества немолекулярного строения, в которых содержится ковалентная неполярная связь.
-
Корунд
-
Карбонат калия
-
Алмаз
-
Пероксид натрия
-
Пероксид водорода
-
Выберите два вещества, в которых есть химическая связь, образованная по донорно-акцепторному механизму.
-
H2S
-
NH4HS
-
Zn(OH)2
-
Na[Al(OH)4]
-
ZnS
-
Выберите два вещества, в которых есть химическая связь, образованная по донорно-акцепторному механизму.
-
CH3NH3Br
-
KF
-
P2O5
-
Na2CO3
-
CO
-
Выберите два вещества, в которых присутствует двойная связь.
-
Хлор
-
Водород
-
Кислород
-
Серная кислота
-
Гидроксид натрия
-
Выберите два вещества, молекулы которых полярны.
-
HBr
-
Br2
-
CH3Cl
-
CH4
-
S8
-
Укажите два вещества, в которых такая же связь, как и в оксиде калия.
-
Кремнезем
-
Фосфин
-
Едкий натр
-
Хлорид цинка
-
Углекислый газ
-
Какие два, из данных веществ, имеют наиболее низкую температуру плавления?
-
СаF2
-
SiO2
-
Al2O3
-
SO3
-
H3PO4
-
Выберите две молекулы с наибольшей длиной связи.
-
HBr
-
HI
-
HF
-
H2O
-
HCl
-
В каких двух веществах присутствует связь такого же типа, как и в молекулах белого фосфора?
-
H2O2
-
I2O5
-
CaS
-
H3PO4
-
I2
-
Выберите два вещества, имеющие ионные и ковалентные полярные связи.
-
Оксид железа (III)
-
Угольная кислота
-
Нитрат рубидия
-
Фосфид калия
-
Хлорид аммония
-
Выберите два вещества, у которых химическая связь наиболее прочна.
-
Cl2
-
N2
-
O2
-
I2
-
Br2
-
Из предложенного перечня выберите два вещества немолекулярного
строения, имеющие ковалентную полярную связь.
1) гидроксид натрия
2) нитрид калия
3) хлорид бария
4) хлороводород
5) оксид кремния
-
Из предложенного перечня выберите два вещества, в которых присутствует ковалентная полярная связь.
1) фторид серы(VI)
2) оксид натрия
3) фторид натрия
4) сульфат магния
5) бор
-
Какие виды химической связи присутствуют в оксалате натрия? Какой тип кристаллической решетки он образует?
-
Почему, при обычных условиях, вода является жидкостью, а сероводород - газ имея при этом большую молекулярную массу?
-
Какие виды химической связи присутствуют в гидразине?
-
Почему сложные эфиры быстрее улетучиваются чем спирты и карбоновые кислоты, из которых они получены, имея при этом более высокую молекулярную массу?
-
Почему азот как простое вещество является относительно инертным при том, что как химический элемент он является сильным окислителем?
-
Какие виды химической связи присутствуют молекуле Р4О10?
-
Какие виды химической связи имеются в циклопентане? Какой тип кристаллической решетки образует твердый циклопентан (toпл. = -94оС)?
-
Почему СО2 это газ, а SiO2 – твердое алмазоподобное вещество?
-
Изобразите структурную формулу озона. По какому механизму образованы связи в этой молекуле?
Ответы:
| 1 | 13 | 11 | 34 |
| 2 | 14 | 12 | 13 |
| 3 | 24 | 13 | 34 |
| 4 | 45 | 14 | 45 |
| 5 | 14 | 15 | 12 |
| 6 | 23 | 16 | 15 |
| 7 | 23 | 17 | 35 |
| 8 | 34 | 18 | 23 |
| 9 | 24 | 19 | 15 |
| 10 | 15 | 20 | 14 |
21. Ковалентные полярные, неполярные и ионные. Ионная кристаллическая решетка.
22. Это объясняется наличием водородных связей между молекулами воды, за счет чего и удерживаются.
23. В молекулах гидразина ковалентные полярные и неполярные связи, а между молекулами – водородные.
24. Большая летучесть эфиров, по сравнению со спиртами и карбоновыми кислотами, обусловлена отсутствием между их молекулами водородных связей.
25. Атомы в молекуле азота удерживаются прочной тройной связью, при этом имеющие сравнительно небольшую длину связи.
26. Только ковалентные полярные.
27. Ковалентные полярные, неполярные. Молекулярная кристаллическая решетка.
28. СО2 является молекулярным веществом, а SiO2 имеет атомное строение. Атомы кремния и кислорода в кристаллической решетке диоксиде кремния удерживаются прочными ковалентными связями, образуя как бы одну гигантскую молекулу.
29. Двойная связь между двумя атомами кислорода образуется по обменному механизму, а связь с третьим атомом кислорода – по донорно-акцепторному.









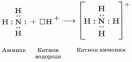





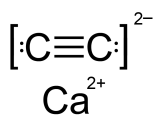
 Пирит
Пирит 

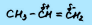
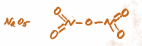

 бразуются между молекулами воды, аммиака, фтороводорода, спиртов и фенолов, альдегидов с водой (но не между молекулами альдегидов), кабоновых кислот, внутри белков и нуклеиновых кислот.
бразуются между молекулами воды, аммиака, фтороводорода, спиртов и фенолов, альдегидов с водой (но не между молекулами альдегидов), кабоновых кислот, внутри белков и нуклеиновых кислот.
























