Тема: Практическая работа № 4
Получение водорода и исследование его свойств.
Цель:
-
совершенствовать экспериментальные умения - приемы работы с лабораторным оборудованием и веществами; наблюдать, делать выводы,
-
закрепление навыков обращения с огнем, опасными веществами и умения оформлять результаты практической работы в тетради;
-
формирование умений составлять уравнения химических реакций, соблюдать правила техники безопасности;
Оборудование:
-
лабораторный штатив с лапкой, держатель для пробирок, штатив для пробирок, спиртовка, спички, прибор Кирюшкина для получения газов, пробирки, кристаллизатор с водой, лучина
Реактивы:
гранулы цинка, соляная кислота (разб.), вода
Правила техники безопасности: Работа со спиртовкой; работа со стеклом; Проверка прибора на герметичность.
Ход работы:
I. Подготовка к проведению практической работы.
-
Инструктаж по технике безопасности при работе с сухим горючим.
-
Технический инструктаж о проведении практической работы.
II. Актуализация знаний
-
Какие исходные вещества будем использовать мы для получения водорода?
-
Необходимо ли нагревать реакционную смесь?
-
На что обратить внимание при записи наблюдений?
-
Какой прибор будем использовать для получения водорода?
-
Какими способами можно собрать водород, почему?
Знакомство с инструкцией: учебник стр. __102______
III. Проведение практической работы (просмотр видео: Получение водорода.)
https://yandex.ru/video/preview/?text=%D0%BF%D1%80%D0%B0%D0%BA%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F%20%D1%80%D0%B0%D0%B1%D0%BE%D1%82%D0%B0%204%20%D0%BF%D0%BE%D0%BB%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D0%B5%20%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4%D0%B0%20%D0%BC%D0%B5%D1%82%D0%BE%D0%B4%D0%BE%D0%BC%20%D0%B2%D1%8B%D1%82%D0%B5%D1%81%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F%20%D0%B2%D0%BE%D0%B4%D1%8B&path=wizard&parent-reqid=1640502528038426-11030179745456302713-sas2-0259-2ea-sas-l7-balancer-8080-BAL-3799&wiz_type=vital&filmId=5630994940907425600
1. Способ получения водорода – взаимодействие активных металлов с кислотами.
Zn + 2HCl =
Наблюдения:
-
реакция взаимодействия гранул цинка с соляной кислотой идет сначала медленно, затем очень бурно, пробирка разогревается
-
из газоотводной трубки выделяется бесцветный газ
2. Рассмотрим приборы для получения и собирания водорода рисунок 35 стр 95
3. Обнаружение водорода – проверка его на чистоту
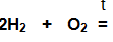
Наблюдения:
при сжигании второй порции газа слышен легкий хлопок
Вывод по реакции:
Одним из способов получения водорода в лаборатории является взаимодействие цинка с разбавленной соляной кислотой, при этом образуется соль (хлорид цинка) и водород. Водород – бесцветный газ, без запаха, малорастворим в воде, легче воздуха, в смеси с воздухом взрывоопасен.
III. Закрепление знаний, умений, навыков.
После проведения работы сделать вывод, записать все результаты в тетрадь.
Вывод
1.
2.
3
Домашнее задание: § _30_______.
3