6
Тема 2 «Периодический закон и периодическая система
Д.И. Менделеева»
Практическое занятие № 2.
Строение электронных формул атомов
Учебная цель: обобщить знания об электронном строении атомов химических элементов; закрепить умения и навыки составления электронных формул атомов химических элементов, а также их графических изображений. Отработать основные понятия: «электронное облако», «атомная орбиталь», «радиус».
Образовательные результаты, заявленные во ФГОС третьего поколения:
Обучающийся должен знать:
- Периодический закон Д.И. Менделеева, структуру периодической таблицы: периоды (малые и большие), группы (главная и побочная), строение атома и атомного ядра, строение электронных оболочек атомов элементов малых и больших периодов, электронные конфигурации атомов химических элементов.
Обучающийся должен уметь:
- характеризовать: элементы малых и больших периодов в Периодической системе, строить электронные конфигурации атомов, определять количество протонов и нейтронов в ядре.
Задачи практического занятия:
Закрепить теоретические знания о Периодическом законе и периодической системе Д.И. Менделеева.
Ответить на вопросы для закрепления теоретического материала.
Выполнить практические задачи. Закрепить практику построения электронного строения атомов химических элементов и их графическое изображение.
Ответить на вопросы для контроля.
Обеспеченность занятия:
Учебно-методическая литература:
Справочная литература:
Тетрадь для практических и контрольных работ.
Ручка.
Краткие теоретические и учебно-методические материалы по теме практического занятия
Атом состоит из атомного ядра и электронной оболочки.
Ядро атома состоит из протонов (p+) и нейтронов (n0). У атома водорода ядро состоит из одного протона.
Число протонов N(p+) равно заряду ядра (Z) и порядковому номеру элемента в естественном ряду элементов (и в периодической системе элементов). N(p+) = Z
Сумма числа нейтронов N(n0), обозначаемого просто буквой N, и числа протонов Z называется массовым числом и обозначается буквой А.
A = Z + N (6)
Электронная оболочка атома состоит из движущихся вокруг ядра электронов (е-).
Число электронов N(e-) в электронной оболочке нейтрального атома равно числу протонов Z в его ядре.
Химический элемент вид атомов (совокупность атомов) с одинаковым зарядом ядра (с одинаковым числом протонов в ядре).
Изотоп совокупность атомов одного элемента с одинаковым числом нейтронов в ядре (или вид атомов с одинаковым числом протонов и одинаковым числом нейтронов в ядре).
Разные изотопы отличаются друг от друга числом нейтронов в ядрах их атомов.
Обозначение отдельного атома или изотопа: 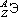 (Э символ элемента), например:
(Э символ элемента), например: 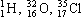 .
.
Атомная орбиталь состояние электрона в атоме. Условное обозначение орбитали  . Каждой орбитали соответствует электронное облако.
. Каждой орбитали соответствует электронное облако.
Орбитали реальных атомов в основном (невозбужденном) состоянии бывают четырех типов: s, p, d и f.
Орбитали одного слоя образуют электронный («энергетический») уровень, их энергии одинаковы у атома водорода, но различаются у других атомов.
Однотипные орбитали одного уровня группируются в электронные (энергетические) подуровни:
s-подуровень (состоит из одной s-орбитали), условное обозначение  .
.
p-подуровень (состоит из трех p-орбиталей), условное обозначение 

 .
.
d-подуровень (состоит из пяти d-орбиталей), условное обозначение 



 .
.
f-подуровень (состоит из семи f-орбиталей), условное обозначение 





 .
.
Энергии орбиталей одного подуровня одинаковы.
При обозначении подуровней к символу подуровня добавляется номер слоя (электронного уровня), например: 2s, 3p, 5d означает s-подуровень второго уровня, p-подуровень третьего уровня, d-подуровень пятого уровня.
Общее число подуровней на одном уровне равно номеру уровня n. Общее число орбиталей на одном уровне равно n2. Соответственно этому, общее число облаков в одном слое равно также n2.
Обозначения:  свободная орбиталь (без электронов),
свободная орбиталь (без электронов),
 орбиталь с электронной парой (с двумя электронами).
орбиталь с электронной парой (с двумя электронами).
Порядок заполнения электронами орбиталей атома определяется тремя законами природы (формулировки даны в приложении 2):
Валентные электроны электроны атома, которые могут принимать участие в образовании химических связей. У любого атома это все внешние электроны плюс те предвнешние электроны, энергия которых больше, чем у внешних. Например: у атома Ca внешние электроны 4s2, они же и валентные; у атома Fe внешние электроны 4s2, но у него есть 3d6, следовательно у атома железа 8 валентных электронов. Валентная электронная формула атома кальция 4s2, а атома железа 4s23d6.
Периодический закон химических элементов Д.И. Менделеева (современная формулировка): свойства химических элементов, а также простых и сложных веществ, ими образуемых, находятся в периодической зависимости от значения заряда из атомных ядер.
Периодическая система Д.И. Менделеева графическое выражение периодического закона (приложение 1).
Естественный ряд химических элементов ряд химических элементов, выстроенных по возрастанию числа протонов в ядрах их атомов, или, что то же самое, по возрастанию зарядов ядер этих атомов. Порядковый номер элемента в этом ряду равен числу протонов в ядре любого атома этого элемента.
Таблица химических элементов строится путем «разрезания» естественного ряда химических элементов на периоды (горизонтальные строки таблицы) и объединения в группы (вертикальные столбцы таблицы) элементов, со сходным электронным строением атомов.
В зависимости от способа объединения элементов в группы таблица может быть длиннопериодной (в группы собраны элементы с одинаковым числом и типом валентных электронов) и короткопериодной (в группы собраны элементы с одинаковым числом валентных электронов).
Группы короткопериодной таблицы делятся на подгруппы (главные и побочные), совпадающие с группами длиннопериодной таблицы.
У всех атомов элементов одного периода одинаковое число электронных слоев, равное номеру периода.
Число элементов в периодах: 2, 8, 8, 18, 18, 32, 32. Большинство элементов восьмого периода получены искусственно, последние элементы этого периода еще не синтезированы. Все периоды, кроме первого начинаются с элемента, образующего щелочной металл (Li, Na, K и т. д.), а заканчиваются элементом, образующим благородный газ (He, Ne, Ar, Kr и т. д.).
В короткопериодной таблице восемь групп, каждая из которых делится на две подгруппы (главную и побочную), в длиннопериодной таблице шестнадцать групп, которые нумеруются римскими цифрами с буквами А или В, например: IA, IIIB, VIA, VIIB. Группа IA длиннопериодной таблицы соответствует главной подгруппе первой группы короткопериодной таблицы; группа VIIB побочной подгруппе седьмой группы: остальные аналогично.
Характеристики химических элементов закономерно изменяются в группах и периодах.
Вопросы для закрепления теоретического материала к практическому занятию
Какое строение имеет атом?
Какие элементарные частицы входят в состав ядра атома? Как определяется заряд ядра атома?
Что определяет сумма протонов и нейтронов?
Дайте определение химического элемента.
Как определить число протонов, нейтронов и электронов в атоме? Докажите, что атом электронейтральная частица.
Дайте определение изотопа.
Задания для практического занятия:
Решить предложенные задачи.
Правильно оформить их в тетрадь для практических и контрольных работ.
Ответить на вопросы для контроля.
Отчитаться о выполненной работе преподавателю.
Задание 1
| Указать элемент, в атоме которого: |
| Вариант 1 | Вариант 2 |
| а) 25 протонов б) 13 электронов | а) 41 протон б) 20 электронов |
Образец решения задания № 1
Указать элемент, в атоме которого 30 протонов.
Алгоритм решения
Дано: N(p+) = 30.
Найти: элемент.
Решение
Известно, что число протонов N(p+) равно заряду ядра (Z) и порядковому номеру элемента в естественном ряду элементов (и в периодической системе элементов) N(p+) = Z.
Определяемый элемент имеет N(p+) = Z = 30.
В Периодической таблице Д.И. Менделеева это цинк (Zn).
Ответ: цинк (Zn)
Задание 2
| Назвать два элемента, в атоме которых: |
| Вариант 1 | Вариант 2 |
| 3 энергетических уровня | 5 энергетических уровней |
Образец решения задания № 2
Назвать два элемента, в атоме которых 4 энергетических уровня.
Алгоритм решения
Дано: 4 энергетический уровень.
Найти: 2 элемента.
Решение
Номер периода в Периодической системе химических элементов им. Д.И. Менделеева указывает, сколько энергетических уровней имеет тот или иной элемент. Поэтому любой элемент из 4 периода относится к атомам, у которых 4 энергетических уровня.
Выберем два элемента из 4 периода Периодической системы химических элементов им. Д.И. Менделеева, например это могут быть калий (К), порядковый номер 19 и цинк (Zn), порядковый номер 30.
Ответ: калий (К), порядковый номер 19 и цинк (Zn), порядковый номер 30.
Задание 3
| Определить два элемента, в атоме которых на последнем энергетическом уровне: |
| Вариант 1 | Вариант 2 |
| 4 валентных электрона | 7 валентных электронов |
Образец решения задания № 3
Определить два элемента, в атоме которых на последнем энергетическом уровне 5 валентных электрона.
Алгоритм решения
Дано: 5 валентных электронов.
Найти: 2 элемента.
Решение
Число валентных электронов определяют с помощью Периодической таблицы Д.И. Менделеева, а именно, по номеру группы, в которой находится элемент (подгруппу при этом не учитывают).
Таким образом, найдем два элемента из 5 группы, пусть это будут: азот (N, порядковый номер 7) и фосфор (Р, порядковый номер 15).
Ответ: азот и фосфор.
Задание 4
| Указать местоположение элементов в Периодической системе химических элементов Д.И. Менделеева, напишите электронные формулы атомов данных элементов: |
| Вариант 1 | Вариант 2 |
| а) № 37 б) № 30 | а) № 24 б) № 50 |
Образец решения задания № 4
Указать местоположение элементов в периодической системе химических элементов, напишите электронные формулы атомов данных элементов:
а) № 41
б) № 68
Алгоритм решения
Дано: элементы с порядковыми номерами 41 и 68.
Найти: 1) месторасположение элементов в периодической системе химических элементов;
2) электронные формулы атомов элементов.
Решение
Элемент с порядковым номером 41 это ниобий (Nb). Элемент расположен в 5 периоде, значит у атома 5 энергетических уровней, в 6 ряду, следовательно у него 6 подуровней, 5 группе, побочной подгруппе, следовательно у элемента 5 валентных электронов.
Электронная конфигурация Nb: 1s22s22p63s23р64s23d104p65s14d4.
Проверяем сумму электронов в атоме:
2 + 2 + 6 + 2 + 6 + 2 + 10 + 6 + 1 + 4 = 41
Следовательно, электронная конфигурация атома написана верно.
Элемент с порядковым номером 68 это эрбий (Er). Элемент расположен в 6 периоде, значит у атома 6 энергетических уровней, в 8 ряду, следовательно у него 8 подуровней, в 3 группе, подгруппе лантаноидов, у элемента 14 валентных электронов.
Электронная конфигурация Er:
1s22s22p63s23р64s23d104p65s24d105p66s26f12
Проверяем сумму электронов в атоме:
2 + 2 + 6 + 2 + 6 + 2 + 10 + 6 + 2 + 10 + 6 + 2 + 12 = 68
Следовательно, электронная конфигурация атома написана верно.
Задание 5
| Чем сходны и чем отличаются по составу изотопы: |
| Вариант 1 | Вариант 2 |
| 4019К 3919К | 3517Сl 3717Cl |
Образец решения задания № 5
Чем сходны и чем отличаются по составу изотопы:
126С и 146C
Алгоритм решения
Дано: изотопы: 126 С и 146 C
Найти: сходства и различия изотопов.
Решение
Изотопы 126С и 146C отличаются массовым числом (А), но имеют одинаковый заряд ядра (Z), т.е. число протонов (N(p+) = 6) и число электронов (N(е-) = 6). Также изотопы отличаются числом нейтронов (N(n0)).
Изотоп 126 С: Массовое число А = 12, число протонов N(p+) = 6, число электронов N(е-) =6, число нейтронов N(n0) = 12 – 6 = 6.
Изотоп 146 С: Массое число А = 14, число протонов N(p+) = 6, число электронов N(е-) =6, число нейтронов N(n0) = 14 – 6 = 8.
Вопросы для контроля
Какое строение имеет электронная оболочка атома? Как определяется число электронов в ней?
Как определить максимальное количество электронов на энергетическом уровне?
Как определяется количество электронов на внешнем энергетическом уровне?
Что такое орбиталь? Какую форму имеют s- и р-орбитали? Какие электроны называются s- и р-электронами?
Что такое электронная формула?
Форма контроля выполнения практического задания:
Выполненная работа представляется преподавателю в тетради для выполнения практических и контрольных работ по дисциплине «Химия».


























