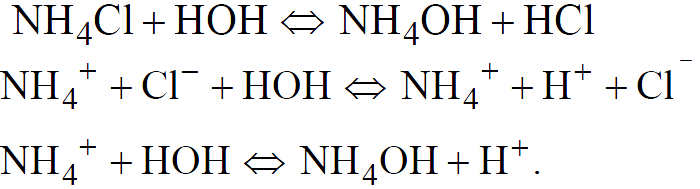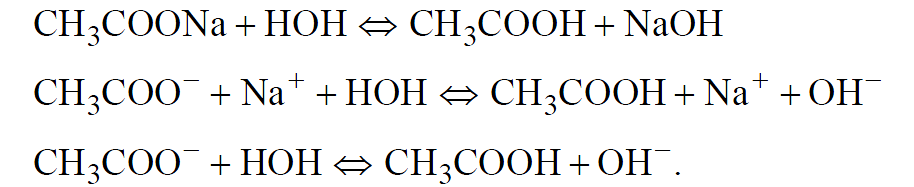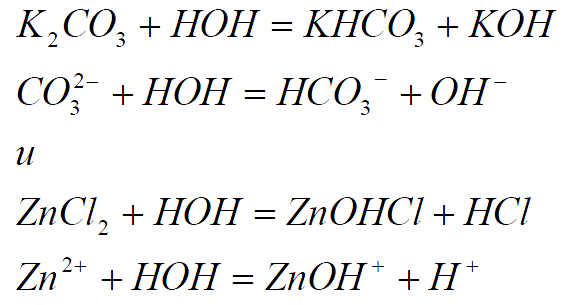Практическое занятие № 3. Определение рН растворов солей
Учебная цель: обобщить знания рН растворов солей и гидролизе солей.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Обучающийся должен знать:
- понятие рН растворов;
- понятие, значение и типы гидролиза.
Обучающийся должен уметь:
- определять рН растворов,
- определять возможность и тип гидролиза соли.
Задачи практического занятия:
Закрепить теоретические знания по теме.
Ответить на вопросы для закрепления теоретического материала.
Закрепить написание управлений гидролиза различных солей.
Закрепить нахождение рН растворов солей по типу соли.
Ответить на вопросы для контроля.
Обеспеченность занятия:
Учебно-методическая литература:
Справочная литература:
Периодическая система химических элементов им. Д.И. Менделеева (приложение 1).
Таблица растворимости (приложение 2).
Окраска индикаторов (приложение 3).
Тетрадь для практических и контрольных работ.
Калькулятор.
Ручка.
Краткие теоретические и учебно-методические материалы по теме практического занятия
Водородный показатель (рН) величина, характеризующая активность или концентрацию ионов водорода в растворах.
Водородный показатель обозначается рН.
Водородный показатель численно равен отрицательному десятичному логарифму активности или концентрации ионов водорода, выраженной в молях на литр:
pH = -lgCН+ (1)
Величина рН имеет большое значение для биохимических процессов, для различных производственных процессов, при изучении свойств природных вод и возможности их применения и т.д.
По значению рН можно судить о среде раствора:
рН
рН = 7 – среда нейтральная;
рН
Реакция водного раствора зависит не только от наличия в нем кислот или оснований, но также и от присутствия некоторых солей. Многие соли, растворяясь в воде, способны смещать реакцию среды в ту или иную сторону. При этом происходит химическое взаимодействие между ионами соли и молекулами воды, сопровождающееся образованием слабых кислот или слабых оснований или малодиссоциируемых ионов. Эта реакция получила название гидролиза солей.
Гидролиз соли – это обратимый, обменный процесс взаимодействия ионов соли с водой, приводящий к образованию слабых электролитов. В результате гидролиза изменяется кислотность среды. Рассмотрим наиболее типичные случаи гидролиза солей.
1. Соль, образованная слабым основанием и сильной кислотой (гидролиз по катиону).
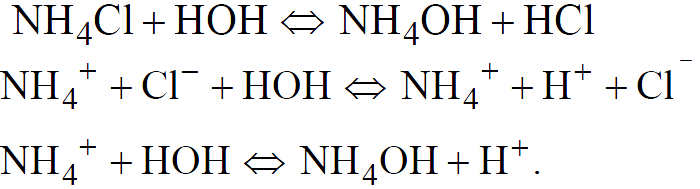
В растворе накапливаются ионы H+, в результате чего реакция смещается в кислую сторону, рН в растворах солей подобного типа меньше 7.
2. Соль, образованная сильным основанием и слабой кислотой (гидролиз по аниону).
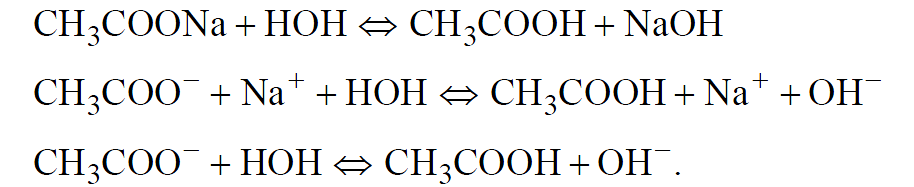
В данном случае гидролиз ведет к увеличению концентраций ионов OH- в растворе, среда щелочная, рН7.
3. Соль, образованная слабой кислотой и слабым основанием (гидролиз по катиону и по аниону).
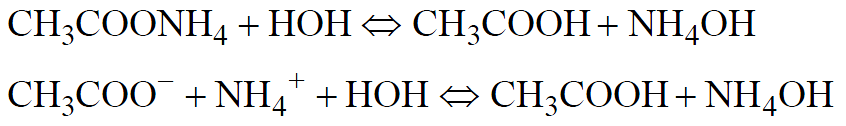
В результате гидролиза ацетата аммония происходит образование двух слабых электролитов, раствор оказывается близким к нейтральному, рН~7.
4. Соль, образованная сильным основанием и сильной кислотой.
Соли подобного типа гидролизу не подвергаются. Их ионы не образуют с ионами H+ и OH- воды слабодиссоциируюших или труднорастворимых соединений, равновесие между ионами и молекулами воды не нарушается и раствор остается нейтральным, рН равен 7.
Особенности гидролиза солей, образованных слабыми многоосновными кислотами, а также солей, образованных слабыми многокислотными основаниями.
Гидролиз солей, образованных слабыми многоосновными кислотами, а также солей, образованных слабыми многоосновными основаниями, протекает ступенчато. В результате гидролиза по первой ступени образуются соответственно кислая или основная соль:
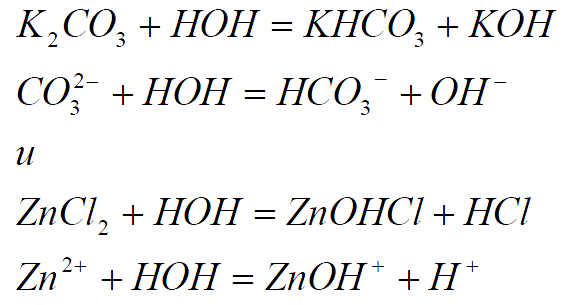
Накопление в растворах ионов OH- и H+ препятствует дальнейшему протеканию гидролиза, и по второй ступени гидролиз практически не протекает.
Вопросы для закрепления теоретического материала к практическому занятию
Дайте понятие рН раствора.
Что означают понятия: нейтральная, кислая, щелочная среда? Каково значение рН в этих средах?
Ход работы:
Написать уравнение реакции солей согласно варранту.
Результаты оформить в таблицу. Сделать вывод.
Ответить на вопросы для контроля.
Отчитаться о выполненной работе преподавателю.
Задание 1
| Написать ионные, ионно-молекулярные и молекулярные уравнения гидролиза солей, определить рН раствора соли: |
| Вариант 1 | Вариант 2 |
| Хлорид алюминия (AlCl3), Железный купорос или сульфат железа (II) (FeSO4), Кальцинированная сода или карбонат натрия (Na2CO3) | Пищевая сода или гидрокарбонат натрия (NaНCO3) Медный купорос или сульфат меди (CuSO4) Нитрит калия (КNO2) |
Образец решения задания № 1
Написать ионные, ионно-молекулярные и молекулярные уравнения гидролиза ацетата натрия (CH3COONa), определить рН раствора соли.
Алгоритм решения
Существует несколько вариантов записи уравнений гидролиза солей. В первом случае первоначально указывают продукты диссоциации соли и воды, после чего – полное и сокращенное ионное уравнения гидролиза и, наконец, его же, но в молекулярном виде.
Рассмотрим на примере гидролиза ацетата натрия (CH3COONa) – одноосновной соли, образованной слабой кислотой – уксусной (CH3COOH) и сильным основанием – гидроксидом натрия (NaOH). Гидролиз всегда протекает по слабому иону (в данном случае – аниону).
CH3COONa ↔ CH3COO— + Na+ (1).
H2O ↔ H+ + OH— (2).
CH3COO— + Na+ + H+ + OH— ↔ CH3COOH + NaOH (3).
CH3COONa + H2O ↔ CH3COOH + NaOH (4).
В данном случае полное и сокращенное ионное уравнения совпали (3). Образование в продуктах реакции NaOH свидетельствует о наличии щелочной среды (рН7).
Занесем данные в таблицу:
| Наиме-нование соли | Формула соли | Тип гидролиза | Уравнение гидролиза в молекулярном и ионном виде | Среда гидролиза |
| Ацетат натрия | CH3COONa | По аниону | CH3COONa ↔ CH3COO— + Na+ (1). H2O ↔ H+ + OH— (2). CH3COO— + Na+ + H+ + OH— ↔ CH3COOH + NaOH (3). CH3COONa + H2O ↔ CH3COOH + NaOH (4) | Щелочная (рН7 |
Вывод: Образование в продуктах реакции NaOH свидетельствует о наличии щелочной среды (рН7).
Вопросы для контроля
Что называется гидролизом?
Какие вы знаете типы гидролиза?
Какие соли не подвергаются гидролизу? Почему?
Форма контроля выполнения практического задания:
Выполненная работа представляется преподавателю в тетради для выполнения практических и контрольных работ по дисциплине «Естествознание».
3