ПРАКТИЧЕСКАЯ РАБОТА № 2 9 класс
ПОЛУЧЕНИЕ СОЛЯНОЙ КИСЛОТЫ И ИЗУЧЕНИЕ ЕЕ СВОЙСТВ
Цель работы: Получить соляную кислоту. Изучить ее свойства, научиться отличать соляную кислоту и ее соли от других кислот и солей.
Оборудование: лабораторный штатив с лапкой, спиртовка, спички, пробирки, газоотводная трубка, вата.
Реактивы: NaCl (крист.), H2SO4 (конц.), AgNO3 (р-р), Mg, NaCl (р-р), CaCl2 (р-р), CuO (тв.), CuSO4(р-р), NaOH (р-р), СaCO3(тв.), вода, лакмус.
Ход работы:
I. Инструктаж по технике безопасности перед началом работы
II. Выполнение работы
1. Получение соляной кислоты
В пробирку насыпать немного поваренной соли и прилить концентрированную серную кислоту так, чтобы кислота смочила соль. Закрыть пробирку газоотводной трубкой. Укрепить пробирку в лапке штатива (смотри рисунок). Конец газоотводной трубки опустить в пробирку с водой так чтобы он был на расстоянии 0,5 – 1 см от поверхности воды. Затем смесь соли и кислоты осторожно нагреть.
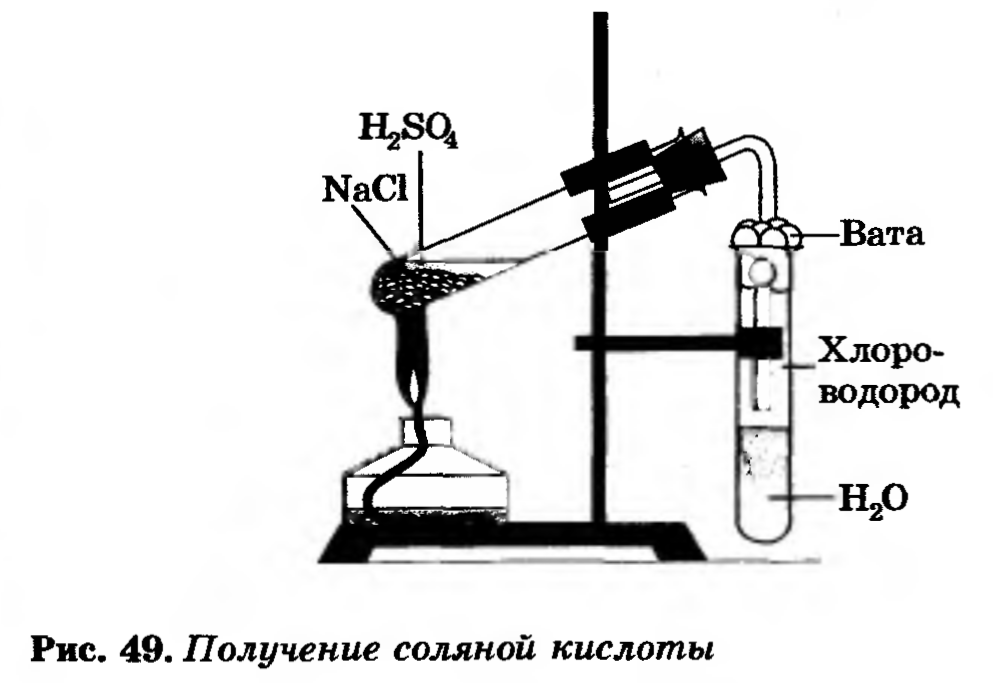
Внимание!
Следите за тем, чтобы газоотводная трубка не касалась воды!
Иначе воду перебросит в горячую пробирку-реактор и стекло лопнет
Наблюдайте за происходящим в пробирке с водой
2. Исследование свойств соляной кислоты
1). Отношение кислоты к индикатору
В пробирку с раствором соляной кислоты HCl добавить лакмус
2). Взаимодействие с металлами
В пробирку с раствором соляной кислоты HCl добавить Mg
Уравнение реакции: Mg + HCl =
3). Взаимодействие с оксидами металлов
В пробирку с раствором соляной кислоты добавить горошину оксида меди CuO
Пробирку немного нагреть (не кипятить!).
Уравнение реакции: CuO + HCl =
4). Взаимодействие с основаниями
В пробирку со свежеосаденным гидроксидом меди (II) Cu(OH)2 1 – 2 мл раствора соляной кислоты (до растворения осадка)
Уравнение реакции: Cu(OH)2 + HCl =
5). Взаимодействие с солями
В пробирку с CaCO3 добавить раствор соляной кислоты HCl
Уравнение реакции: CaCO3 + HCl =
3. Распознавание соляной кислоты и ее солей (качественная реакция на хлориды)
В пробирки с р-ром соляной кислоты и хлорида натрия добавить несколько капель раствора нитрата серебра AgNO3 (качественная реакция на ион хлора Cl-)
Уравнения реакций: HCl + AgNO3 =
NaCl + AgNO3 =
Выполните отчет по работе
(Результаты исследования занести в таблицу)
| Название опыта | Наблюдения | Уравнение реакции (молекулярное, сокращенное ионное) | Вывод |
| 1. Получение соляной кислоты | Выделение газа и растворение его в воде. От поверхности воды вниз опускаются струйки тяжелой жидкости | t NaCl + H2SO4 = | В лаборатории соляную кислоту можно получить при взаимодействии _______ и ________. |
| 2. Исследование свойств соляной кислоты 1). Отношение кислоты к индикатору |
Лакмус __________ |
|
При диссоциации соляной кислоты образуется ион _______(катион) и хлорид ион (________). |
| 2). Взаимодействие с магнием | Растворение металла и выделение газа | Mg + HCl = | Активные металлы вытесняют _______ из раствора соляной кислоты. |
| 3). Взаимодействие с оксидом меди (II) | Растворение оксида меди (II) и образование раствора _____ цвета. | CuO + HCl = | Основный Оксид и кислота при взаимодействии образуют ________ и воду. |
| 4). Взаимодействие с гидроксидом меди (II) | Растворение осадка и образование голубого раствора | Cu(OH)2 + HCl = | При взаимодействии кислоты с основаниями образуется растворимая ________ и вода. |
| 5). Взаимодействие с карбонатом кальция | Выделение газа | CaCO3 + HCl = | При взаимодействии соли и кислоты в одном сосуде – происходит обмен ионами. Реакция между солью и кислотой происходит тогда, когда может образоваться осадок или выделиться газ. |
| 3. Распознавание соляной кислоты и ее солей | Выпадает __________ осадок | HCl + AgNO3 =
NaCl + AgNO3 =
| Реактивом на хлорид ион является раствор ____________ . |
III. Вывод




























