Практическая работа №1
Тема «Приемы обращения с лабораторным оборудованием».
Образовательная цель: знать названия предметов лабораторного оборудования; освоить приемы обращения с лабораторным оборудованием.
Развивающая цель: мышление через постановку вопросов в ходе работы и ответы на вопросы.
Воспитательная цель: воспитывать коммуникативные отношения при работе в паре согласно инструкции; соблюдать дисциплину при выполнении работы.
Оборудование: лабораторный штатив, спиртовка, посуда: пробирки, колбы, химические стаканы; фильтры, воронки, прибор для получения газов.
Дидактический материал: инструкция для работы в паре; таблица «Правила техники безопасности при работе в химической лаборатории».
Знать названия предметов лабораторного оборудования; освоить приемы обращения с лабораторным оборудованием.
1.Чертят таблицу в тетради.
Таблица в тетради.
2.1.Читают правила техники безопасности при работе в химической лаборатории на с.174 в учебнике.
2.2.Сравнивают с правилами в инструкции.
2.3..Задают вопросы.
2.4.Раписываются в журнале по ТБ.
Ознакомлены с правилами по ТБ.
3.1.Изучают устройство лабораторного штативы.
3.2.Выполняют задание, указанное в инструкции.
3.3.Делают схематический рисунок и подписывают части.
В таблице заполнены графы.
2.3.Читают ст. «Использование лабораторного штатива».
Выполняют описанные в ней действия.
Собран штатив и закреплена пробирка.
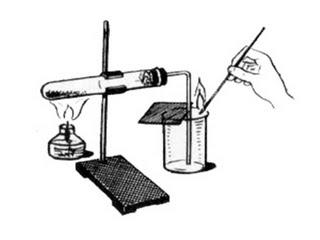
3.1.Читают ст. «Приемы работы со спиртовкой».
3.2.Оформляют таблицу.
В таблице заполнены графы.
4.1.Читают ст. «Посуда».
В таблице заполнены графы..
4.Итог урока
Инструкция для учащихся:
1.Прочитай инструкцию по технике безопасности при работе в химической лаборатории на с.174-175.
2.Обсудите вопросы, возникшие после чтения. Сформулируйте их для учителя. Задайте вопросы учителю.
3.Распишитесь в журнале по ТБ.
4.Начертите таблицу в тетради.
5.На с. 175 прочтите текст «Устройство лабораторного штатива».
6.Сделайте схематический рисунок и подпишите части.
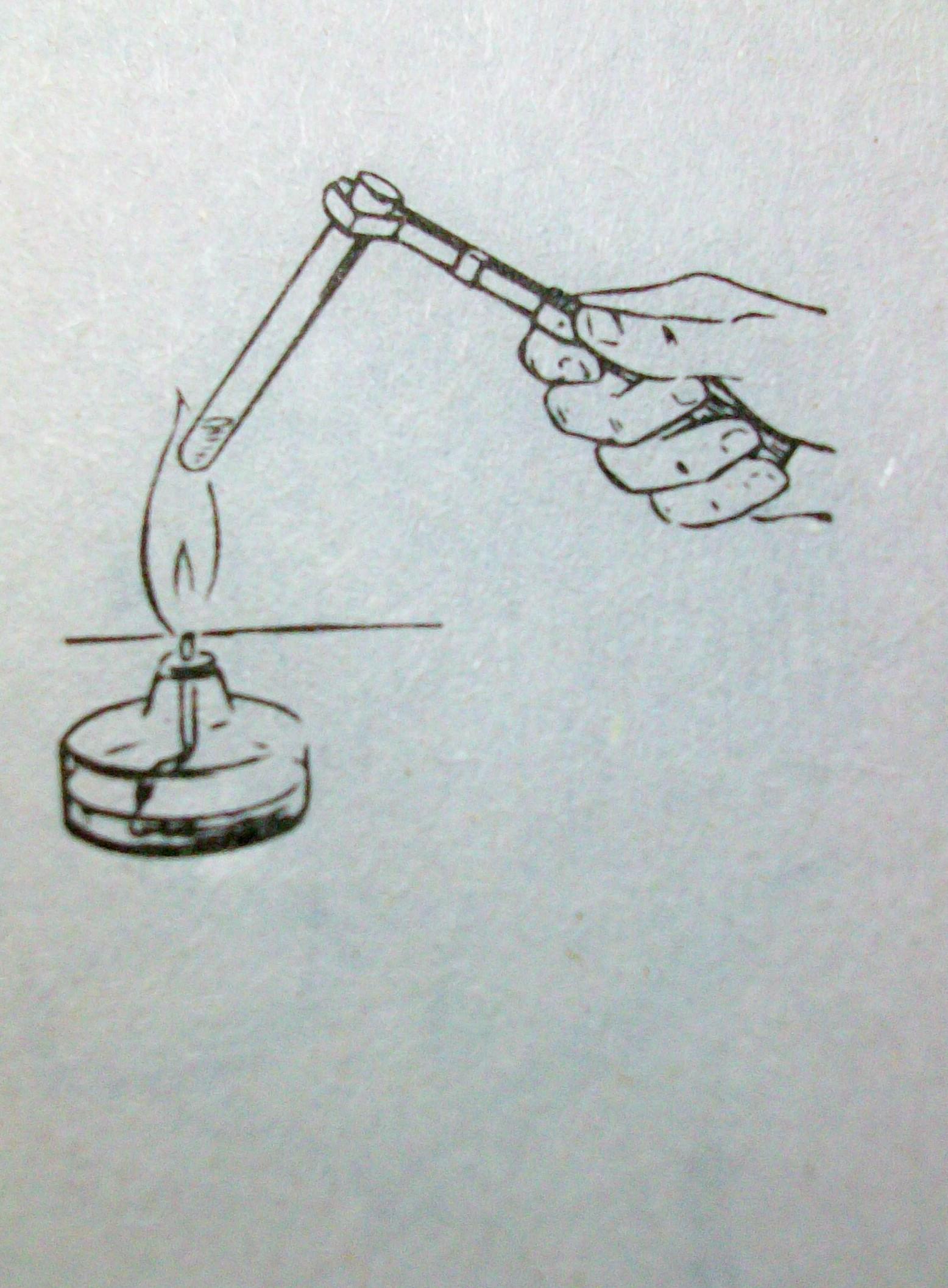
7.Используя текст «Использование лабораторного штатива» закрепите в лапке штатива пробирку под углом в 45 градусов и на расстоянии 15см от стола. Ответьте на вопрос: Как правильно расположить винт муфты на стержне штатива? Как правильно закрепить пробирку?
8. Прочтите текст «Приемы работы со спиртовкой». Сделайте рисунок и подпишите части. Ответьте на вопросы: Как спиртовку зажигают? Как спиртовку гасят?
9. Прочтите текст «Посуда». Сделайте рисунок, подпишите название. Ответьте на вопросы: Сколько должно быть жидкости в пробирке при перемешивании? Что запрещается? Когда используют воронку? Как готовят фильтр к фильтрованию? Какой объем жидкости должен быть в чашке для выпаривания? Как готовится прибор для получения газов к работе?
10.Сделайте вывод по итогам работы.
Таблица №1
№/п
Название этапа работы
Рисунок и название частей оборудования.
Приемы работы с лабораторным оборудованием.
1.
Приемы работы с лабораторным штативом
Рис.113
1.Винт, закрепляющий муфту находится справа от стержня штатива, а стержни лапки укреплялись бы так, чтобы их поддерживал не только винт, но и муфта.
2.Пробирку закрепляют ближе к горлышку.
Вывод: освоил приемы работы с лабораторным оборудованием.
2.Приемы работы со спиртовкой
Рис.№114
1.Нельзя зажигать спиртовку от другой горящей спиртовки.
2.Гасят спиртовку накрывая ее колпачком с боку.
3.
Приемы работы с посудой.
Рис.№115
1.Высота столбика жидкости при перемешивании растворов в пробирке не должна превышать 2 см.
2.Запрещается встряхивать пробирку, закрывая отверстие пальцем.
3.Фильтр перед употреблением смачивают.
4.В чашку наливают 1/3 объёма для выпаривания.
5.Проверить прибор на герметичность.
3.Пробирка укреплена правильно, если ее можно повернуть в лапке без больших усилий.
Выводы:
Практическая работа №1
Тема : «Приемы обращения с лабораторным оборудованием. Изучение строения и свойств пламени»
Цель: рассмотреть основные составные части штатива, спиртовки. Изучить правила безопасного обращения с нагревательными приборами. Изучить строение и свойства пламени.
Оборудование: Штатив, спиртовка, пробирка, держатель для пробирок, асбестовая сетка, лучинка, спички, штатив для пробирок, асбестовая сетка.
Ход работы:
Задание №1.
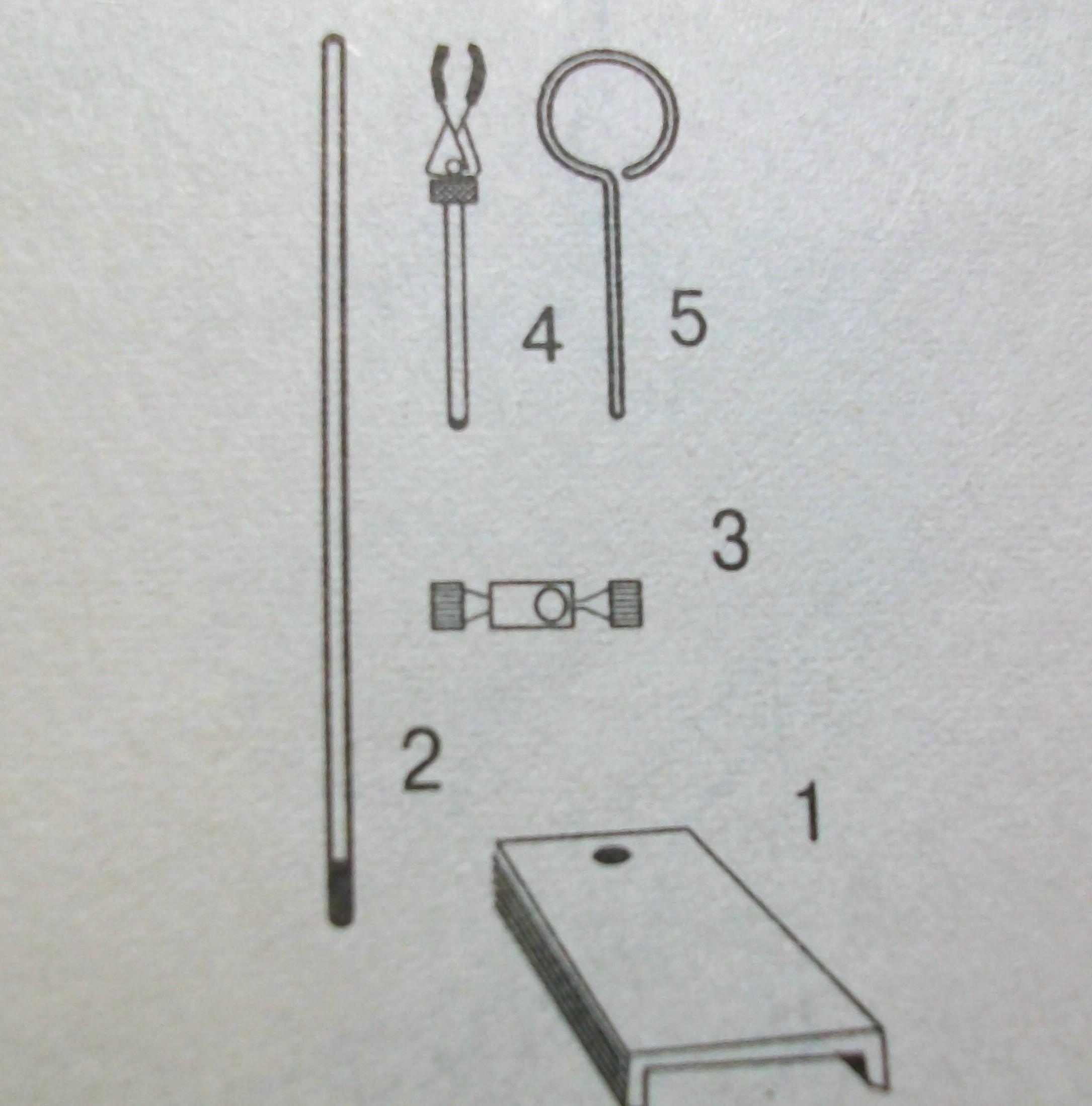
1. Пользуясь рисунком, выберите детали для монтажа лабораторного штатива:
1 – основание 2- стержень 3 – муфта с винтами 4 – лапка 5 – кольцо
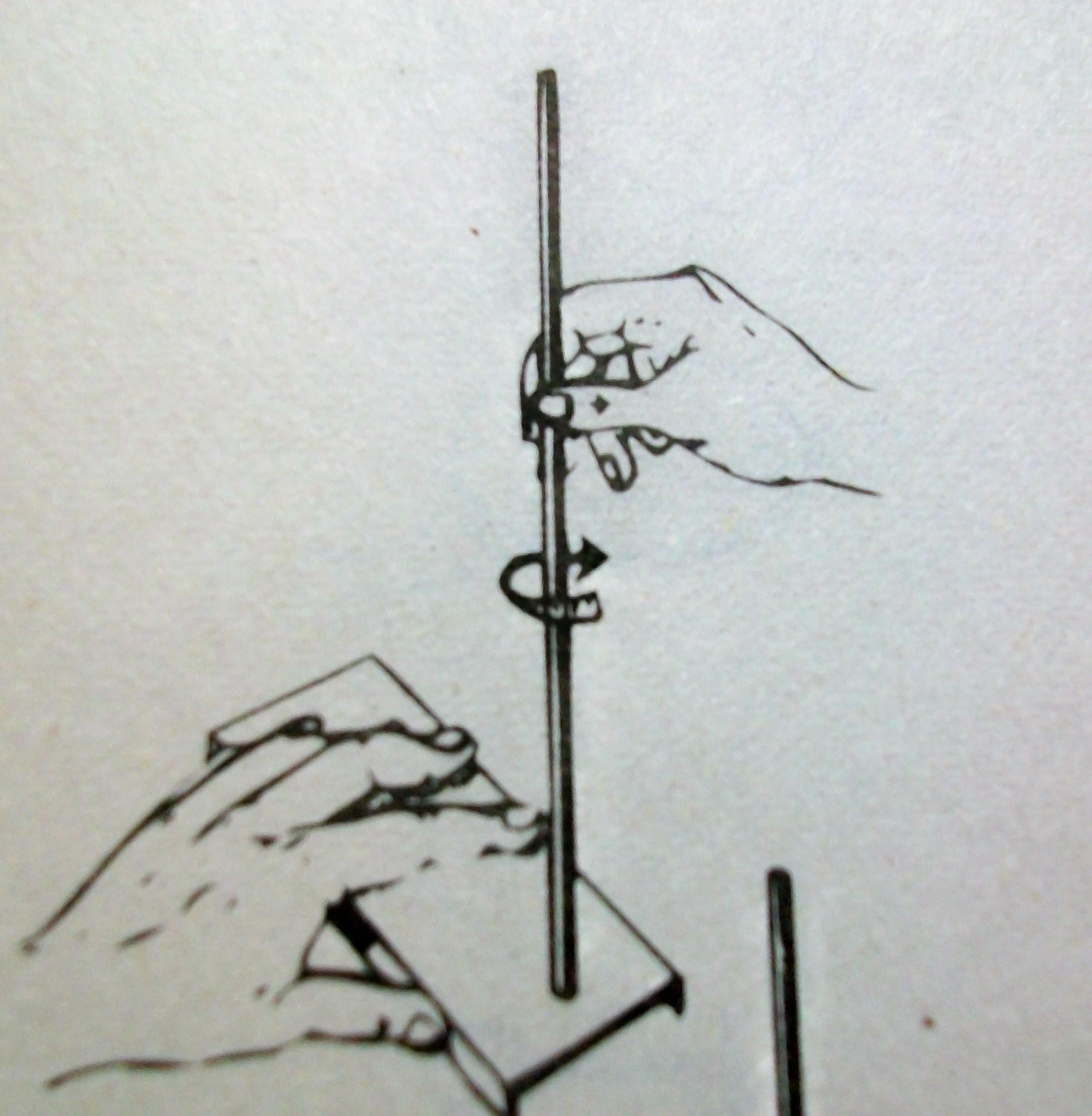
2. Ввинтите (по часовой стрелке) стержень в основание штатива.
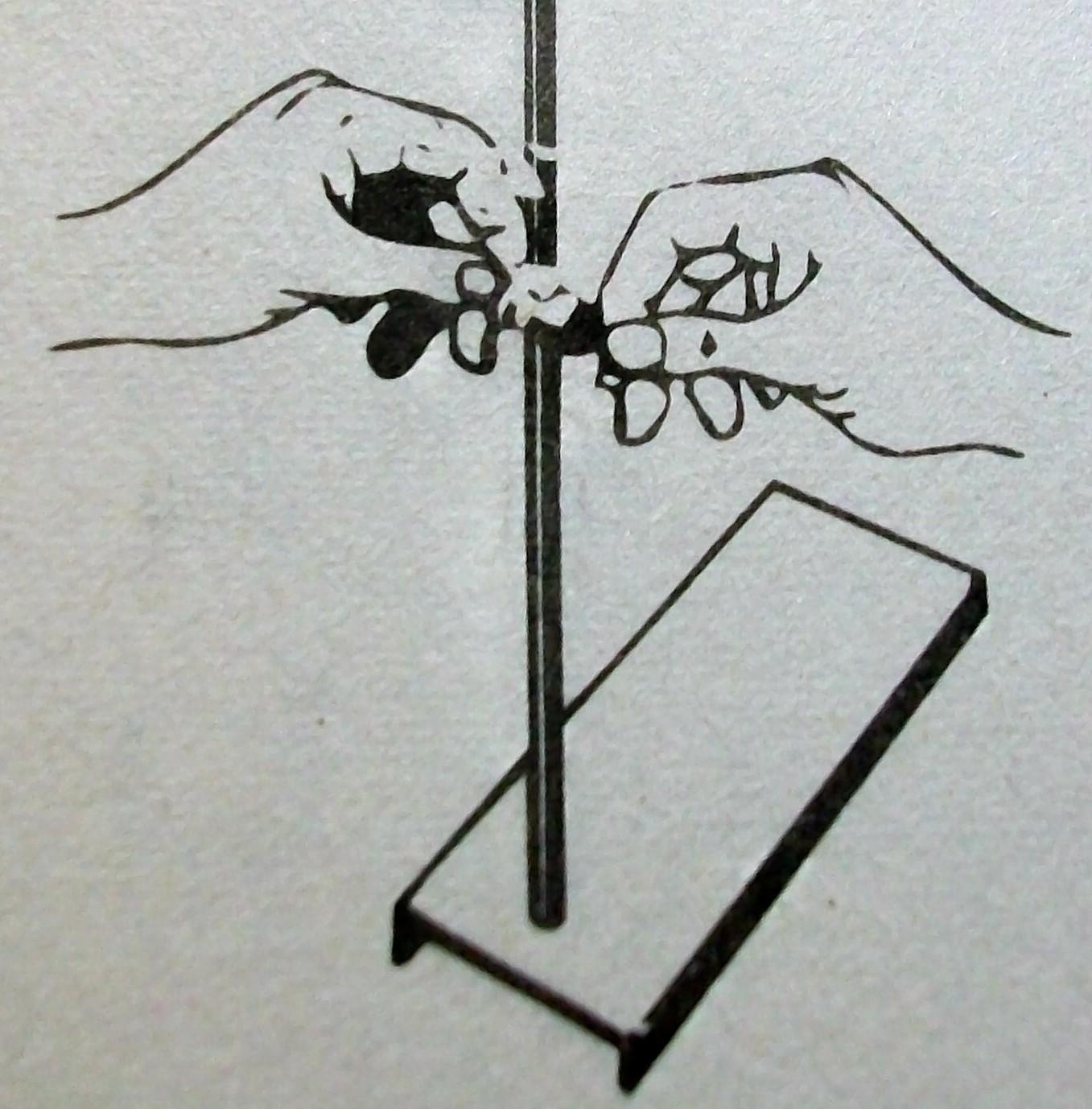
3. Наденьте муфту на стержень штатива, закрепите ее с помощью винта.
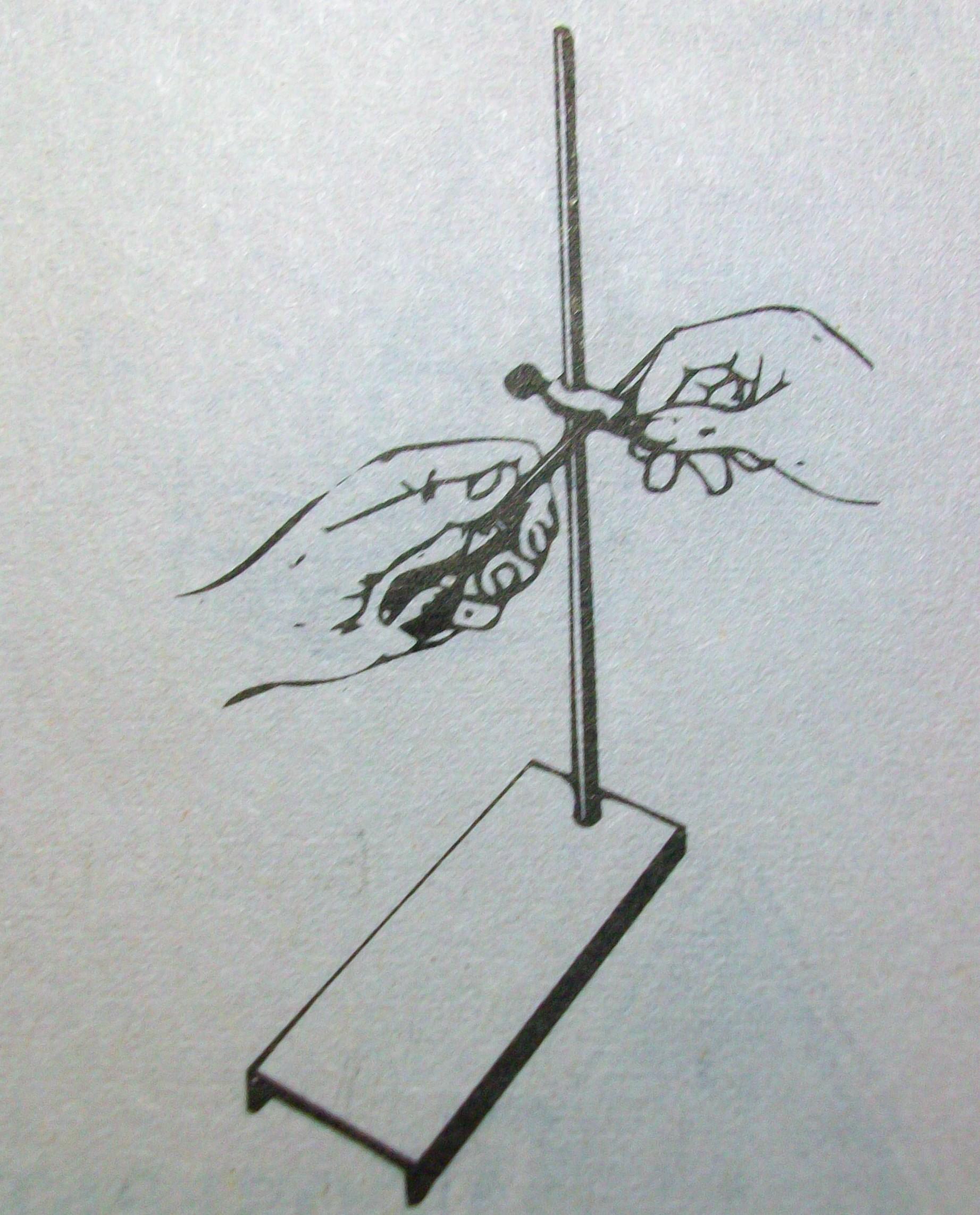
4. Закрепите лапку в муфте с помощью винта.
5. Вставьте пробирку в лапку. Поворачивайте винт лапки правой рукой до закрепления пробирки, при этом левой рукой проверяйте жесткость крепления.
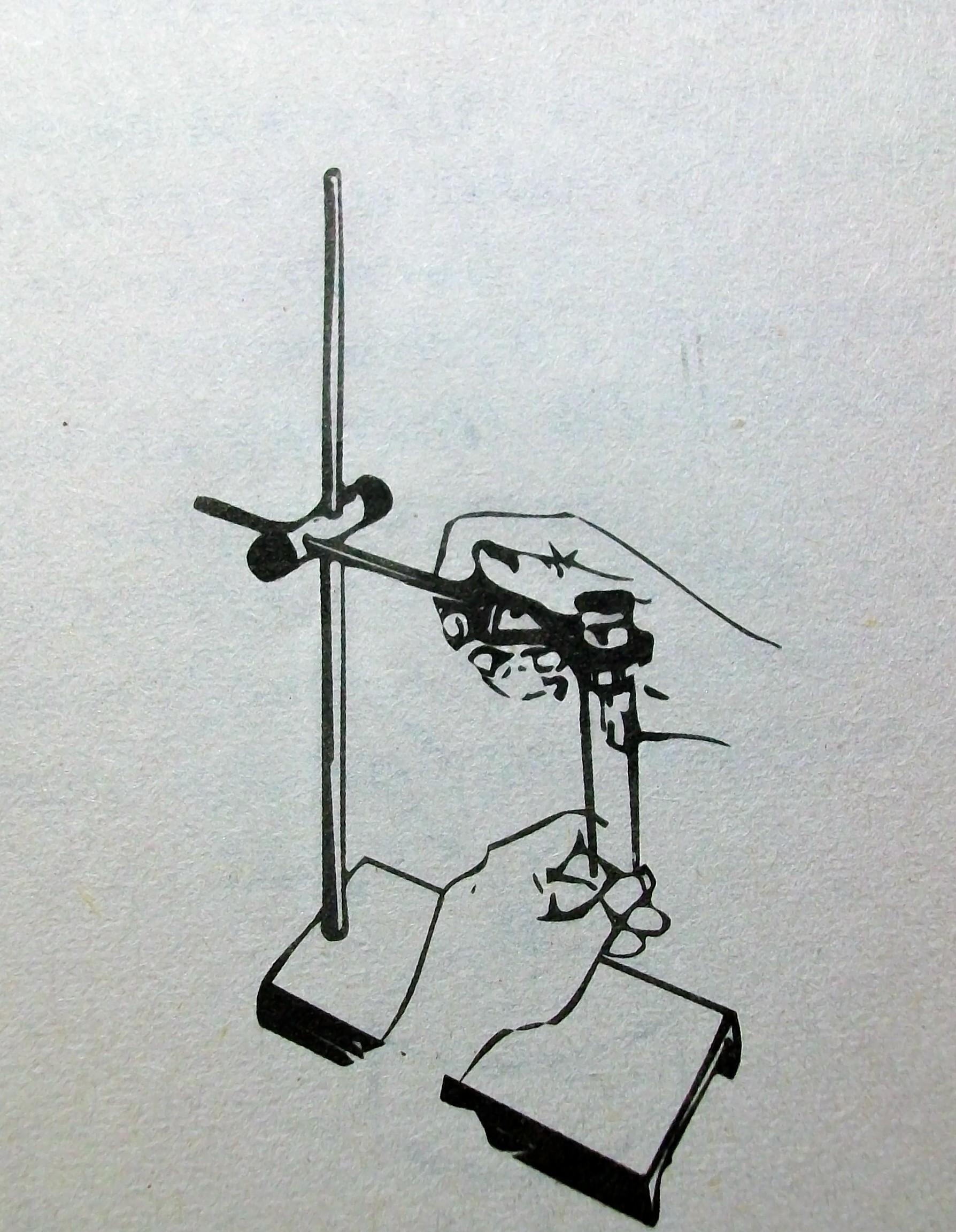
ВНИМАНИЕ: Пробирка закреплена правильно, если она не выпадает из лапки и может
быть слегка повернута вокруг своей оси.
Задание №2.
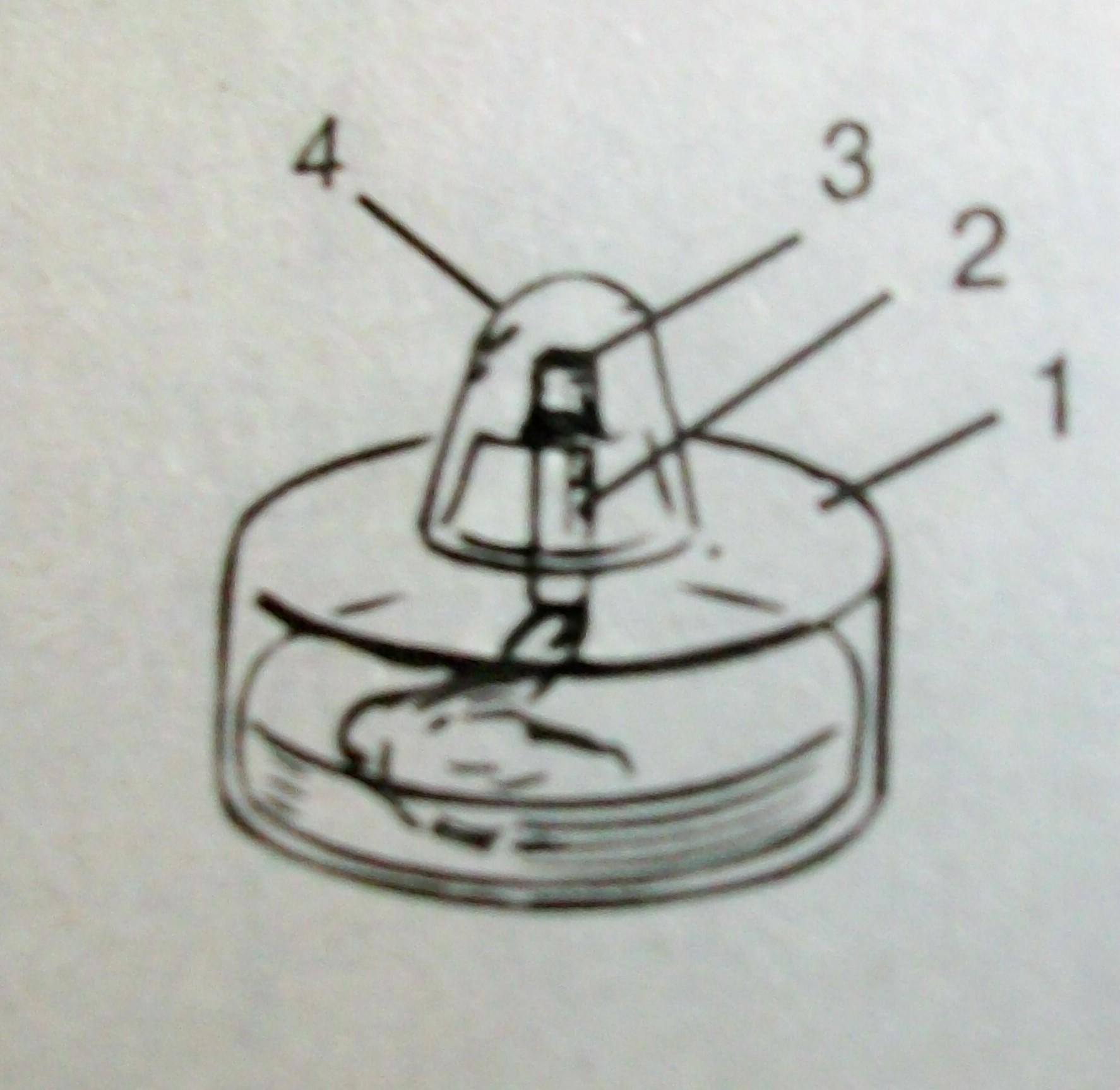
1. Рассмотрите спиртовку. Согласно рисунку определите ее составные части. 1 – резервуар. 2 – трубка с диском 3 – фитиль 4 – колпачок.
ПРОВЕРЬТЕ: 1/Правильность заполнения спиртовки на 2/3 ее объема спиртом. 2/Состояние фитиля: ровно подрезан, длина его над диском – 1,5 см.
3/Положение фитиля в трубке – неплотно прилегает к трубке.
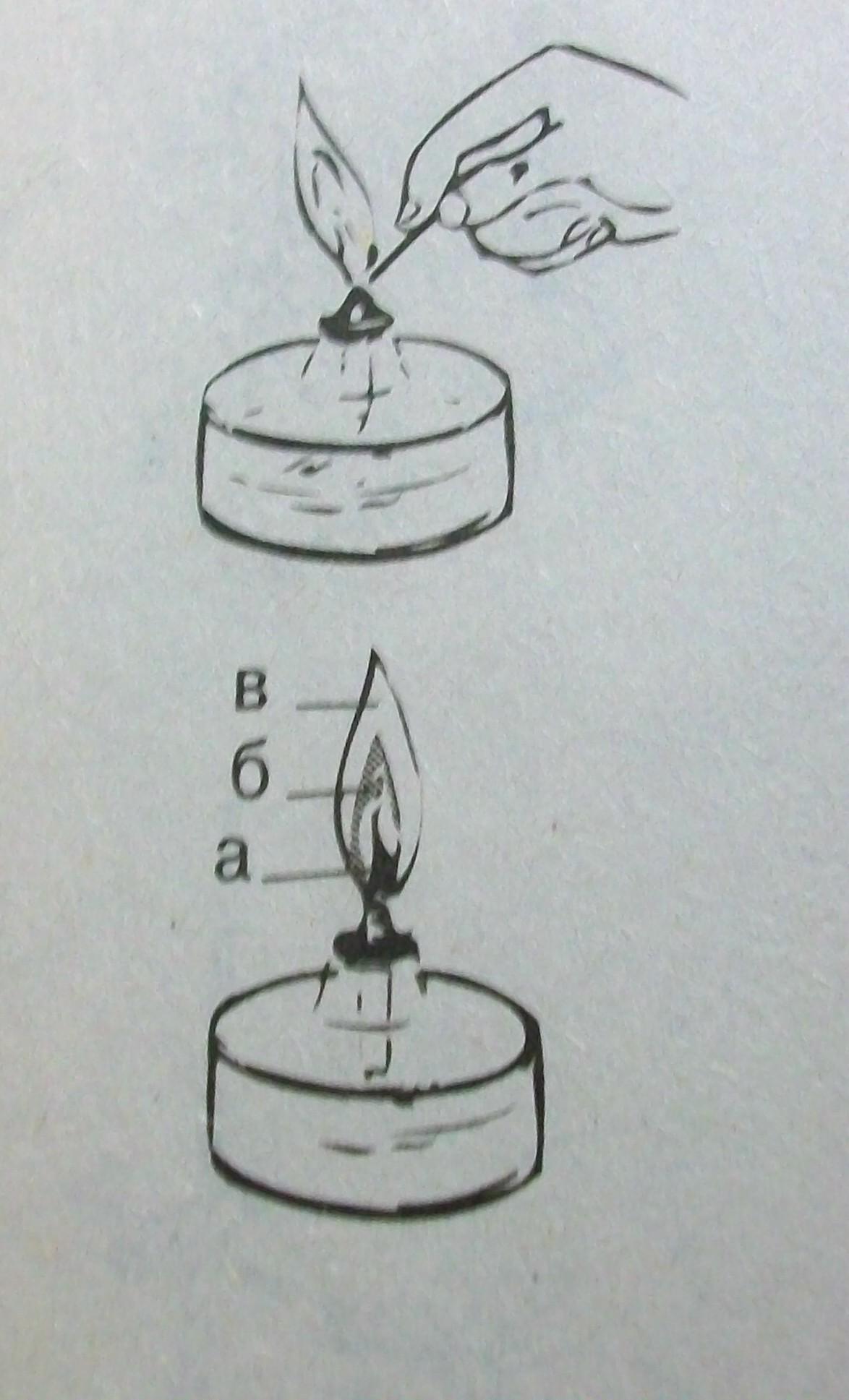
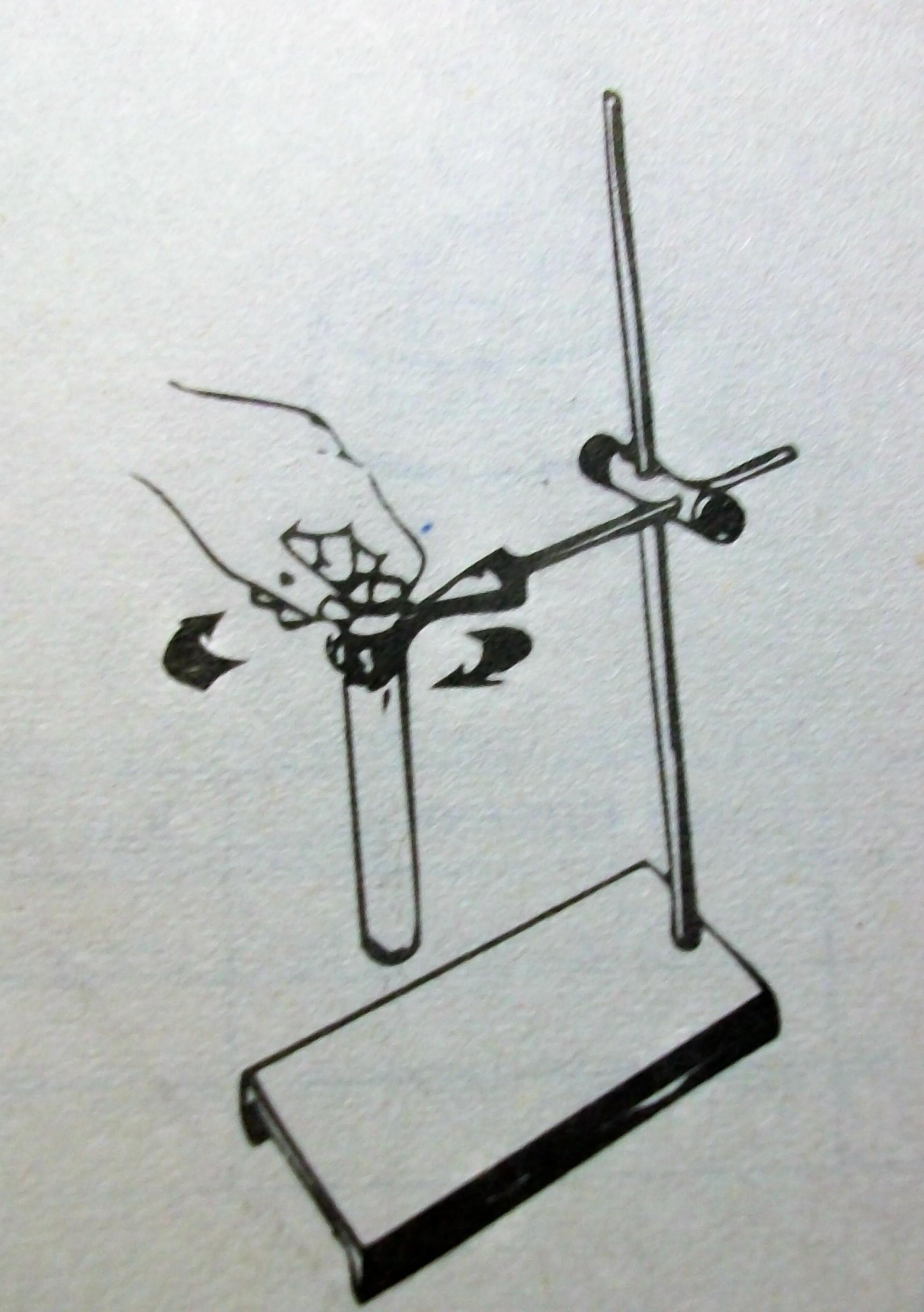
2. Зажгите спиртовку спичкой или горящей лучинкой. Рассмотрите пламя. Сколько зон в пламени можно выделить? Исследуйте каждую зону пламени, внося в нее лучинку. В какой зоне лучинка быстрее загорается? Какой частью пламени следует пользоваться при нагревании?
3.Налейте в пробирку на 1/5 ее высоты воду. Поместите пробирку в держатель. Внесите
пробирку в самую горячую часть пламени.
ВНИМАНИЕ: Нагревайте осторожно сначала всю пробирку, а затем, не вынимая ее из пламени, ту часть, где находится вещество. Направляйте отверстие нагреваемой пробирки в сторону от себя и соседей. Избегая выбрасывания жидкости. Не наклоняйтесь над нагреваемым сосудом.
4. Погасите спиртовку, накрыв пламя колпачком.
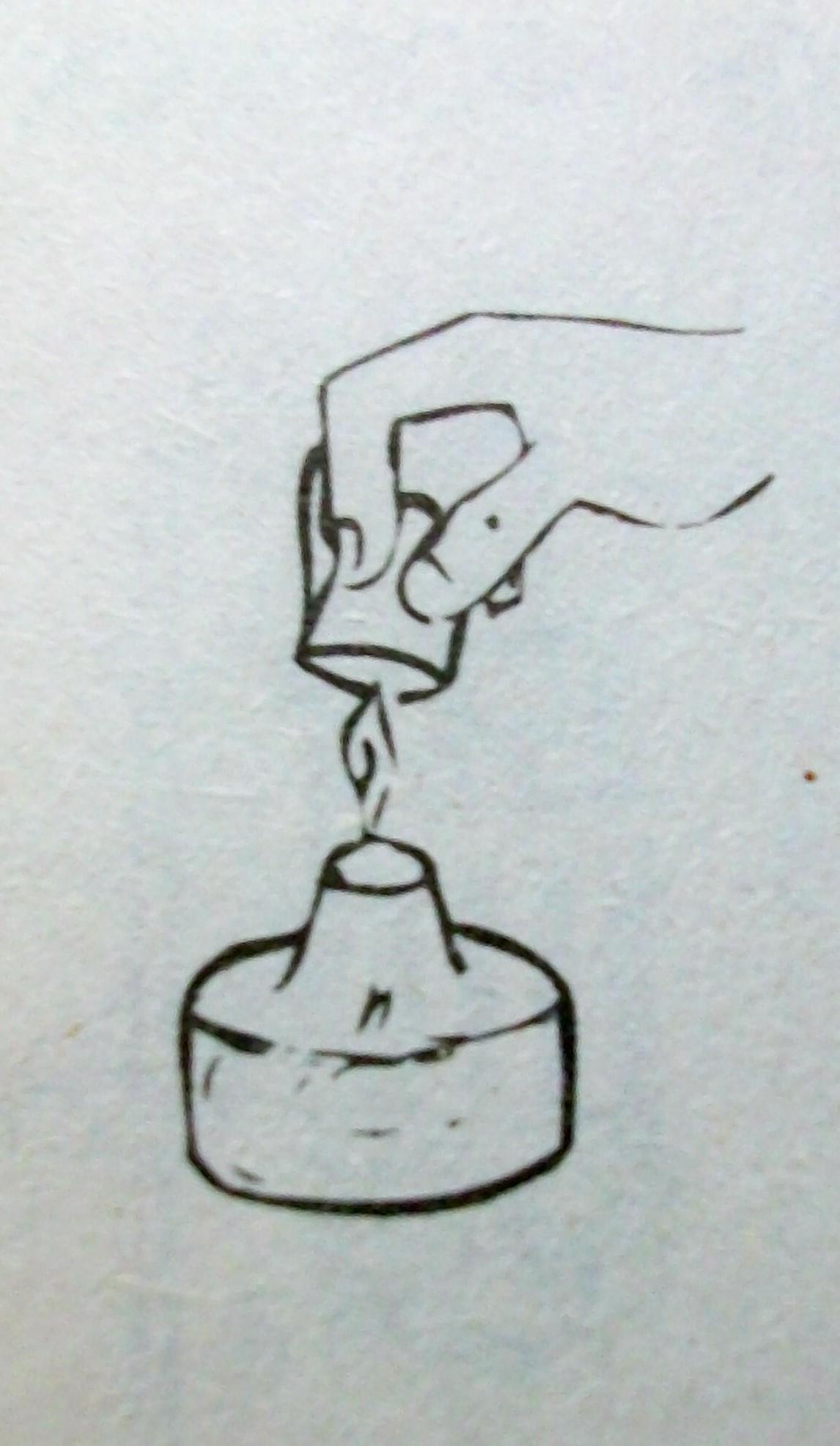
ПОМНИТЕ: При пользовании спиртовкой запрещается:
Гасите спиртовку только накрывая пламя колпачком.
Задание №3. Оформите отчет о проделанной работе по предложенному плану.
Практическая работа № 2
Тема "Очистка загрязнённой поваренной соли"
Цель:Очистить полученный препарат соли от загрязнения.
Научиться методу фильтрования
Оборудование: штатив, смесь соли с песком, сткакан со стеклянной палочкой, колба, воронка, фильтр, чашка для выпаривания, стакан с водой, сухое горючее.
Инструктаж по технике безопасности:
Ход работы:
1. Возьмите из банки сухой чистой ложкой загрязнённую соль.
2. Насыпьте в стакан ложкой-дозатором 3 порции соли.
3. Добавьте в стакан воды на 1/2 его высоты.
4. Размешайте осторожно стеклянной палочкой с резиновым наконечником содержимое стакана.
5. Приготовьте фильтр: сложите вчетверо круг фильтровальной бумаги и расправьте его так, чтобы образовался конус.
6. При отсутствии готового фильтра используйте фильтровальную бумагу.
7. Обрежьте ножницами край полученного квадрата так, чтобы получился сектор
8. Вложите фильтр в стеклянную воронку так, чтобы он:
плотно прилегал к её стенкам,
не доходил до края воронки на 0,5 см.


ВНИМАНИЕ! Обрежьте фильтр, если он выходит за край воронки, иначе фильтруемая жидкость будет стекать по внешней стенке воронки!9. Смочите фильтр водой, удерживая воронку наклонно и вращая её над стаканом или чашей.
10. Наливайте фильтруемую жидкость на фильтр по стеклянной палочке, напровив её нижней конец к стенке воронки, а не в середину фильтра, чтобы не прорвать его.
ВНИМАНИЕ! Наливайте в воронку жидкость так, чтобы она не доходила до края фильтра на 0,5 см, т.к. жидкость будет попадать между фильтром и стенкой воронки, не очищаясь от примесей.
11. Вылейте фильтрат (раствор соли) в фарфоровую выпарительную чашку до 1/2 её объёма.
12. Поставьте чашку на кольцо штатива.
13. Зажгите сухое горючее с помощью учителя. нагрейте фильтрат до начала образования кристаллов поваренной соли.


ВНИМАНИЕ! Снимайте горячую чашку с кольцами тигельными щипцами! Ставьте её на огнезащитную подставку!
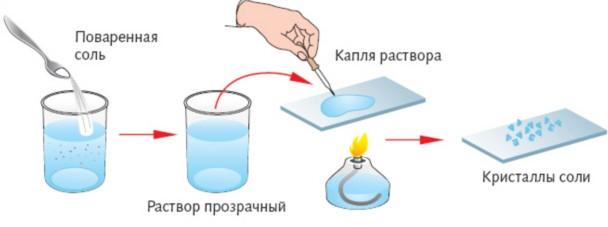
14. Оформите отчёт о проделанной работе в виде таблицы.
15. Приведите в порядок своё рабочее место: демонтируйте штатив, разместите на своих местах принадлежности и посуду!
Практическая работа №3 Получение водорода и его сжигание.
Цель: научиться получать водород, изучать физические и химические свойства водорода, совершенствовать приемы работы с лабораторным оборудованием и с веществами;
воспитывать самостоятельность, аккуратность, трудолюбие, сотрудничество, наблюдательность, прилежность, внимание;
учащиеся должны уметь собирать установку для получения водорода, проверять на чистоту, уметь оформлять результаты практической работы, делать правильные выводы из наблюдаемых опытов.
Приборы: пробирки, газоотводная трубка, спички, штатив.
Реактивы: цинк, соляная кислота.
Требование безопасности при работе:
осторожно с кислотой, с огнём, стеклянной посудой, вещества брать в малой дозе, соблюдать порядок и тишину, не мешать соседа.
Ход работы:
| Физические свойства | Химические свойства |
| Молекула водорода двухатомна-H2. При обычных условиях – это газ без цвета, запаха и вкуса. Самый легкий газ, его плотность в 14,5 раза меньше плотности воздуха. Обладает высокой теплопроводностью, как самые легкие молекулы движутся быстрее. По распространенности во Вселенной занимает первое место. На Земле находится в виде соединений. Значение водорода велико, как и кислорода. | Молекулы водорода довольно прочны. Чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия. Реагирует только с очень активными металлами, образуя гидрид. Са+H2=CaH2 Взаимодействует с неметаллом-фтором, образуя фтороводород.F2+H2=2HF При нагревании он отнимает кислород от некоторых оксидов. CuO+H2=Cu+H2O |
| Что делаю | Наблюдения | Уравнение реакции | Вывод |
| 1.Получение водорода. Осторожно опускаем в пробирку 3-4 кусочков цинка, закрепим пробирку в штативе. Наливаем соляную кислоту (2–3 см.). Пробирку закрываем пробкой с газоотводной трубкой. На верхний конец трубки надеваем сухую пробирку. 2.Проверка водорода на чистоту. Через минуту снимаем пробирку с трубки и, не переворачивая, поднесем её отверстием к пламени. 3.Горение водорода. Поднесем горящую спичку к концу газоотводной трубки. 4.Над пламенем горящего водорода держим перевёрнутый вверх дном стакан. | 1.Выделяется газ. Так как газ легче воздуха, поэтому пробирку-приемник устанавливаем вверх дном. 2. Если водород сгорит с легким глухим хлопком, то это доказывает, что он чистый. Если раздастся свистящий звук, то водород смешан с кислородом воздуха. Поджигать такой водород нельзя. Он может взорваться. 3.Водород горючий газ, поэтому горит. 4. Внутренняя стенка стакана запотевает. | Zn+2HCl=ZnCl2+H2 2H2+O2= 2H2O | Атомы металла вытеснили атомы водорода из молекулы кислоты. При взаимодействии молекул водорода с молекулами кислорода образуется молекулы воды в виде пара. |
Промышленный способ получения водорода. Реакция метана с водой при высокой температуре.CH4+2H2O=CO2+4H2 — 165кДж.
Лабораторный способ. Разложение воды электрическим током. 2H2O=2H2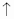 +O2
+O2
Вывод работы. Научились получать водород. Изучили физические и химические свойства водорода.
| Практическая работа №3 Тема: Получение и свойства кислорода | Цель работы: Получить кислород (методом вытеснения воздуха) и изучить его свойства. | Необходимое оборудование и реактивы | | Оборудование: |
| | 
| штатив лабораторный с лапкой; спиртовка (или электронагреватель); два химических стакана; стеклянная пластинка; пробирка; шпатель (ложка); пробка с газоотводной трубкой; промывалка с водой; ложка для сжигания веществ; спички; лучинка; вата. | | Вещества: |
|
| Меры предосторожности | |
| Работа с нагревательными приборами | | 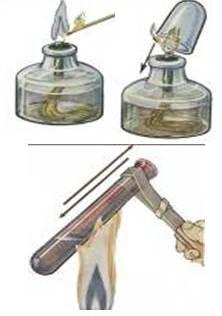
| | | | | | При нагревании не забудьте прогреть пробирку. Для этого пробирку, закрепленную в лапке штатива, медленно проведите сквозь пламя от донышка до отверстия и обратно. Эту операцию повторите несколько раз: чтобы стекло равномерно прогрелось. Признаком прогрева стекла можно считать исчезновение запотевания на стенках пробирки. | | | | | |
|
| |
| | Работа со стеклом: | | | | |
| Ход работы | | 
| 1. Проверьте прибор на герметичность. Закройте пробирку пробкой с газоотводной трубкой, опустите конец трубки в стакан с водой. Плотно обхватите ладонью пробирку и внимательно следите за появлением пузырьков воздуха. | | 
| 2. Выньте пробку из пробирки. | | 3. Насыпьте в пробирку перманганат калия. Твердого вещества должно быть 1-1,5 см по высоте пробирки. | | 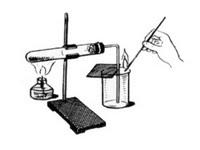
| 4. Около отверстия пробирки поместите очень рыхлый комочек ваты и закройте пробирку пробкой с газоотводной трубкой. | | 5. Закрепите пробирку в лапке штатива так, чтобы газоотводная трубка была направлена вниз. | | 6. Опустите газоотводную трубку в стакан до самого дна. | | 7. Прогрейте пробирку. | | 8. Нагревайте перманганат калия. | | 9. Подожгите лучинку, дождитесь появления на конце красного уголька и тут же погасите. | | 10. Поднесите тлеющую лучинку к краю стакана. Если лучинка вспыхнет, прекратите нагревание перманганата калия, но не гасите спиртовку. | | 11. Выньте газоотводную трубку из стакана. Стакан закройте стеклянной пластинкой. | | 12. Положите уголек в ложку для сжигания веществ. | | 13. Раскалите уголек в пламени спиртовки. | | 14. Погасите спиртовку. | | 15. Сдвиньте стекло и опустите в стакан ложку с раскаленным углем. НЕ КАСАЙТЕСЬ ДНА ИЛИ СТЕНОК СТАКАНА! | | 16. После того, как уголь сгорит, прилейте в стакан известковую воду. | | 17. Оформите отчет о работе. | ВЫПОЛНЕНИЕ РАБОТ
1. Получение кислорода : Кислород( O 2 ) в лаборатории получают разложением перманганата калия KMnO 4 (марганцовки). Для опыта понадобится пробирка с газоотводной трубкой. В пробирку насыпаем кристаллический перманганат калия. Для сбора кислорода приготовим колбу. При нагревании перманганат калия начинает разлагаться, выделяющийся кислород поступает по газоотводной трубке в колбу. Кислород тяжелее воздуха, поэтому не покидает колбу и постепенно заполняет ее. Тлеющая лучинка вспыхивает в колбе: значит нам удалось собрать кислород. 2 KMnO 4 = K 2 MnO 4 + MnO 2 + O 2 ↑ Чистый кислород впервые получили независимо друг отдруга шведский химик Шееле (при прокаливании селитры) и английский ученый Пристли (при разложении оксидов ртути и свинца). До их открытия ученые считали, что воздух ‑ однородная субстанция. После открытия Шееле и Пристли Лавуазье создал теорию горения и назвал новый элемент Oxygenium (лат.) – рождающий кислоту, кислород. Кислород - необходим для поддержания жизни. Человек может выдержать без кислорода всего несколько минут.
2. Обнаружение кислорода Кислород поддерживает горение - это свойство кислорода используется для его обнаружения
3. Горение угля в кислороде Кислород активно взаимодействует со многими веществами. Посмотрим, как реагирует кислород с углем. Для этого раскалим кусочек угля на пламени спиртовки. На воздухе уголь едва тлеет, потому что кислорода в атмосфере около двадцати процентов по объему. В колбе с кислородом уголь раскаляется. Горение углерода становится интенсивным. При сгорании углерода образуется углекислый газ: С+О2= СО2 Добавим в колбу с газом известковую воду – она мутнеет. Известковая вода обнаруживает углекислый газ. Вспомните, как разжигают гаснущий костер. Дуют на угли или интенсивно обмахивают их для того, чтобы увеличить подачу кислорода в зону горения.
|
Комментарии _displayNameOrEmail_ - _time_ - Удалить _text_ |
Практическая работа №4 Тема: Получение кислорода и изучение его свойств.
Цель: научиться получать, собирать кислород методом вытеснения воды и методом вытеснения воздуха; изучение физических и химических свойств кислорода; горение угля в кислороде и на воздухе; совершенствовать приемы безопасной работы, проверкой прибора на герметичность.
самостоятельность, аккуратность, трудолюбие, сотрудничество, наблюдательность.
умение составлять уравнения химических реакций, умение делать выводы, соблюдать правила техники безопасности.
Приборы:
пробирки, газоотводная трубка, стакан химический, ложечка для сжигания,стеклянная пластина, вата, пробка, сухое горючее,спички.
Реактивы:
Перманганат калия, сосуд с водой, уголь.
Знакомство с инструкцией №1, №7.стр51.
Ход работы:
1. В пробирку с перманганатом калия положим комок ваты и закроем пробкой с газоотводной трубкой и проверим прибор на герметичность. Для этого, опустим газоотводную трубку в воду, нагреем ладонью пробирку. Если прибор герметичный, то из газоотводной трубки выйдет пузырек воздуха.
2.Закрепим пробирку в штативе в горизонтальном положении. Сначала прогреем всю пробирку, затем прокалим ту часть, где находится перманганат калия. Кислород плохо растворяется в воде, поэтому пузырьки кислорода, выходящие из газоотводной трубки, будут вытеснять воду из пробирки. Газоотводную трубку следует вынуть из воды, не прекращая нагревания пробирки с перманганатом калия. Если вы собираете кислород методом вытеснения воды, то не прекращаете нагревание, пока газоотводная трубка находится под водой!
3. С помощью тлеющей лучинки докажем наличие кислорода в пробирке. Если лучина вспыхивает ярко, то в пробирке есть кислород. Так как кислород - бесцветный газ, плотность кислорода больше плотности воздуха, малая растворимость в воде.
4. Получение кислорода. Нарисовать рис.37 и 38. Стр. 111!
2 KMnO4K2MnO4+MnO2+O2^
2H2O22H2+O2^
2KClO32KCl+3O2^
5. Горение угля, простого вещества в кислороде.
C+O2CO2
6. Горение серы:, напишите уравнение:__________________________
Горение метана:
CH4+2O2CO2+2H2O
Вывод.
Научились получить кислород 2спосабами: методом вытеснения воздуха и методом вытеснения воды. Познакомились физическими свойствами кислорода. Научились составлять уравнения химических реакций, характеризующие химические свойства кислорода. Вещества в кислороде горят лучше. При взаимодействии сложных веществ с кислородом образуются углекислый газ и вода.
Отчет можно оформить в виде таблицы.
| Что делали | Что наблюдали | Уравнения реакций | Вывод |
| 1Получение кислорода 2Горение угля в кислороде 3 Горение лучины в кислороде |
|
|
|

| Практическая работа № 5 Приготовление растворов солей с определённой массовой долей растворённого вещества. Цель: - научиться практически готовить растворы с заданной массовой долей растворённого вещества. Задачи: - повторить и использовать правила ТБ при выполнении практических работ в кабинете химии, -повторить и практически применить знания о растворах и массовой доле растворённого вещества, - познакомиться с устройством лабораторных весов и правилами взвешивания, -формировать коммуникативные компетентности. Оборудование и реактивы: Весы лабораторные, химические стаканы (V = 50мл), стеклянные палочки, керамические ложечки, мерные цилиндры (V = 100мл), мензурки (V =50мл), дистиллированная вода, хлорид натрия (тв.), хлорид калия (тв.),карбонат натрия (тв.)
| | I –вариант Приготовить 20 г. водного раствора поваренной соли с массовой долей соли 5%. | II –вариант Приготовить 25 г. водного раствора хлорида калия с массовой долей соли 4%. | III –вариант Приготовить 10 г. водного раствора карбоната натрия с массовой долей соли 10%. | Ход урока. I. Организационный момент. II. Постановка цели урока. III. Основная часть урока. (Теоретическая часть) - Ребята, вы дома готовились к практической работе и должны были в ходе подготовки выполнить теоретические расчёты, необходимые для её проведения в соответствии с вариантами ( рядами) в рабочих тетрадях. - Я проверю наличие расчётов, проходя между рядами, откройте рабочие тетради. - Пока я это делаю вспомните и скажите, что такое массовая доля растворённого вещества? (Это отношение массы растворённого вещества к массе раствора) - Что говорит о растворе его массовая доля? ( Она показывает содержание растворённого вещества в 100 граммах данного раствора) - Давайте сравним массы растворённого вещества в трёх вариантах.(В каждом варианте масса растворённого вещества равна 1 грамму.) - Почему же массовые доли растворённого вещества в трёх растворах разные? (Массы растворителя в каждом случае разные) - Перепишите расчёты масс растворённого вещества и воды в виде задачи в тетрадь для практических работ – эта решённая задача является частью оформления практической работы. IV. Динамическая пауза. V. Основная часть урока. (Практическая часть) - Практическую часть начнём с проверки знаний правил ТБ, которые важно помнить при выполнении работы. 1) Нельзя пробовать вещества на вкус. 2) Нельзя брать вещества руками. 3) Если взяли реактива больше, чем требуется, нельзя высыпать ( выливать) обратно в банку (склянку). 4) Нюхать вещества с осторожностью. 5) Работать аккуратно и внимательно , соблюдая порядок и дисциплину. 6) По окончанию работы привести в порядок рабочее место и вымыть руки с мылом.) - Распишитесь в журнале по ТБ. - Откройте коробку с весами, соберём чашечные весы, повторяя за мной все действия.(Повесить весы за кольцо на крючок, укрепить чашки на серьгах коромысла, уравновесить чашки с помощью регулирования длины плеч коромысла) - Все гирьки весов называются разновесом. Их следует брать специальным пинцетом. - На правую чашку весов ставится гирька нужной массы, а на левую аккуратно насыпается твёрдое вещество. - Взвесьте необходимую массу твёрдой соли, пользуясь этим правилом взвешивания.(Согласно расчёту 1 грамм.) - Взвешенную соль высыпьте в химический стакан(V=50 мл.) - Ребята, что дальше необходимо сделать для приготовления нужного раствора? (Отмерить мерным цилиндром или мензуркой рассчитанный объём дистиллированной воды.) - Почему объём воды равен её расчётной массе?( так как плотность воды равна 1гр ⁄ мл) - Вылейте воду в стакан с твёрдой солью и перемешайте стеклянной палочкой до полного растворения соли. - Что вы получили? (Однородную бесцветную жидкость, которая является раствором данной соли с определённой массовой долей растворённого вещества) - Составьте краткое описание выполненной работы и самостоятельно сформулируйте вывод о том, как приготовить раствор с определённой массовой долей растворённого вещества. - Ребята, сдайте тетради для практических работ, приведите в порядок рабочее место (Разобрать весы, вымыть и поставить на место химическую посуду) и вымойте руки с мылом. VI. Итог урока.- Чему вы сегодня учились на уроке? (Приготовлению растворов с определённой массовой долей растворённого вещества). - Какие действия для этого следует выполнить? ( Провести расчёт масс растворённого вещества и воды, необходимых для приготовления раствора, взвесить нужную массу твёрдого вещества, отмерить объём воды, эту смесь перемешать до полного растворения твёрдого вещества.) - Повторить устно и одному из учеников написать на доске вывод о последовательности действий при приготовлении растворов с определённой массовой долей растворённого вещества. - Где можно воспользоваться умением готовить растворы с определённой массовой долей растворённого вещества? (При приготовлении сахарных сиропов, маринадов.) VII. Выводы:
|
Практическая работа №5 Тема: Обобщение сведений о классах неорганических соединений.
Цель изучить свойства веществ, зкрепить основные признаки и условия протекания химических реакций, научиться составлять уравнения химических реакций, делать выводы из наблюдений, совершенствовать приемы работы с веществами и лабораторными оборудованиями.
воспитывать самостоятельность, аккуратность, трудолюбие, сотрудничество, наблюдательность, прилежность, внимание.
учащиеся должны уметь делать выводы из наблюдений, уметь оформлять результаты практической работы, уметь правильно ставить опыты.
Оборудование и реактивы
: cпиртовка,держатель, предметное стекло, пробирки, СuO, HCl, NaOH, Mq, CuSO4.
Требования безопасности при работе
:Осторожно с кислотой, щелочью, спичкой и стеклянной посудой; вещества брать аккуратно в малой дозе, соблюдать порядок и тишину, не мешать соседа.
Зад. 1.
СuO 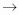 CuCl2
CuCl2 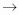 Cu(OH)2
Cu(OH)2 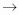 Cu
Cu
| Что делаю | Наблюдения | Уравнение реакции | Вывод |
| В пробирку ложу оксид меди и приливаю соляную кислоту | Оксид меди растворяется | CuO+2HCl=CuCl2+H2O | Идёт реакция нейтрализации с образованием соли и воды |
| К образовавшемуся раствору добавляю щелочь гидроксид натрия | Выпадает синий осадок | CuCl2+2NaOH=Cu(OH)2 +2NaCl +2NaCl | В результате связывания ионов меди и ионов ОН образуется нерастворимое основание гидроксид меди |
| На предметное стекло капаю раствор гидроксида меди и держу над пламенем спиртовки | Осадок чернеет | Cu(OH)2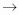 CuO+H2O CuO+H2O | Так как гидроксид меди нерастворимое основание , то оно при нагревании разлагается на оксид меди и воду |
Зад. 2. Mg 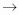 MgO
MgO 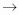 MgCl2
MgCl2 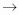 Mg(OH)2
Mg(OH)2
| Что делаю | Наблюдения | Уравнение реакции | Вывод |
| Сжигаю магний в ложке | Магний сгорает ярким пламенем | 2Mg+O2=2МgO | Образуется твердое белое вещество –оксид магния |
| Порошок оксида магния ложу в пробирку и приливаю соляную кислоту | Оксид магния растворяется | MgO+2HCl=MgCl2+H2 | Идёт реакция нейтрализации с образованием соли и воды |
| К образовавшемуся раствору приливаю щелочь | Выпадает осадок | MgCl2+2NaOH=Mg(OH)2 +2NaCl +2NaCl | В результате связывания ионов магния и ионов ОH образуется нерастворимое основание |
Зад. 3.
СuSO4 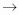 Сu(OH)2
Сu(OH)2 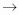 CuO
CuO 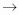 CuCl2
CuCl2
| К раствору медного купороса наливаю щелочь | Выпадает синий осадок | CuSO4+NaOH= Cu(OH)2 +Na2SO4 +Na2SO4 | В результате связывания ионов меди и и ОН образуется нерастворимое основание |
| Осадок нагреваю | Осадок чернеет | Cu(OH)2=CuO+H2O | Нерастворимое основание при нагревании разлагается на оксид меди и воду |
| К осадку добавляю соляную кислоту | Осадок растворяется | CuO+2HCl=CuCl2+H2O | Идёт реакция нейтрализации с образованием соли и воды |
Вывод работы.
Изучили физические и химические свойства основных классов неорганических веществ. Выяснили существование генетической связи между классами неорганических веществ. Из оксидов получили соли, из солей основания, а из оснований оксиды. Ещё раз вспомнили основные признаки и условия
Практическая работа
Тема: Реакция обмена между оксидом меди (II) и серной кислотой
а) Действия: нагреваем раствор серной кислоты.
Наблюдения: оксид меди (II) растворяется.
б) Действия: добавляем к нему оксид меди (II) до тех пор, пока он не перестанет растворяться.
Наблюдения: раствор приобретает голубую окраску.
в) Действия: добавляем 1/2 пробирки воды и нагреваю до кипения. Фильтруем полученный раствор.
Наблюдения: непрореагировавший оксид меди (II) остается на фильтре, а прозрачный фильтрат проходит через него.
г) Действия: выпариваем фильтрат в фарфоровой чашке.
Наблюдения: появляются кристаллы синего цвета.
Выводы:
Между оксидом меди (II) и серной кислотой протекает реакция обмена, в результате которой образуется соль (сульфат меди (II) и вода). Эту реакцию можно использовать для получения солей тех металлов, которые непосредственно с кислотой не реагируют.
Практическая работа №6
Тема: Свойства кислот, оснований, оксидов и солей
с точки зрения ТЭД
Опыт 1. Взаимодействие растворов кислот с металлами
Возьмите две пробирки, в первую поместите гранулу алюминия или цинка, во вторую - стружку меди (или немного медных опилок) и добавьте в обе пробирки по 1 мл раствора серной кислоты. Запишите свои наблюдения.
Составьте уравнения протекающей реакции в молекулярном и ионном виде. Ответьте на вопрос: с какими металлами могут реагировать кислоты?
Опыт 2. Взаимодействие растворов кислот с солями
В одну лунку планшета для капельных реакций внесите 2-3 капли раствора карбоната натрия, в другую столько же раствора сульфата натрия, добавьте в обе лунки немного раствора соляной кислоты. Запишите свои наблюдения.
Составьте уравнения протекающей реакции в молекулярном и ионном виде. Ответьте на вопрос: при каких условиях растворы кислот взаимодействуют с солями?
Опыт 3. Взаимодействие растворов кислот с основаниями
а) с раствором гидроксида калия
В лунку планшета для капельных реакций внесите 2-3 капли раствора гидроксида натрия, добавьте 1-2 капли раствора фенолфталеина, затем прилейте небольшое количество раствора азотной кислоты до появления видимых изменений. Запишите свои наблюдения.
Составьте уравнения протекающей реакции между кислотой и основанием в молекулярном и ионном виде. Ответьте на вопрос: в чём причина появления и исчезновения окраски индикатора?
б) с гидроксидом меди(II)
Получите гидроксид меди(II) следующим способом: в лунку планшета для капельных реакций внесите 2-3 капли раствора гидроксида натрия и добавьте 1-2 капли раствора сульфата меди(II).
К полученной смеси, содержащей осадок нерастворимого основания, добавьте немного раствора соляной кислоты до появления видимых изменений. Запишите наблюдения.
Составьте уравнения проведённых реакций в молекулярной и ионной форме. Ответьте на вопрос: какой ион, входящий в состав кислот, отвечает за общие химические свойства, проявляемые этими веществами?
Опыт 4. Взаимодействие растворов солей со щелочами
В две лунки планшета для капельных реакций внесите по 2-3 капли раствора гидроксида натрия и добавьте в одну – несколько капель раствора хлорида железа(III), в другую – несколько капель раствора сульфата железа(II). Запишите свои наблюдения.
Составьте уравнения проведённых реакций в молекулярной и ионной формах. Ответьте на вопросы: в чём сходство обеих реакций с точки зрения ионных взаимодействий и в чём причина различной окраски образовавшихся осадков?
Опыт 5. Взаимодействие между растворами солей
В две лунки планшета для капельных реакций внесите по 2-3 капли раствора сульфата меди(II) и добавьте в одну – несколько капель раствора хлорида бария, в другую – несколько капель раствора карбоната натрия. Запишите свои наблюдения.
Составьте уравнения проведённых реакций в молекулярной и ионной формах. Ответьте на вопрос: какие ионы, входящие в состав сульфата меди(II), принимают участие в проведённых реакциях?
Опыт 6. Химические реакции, характерные для оксидов.
а) Поместите в пробирку несколько кусочков мрамора (состоит в основном из карбоната кальция) и добавьте 2 мл соляной кислоты. Закройте пробирку пробкой с газоотводной трубкой, конец которой опустите в другую пробирку, содержащую 2 мл известковой воды (раствора гидроксида кальция). Пропускайте углекислый газ, образующийся при взаимодействии мрамора с соляной кислотой, через известковую воду до появления видимых изменений. Запишите наблюдения.
Составьте уравнения проведённых реакций в молекулярной и ионной формах. Ответьте на вопрос: какой характер оксида (основный или кислотный) подтверждает реакция взаимодействия его с раствором щёлочи?
б) Поместите в пробирку небольшое количество (со спичечную головку) порошка оксида меди и прилейте 1 мл раствора серной кислоты. Закрепите пробирку в держателе и немного нагрейте. Как изменилась окраска раствора? Запишите наблюдения.
Составьте уравнение проведённой реакции в молекулярной и ионной форме. Ответьте на вопрос, какой характер оксида (основный или кислотный) подтверждает эта реакция?
Отчёт о работе оформите в виде таблицы:
| № опыта | Название опыта | Наблюдения | Выводы и уравнения химических реакций |
|
|
|
|
|
| Практическая работа №6 Решение экспериментальных задач по теме: «Химические свойства основных классов соединений» Цель работы: Изучить химические свойства классов неорганических соединений Реактивы и оборудование: Оксид меди(II), раствор серной кислоты, раствор гидроксида натрия, фенолфталеин, раствор соляной кислоты, раствор сульфата меди (II), спиртовка, пробирки, пробиркодержатель. Ход работы: ОСТОРОЖНО! КИСЛОТЫ И ЩЁЛОЧИ! Опыт №1. Реакция обмена между оксидом меди(II) и раствором серной кислоты Инструкция к выполнению: Загрузите и внимательно наблюдайте за В пробирку прилейте 1-2 мл раствора серной кислоты и добавьте порошок (на кончике лопатки) оксида меди (II) Пробирку с реакционной смесью укрепите в пробиркодержателе и осторожно нагрейте на пламени спиртовки. Что происходит с оксидом меди (II)? Как изменился цвет смеси? Потушите спиртовку. Сделайте вывод. Опыт №2. Реакция нейтрализации Инструкция к выполнению: Загрузите и внимательно наблюдайте за видео - экспериментом В пробирку прилейте 1 мл раствора гидроксида натрия и добавьте к нему каплю фенолфталеина. Что наблюдаете? К полученной смеси добавьте по каплям соляную кислоту. Как изменился цвет в пробирке? Почему цвет индикатора меняется? Сделайте вывод Опыт №3. Распознавание растворов щелочи, кислоты и воды с помощью индикаторов. Инструкция к выполнению: Загрузите и внимательно наблюдайте за видео - экспериментом Внимательно рассмотрите выданные в пронумерованных пробирках вещества. Продумайте, с помощью какого реактива можно наиболее рациональным способом различить кислоту и основание. Возьмите небольшие пробы из каждой пронумерованной пробирки (5-10 капель, воспользуйтесь пипеткой). Поместите их в чистые пустые пробирки. Не забудьте, откуда брали пробы! В каждую пробу добавьте по 2-3 капли выбранного индикатора. Запишите наблюдения. Сделайте вывод о том, какие вещества находятся в пробирках. Подтвердите с помощью характерных реакций, наличие кислоты и основания среди выданных веществ. Сделайте вывод. Отчёт о проделанной работе оформить в виде таблицы: | Номер и название опыта | Что делали? | Что наблюдали? Почему? Сделайте выводы? | Уравнение химической реакции (продуктам реакции дать названия, указать типы химических реакций) | |
|
|
|
| Если вы выполняете работу в лаборатории: Убрать рабочее место: грязные пробирки убрать в раковину, реактивы и оборудование сложить в лоток. Вымыть руки. | Комментарии _displayNameOrEmail_ - _time_ - Удалить _text_ |
Практическая работа №7 Тема: Получение соляной кислоты и изучение ее свойств Соберите прибор, как показано на рисунке 49.
В пробирку насыпьте 2—3 г хлорида натрия и прилейте столько концентрированной серной кислоты (2:1), чтобы она смочила всю соль. Закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку с водой так, чтобы он был примерно на расстоянии 0,5—1 см от поверхности воды. Затем смесь в первой пробирке осторожно нагревайте в течение 5—6 мин (следите, чтобы кислоту не перебросило во вторую пробирку с водой!).
1. Напишите уравнения химических реакций, протекающих между концентрированной протекающих между соляной кислотой и указанными металлами.
2. Как объяснить образование в четвертой и пятой пробирках растворов синего цвета, а в шестой — выделение газа? Составьте уравнения соответствующих реакций.
3. Проведите реакции по распознаванию соляной кислоты и ее солей. Для этого в одну пробирку налейте 1—2 мл разбавленной соляной кислоты, во вторую — столько же раствора хлорида натрия, а в третью — раствор хлорида кальция. Во все пробирки добавьте по нескольку капель раствора нитрата серебра. Проверьте, растворяется ли выпавший осадок в концентрированной азотной кислоте.
Напишите уравнения проведенных вами реакций и укажите, как можно отличить: а) соляную кислоту от других кислот, б) хлориды от других солей, в) растворы хлоридов от соляной кислоты.
Почему вместо раствора нитрата серебра(I) можно также использовать раствор нитрата свинца(II)?серной кислотой и хлоридом натрия при обычных условиях и при сильном нагревании.
2. Чем вызвано появление во второй пробирке тонких опускающихся вниз струек?
3. Почему конец газоотводной трубки должен находиться на расстоянии 0,5—1,0 см от поверхности воды?
Изучение свойств соляной кислоты
Полученную соляную кислоту разлейте поровну в шесть пробирок. В первую пробирку опустите лакмусовую бумажку. Во вторую пробирку положите кусочек цинка или магниевые стружки, а в третью — кусочек меди. В четвертую пробирку внесите немного оксида меди(II) и нагрейте раствор. В пятую пробирку поместите немного свежеприготовленного гидрокси-да меди(II), в шестую — немного мела или другого карбоната.
Со всеми ли металлами реагирует соляная кислота? Составьте уравнения реакций
Выводы:
Практическая работа №8
Решение экспериментальных задач по теме галогены
| Опыт №1. Качественные реакции галогенидов - солей галогенводородных кислот HCl, HBr, HI. Инструкция к выполнению эксперимента: В три пробирки прилейте по 1-2 мл растворов хлорида натрия, бромида натрия и йодида калия. В каждую пробирку добавьте несколько капель раствора нитрата серебра Что происходит в каждой из пробирок? Как изменился цвет? Сделайте вывод. «Обнаружение хлорид-ионов» Цель работы: Научиться распознавать соли – галогениды Реактивы и оборудование:________________________ Техника безопасности:___________________________ | Название опыта | Что делали? Что наблюдали? Выводы. | Составьте уравнения реакций между веществами | | Качественные реакции галогенидов - солей галогенводородных кислот HCl, HBr, HI. |
| NaCl + AgNO3→ | |
| NaBr + AgNO3→ | |
| KI+ AgNO3→ | Опыт №2. Определение качественного состава соляной кислоты «Действие кислот на индикаторы» Инструкция к выполнению эксперимента: Определим наличие водорода в растворе соляной кислоты – 1) В три пробирки прилейте по 1-2 мл раствора соляной кислоты. 2) В первую пробирку добавьте несколько капель лакмуса; во вторую – метилоранжа, а в третью пробирку – фенолфталеин. 3) Что происходит в каждой из пробирок? Как изменился цвет? 4) Сделайте вывод. Определим наличие хлорид-иона в растворе соляной кислоты – 1) В пробирку прилить 1 -2 мл раствора соляной кислоты 2) Добавить к раствору соляной кислоты раствор нитрата серебра 3) Что наблюдаете? 4) Сделайте вывод. Оформите отчёт Цель работы: Подтвердить опытным путём качественный состав соляной кислоты Реактивы и оборудование:________________________ Техника безопасности:___________________________ Заполните таблицу: | Название индикатора | Цвет индикатора в нейтральной среде | Цвет индикатора в кислой среде | | лакмус |
|
| | метилоранж |
|
| | фенолфталеин |
|
| Сделайте вывод, как можно доказать наличие водорода в растворе?____________________________________________ Заполните таблицу: | Название опыта | Что делали? Что наблюдали? Выводы. | Составьте уравнения реакций между веществами | | Определение хлорид - иона |
| HCl + AgNO3 → | Сделайте вывод, как можно доказать наличие хлорид - иона в растворе?____________________________________________ Опыт №3. Получение хлорида меди (II) Посмотрите видео – эксперимент "Взаимодействие хлора с медью" Задача: Предложите ещё два различных способа получения хлорида меди (II). Составьте уравнения соответствующих химических реакций. |











































