
фосфор

Открытие фосфора
- Белый фосфор был открыт в 1669г. немецким алхимиком Геннингом Брандом.
- Красный фосфор - в 1847г. Шрёттером при нагревании белого до 250 0 С в инертном газе.
- Фиолетовый фосфор открыл в 1797г. р усский учёный Мусин-Пушкин .
- В 1934г. проф. Бриджмен , подвергая белый фосфор давлению до 1100 атм. превратил его в чёрный фосфор.
Открытие белого фосфора

2. Название - ФОСФОР
3. Порядковый номер - 15
4. Ar (Р) = 31
5. 3 период
6. VA группа
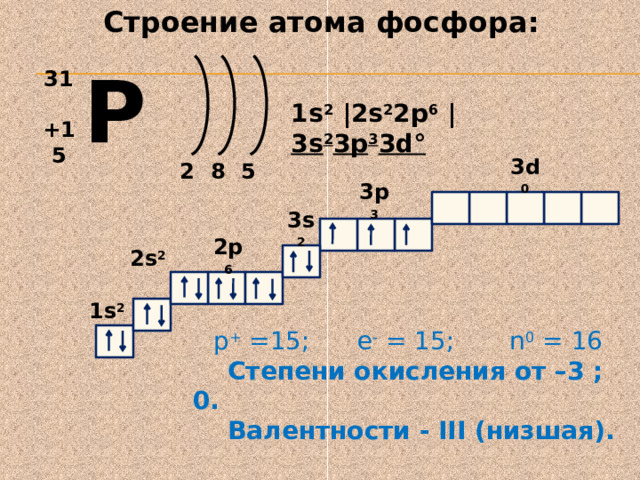
Строение атома фосфора:
P
31
1s 2 | 2s 2 2p 6 | 3s 2 3p 3 3d °
+15
2
5
8
3d 0
3p 3
3s 2
2p 6
2s 2
1s 2
р + =15; е - = 15; n 0 = 16
Степени окисления от –3 ; 0.
Валентности - III (низшая).
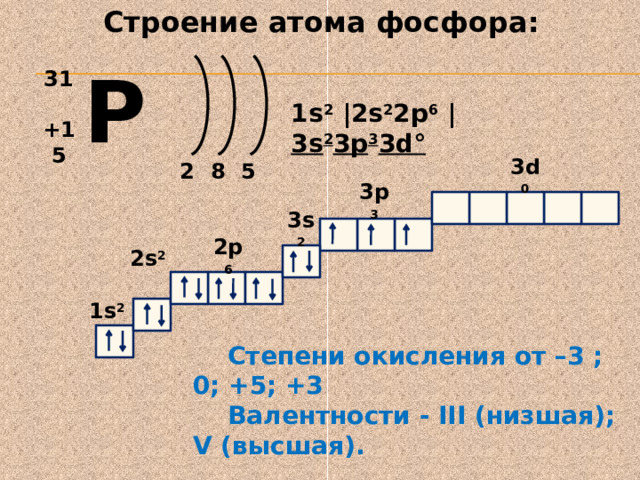
Строение атома фосфора:
P
31
1s 2 | 2s 2 2p 6 | 3s 2 3p 3 3d °
+15
2
5
8
3d 0
3p 3
3s 2
2p 6
2s 2
1s 2
Степени окисления от –3 ; 0; +5; +3
Валентности - III (низшая); V (высшая).

8. Неметалл
9. Р 2 О 5 – кислотный оксид
10. Н 3 РО 4 – ортофосфорная кислота
11. РН 3 – фосфороводород (фосфин)

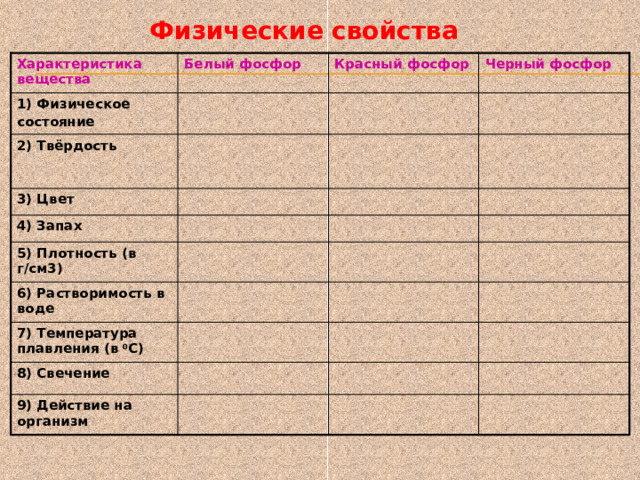
Физические свойства
- Характерно явление аллотропии
Белый фосфор
Черный фосфор
Красный фосфор
Физические свойства
Характеристика вещества
Белый фосфор
1) Физическое
Красный фосфор
состояние
2) Твёрдость
Черный фосфор
3) Цвет
4) Запах
5) Плотность (в г/см3)
6) Растворимость в воде
7) Температура плавления (в 0 С)
8) Свечение
9) Действие на организм

Белый фосфор – P 4
- Воскоподобное белое вещество
- Имеет чесночный запах
- Нерастворим в воде
- Хранят под слоем воды
- Хорошо растворим в сероуглероде
- Летуч
- T пл = 44 0 С
Молекулярная кристаллическая решётка
Химически активен
на воздухе самовоспламеняется
в темноте светится
ЯДОВИТ!!!

Красный фосфор
- твердое вещество
- красно-бурого цвета
- не ядовит
- нерастворим в воде и органических растворителях
- атомная кристаллическая решётка
- устойчив
- Белый →260 0 С, без воздуха → Красный

черный фосфор
- вещество без запаха
- похож на графит
- жирный на ощупь
- нерастворим в воде и органических растворителях
- атомная кристаллическая решетка
- полупроводник
- Т кип = 453°С (возгонка)
- Т пл = 1000°С (при р=1,8 • 10 9 Па)
- устойчив
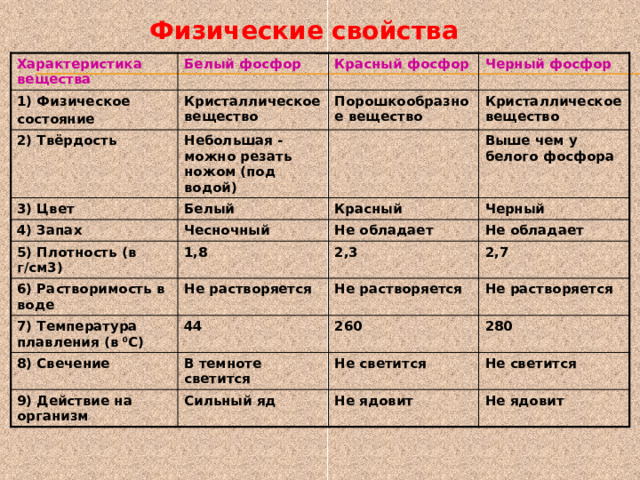
Физические свойства
Характеристика вещества
Белый фосфор
1) Физическое
состояние
Кристаллическое вещество
Красный фосфор
2) Твёрдость
3) Цвет
Черный фосфор
Небольшая -можно резать ножом (под водой)
Порошкообразное вещество
Белый
Кристаллическое вещество
4) Запах
5) Плотность (в г/см3)
Красный
Чесночный
Выше чем у белого фосфора
1,8
Черный
Не обладает
6) Растворимость в воде
Не обладает
2,3
7) Температура плавления (в 0 С)
Не растворяется
2,7
Не растворяется
44
8) Свечение
Не растворяется
260
В темноте светится
9) Действие на организм
Не светится
Сильный яд
280
Не светится
Не ядовит
Не ядовит

Фосфор как восстановитель Взаимодействие с кислородом.
4Р + 5О 2 = 2Р 2 О 5
(избыток кислорода)
4Р + 3О 2 = 2Р 2 О 3
(недостаток кислорода)
белый при t = 40°С
красный при t = 260°С
черный при t = 400°С

Взаимодействие фосфора с хлором
2Р°+ЗСl 2 ° = 2Р +3 Сl 3 -1
Легко разлагается водой:
РСl 3 + ЗН 2 О = Н 3 РО 3 + ЗНСl
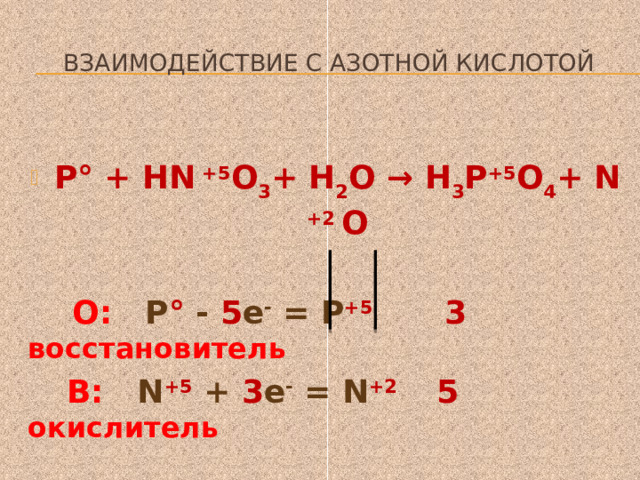
Взаимодействие с азотной кислотой
- Р° + HN +5 O 3 + Н 2 О → Н 3 Р +5 O 4 + N +2 O
О: Р ° - 5 е - = Р +5 3 восстановитель
В: N +5 + 3 е - = N +2 5 окислитель
- ЗР+ 5HN O 3 +2Н 2 О = ЗН 3 РO 4 +5N O

Фосфор как окислитель
- Взаимодействие с металлами с образованием фосфидов:
Mg 0 + P 0 = Mg 3 +2 P 2 -3
О: Mg 0 – 2 е - = Mg +2 3 восстановитель
В: P 0 + 3 е - = P -3 2 окислитель
3 Mg + 2 P = Mg 3 P 2

- Фосфиды металлов легко разлагаются с выделением ядовитого газа фосфина РН 3
Mg 3 P 2 + 6Н 2 О = 3Mg(ОН) 2 + 2PН 3 ↑

PH 3 Фосфин или фосфористый водород
- Бесцветный газ с запахом чеснока. Очень ядовит. Сгорает с образованием фосфорного ангидрида P 2 O 5 .
- Чистый фосфин (без примесей) воспламеняется при температуре 150°С,
сгорает с образованием фосфорной кислоты.
При наличии примесей дифосфина Р 2 Н 4
или газообразного фосфора Р 4 может самопроизвольно воспламеняться на воздухе

Блуждающие огни , также болотные огни , «бесовские огни» ( лат. ignis fatum , от ignis — «огонь» и fatum — «судьба») — редкие природные явления, наблюдаемые по ночам на болотах, полях и кладбищах.
Существует несколько гипотез возникновения загадочных огней. По одной из них - это самовозгорание газообразного
фосфористого водорода
образующегося при гниении отмерших растительных и животных организмов
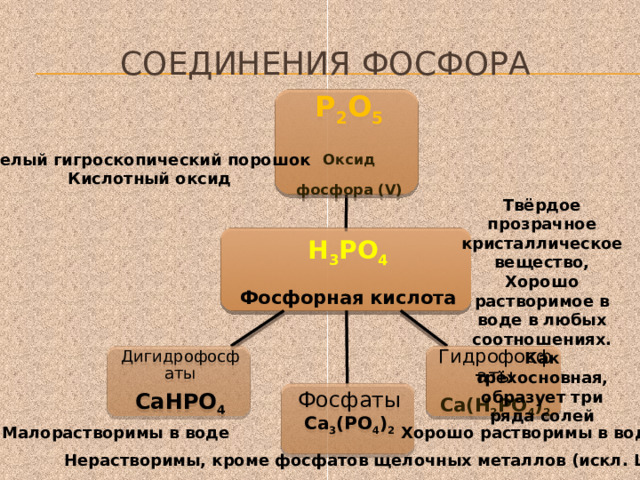
Соединения фосфора
Р 2 О 5
Оксид фосфора (V)
Белый гигроскопический порошок
Кислотный оксид
Твёрдое прозрачное кристаллическое вещество, Хорошо растворимое в воде в любых соотношениях. Как трёхосновная, образует три ряда солей
Н 3 РО 4
Фосфорная кислота
Гидрофосфаты
Дигидрофосфаты
СаНРО 4
Са(Н 2 РО 4 ) 2
Фосфаты
Са 3 (РО 4 ) 2
Хорошо растворимы в воде
Малорастворимы в воде
Нерастворимы, кроме фосфатов щелочных металлов (искл. Li )

Кислотный оксид Р 2 О 5 Физические свойства
- Белое гигроскопичное порошкообразное вещество.
- Хорошо растворимое в воде, образует несколько кислот.
- Используется как осушитель газов и жидкостей, отнимает воду у химических соединений.

Ортофосфорная кислота Н 3 РО 4 Физические свойства
- Белые прозрачные кристаллы,
- не ядовита
- Кислота средней силы
- С водой смешивается в любых соотношениях.
- Тплав. = 42 0 С, плавиться без разложения, при умеренном нагревании разлагается.
- Окислительные свойства не проявляет (отличие от Н 2 SO 4 (конц.), НNO 3 )

Ортофосфорная кислота Н 3 РО 4
- Является трехосновной кислотой и образует три ряда солей:
- 1 ) средние соли , или фосфаты - Са 3 (РО 4 ) 3
- Которые нерастворимы в воде, кроме фосфатов щелочных металлов
- 2) Кислые - дигидрофосфаты - Са(Н 2 РО 4 ) 2
- Большинство из которых хорошо растворимы в воде

Ортофосфорная кислота Н 3 РО 4
- 3) Кислые - гидрофосфаты - СаНРО 4
- Которые малорастворимы в воде (кроме фосфатов натрия, калия и аммония), т.е. занимают промежуточное положение между фосфатами и дигидрофосфатами по растворимости.
- Вывод: с увеличением содержания атомов водорода в молекуле соли, ее растворимость повышается.

Качественная реакция на растворимые фосфаты
3Ag + + PO 4 3- = Ag 3 PO 4 ↓
жёлтый осадок
Ортофосфат серебра
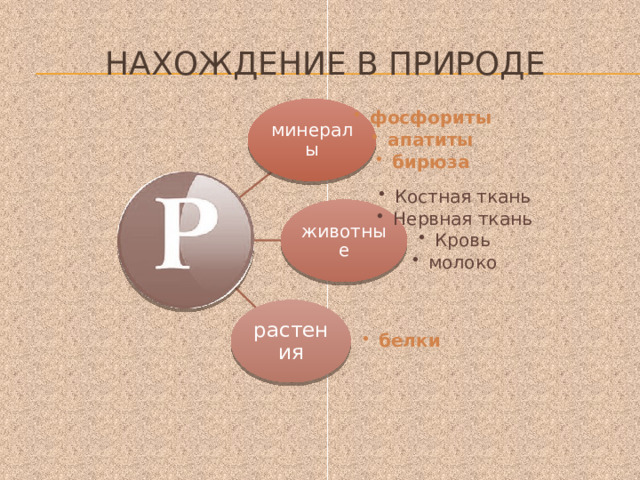
Нахождение в природе
минералы
- фосфориты апатиты бирюза
- фосфориты
- апатиты
- бирюза
животные
- Костная ткань Нервная ткань Кровь молоко
- Костная ткань
- Нервная ткань
- Кровь
- молоко
растения

фосфориты
апатиты
Важнейшие Природные соединения

5С + 3SiO 2 + Са 3 (РО 4 ) 2 = 5СО + 3CaSi0 3 + 2Р (сплавление в электрической печи)
Получение фосфора

Продукты питания богатые фосфором (P)
Указано ориентировочное наличие в 100г продукта :
Сыр плавленый
Камбала
Скумбрия
600 мг
Мойва
Осетр
400 мг
Брынза
280 мг
Сардина
Минтай
240 мг
Краб
270 мг
375 мг
Ставрида
Корюшка
Тунец
280 мг
240 мг
260 мг
Креветка
240 мг
Кальмар
250 мг
280 мг
225 мг
Творог
250 мг
220 мг
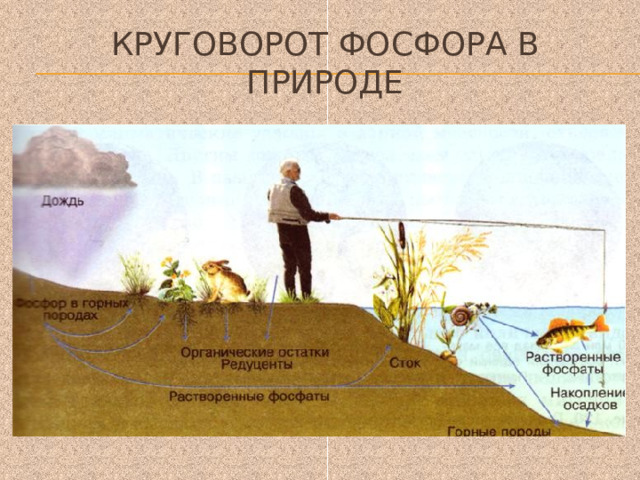
Круговорот фосфора в природе

Задание
- Напишите уравнение диссоциации солей
- Фосфата натрия
- Гидрофосфата натрия
- Дигидрофосфата натрия
- Обратите внимание: средние соли диссоциируют в 1 ступень (сильные электролиты), у кислых солей – несколько ступеней диссоциации.

Диссоциация солей фосфора

Домашнее задание: §19



























































