
Не надо учить наизусть химические свойства каждого атома, не надо
зазубривать химические реакции... ответ на любой вопрос по химии находится
в Периодической системе элементов .

Химия –
это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения.

Задачи неорганической химии:
- Установление строения химических элементов, состава и свойств образуемых ими соединений,
- Установление строения молекул сложных веществ;
- Разработка и научное обоснование способов создания новых материалов с нужными свойствами.

Основными методами неорганической химии являются синтез и анализ.
Основным теоретическим фундаментом неорганической химии служат:
- Теория строения атомов;
- ПЗ;
- ПСХЭ.
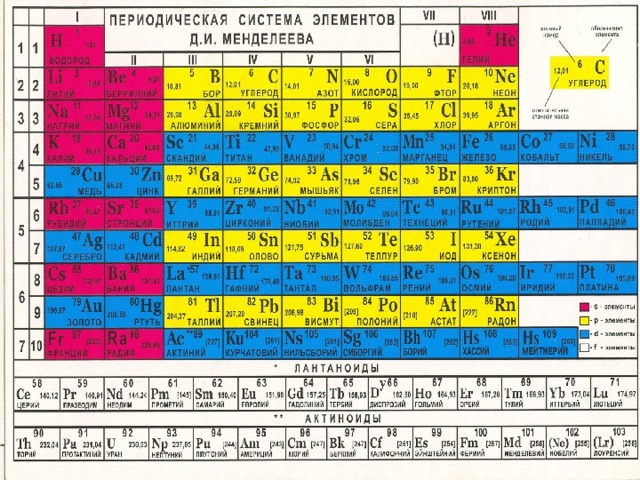

Дайте характеристику химическому элементу на основании его положения в ПСХЭ

«Характеристика химического элемента на основании его положения в ПСХЭ»
- создать условия для формирования у учащихся навыков для характеристики химических элементов 1-3 периодов по их положению в ПСХЭ.

Задачи:
- Научиться характеризовать химический элемент на основании его положения в ПСХЭ
- Узнать закономерности изменения свойств простых веществ на основе ПСХЭ.

- Положение элемента в ПСХЭ и строение его атомов
- Характеристика простого вещества
- Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами
- Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по периоду элементами
- Состав высшего оксида, его характер
- Состав высшего гидроксида, его характер
- Состав летучего водородного соединения

1 пункт ,
значит указать порядковый номер, номер периода (большой или малый), номер группы (главная или побочная), рассмотреть строение атома, значит определить число протонов и электронов, а также нейтронов (массовое число – порядковый номер), указать число энергетических уровней и число электронов на внешнем энергетическом уровне.

2 пункт ,
при рассмотрении необходимо вспомнить о диагонали от бора к астату: в области справа от диагонали являются неметаллами, слева – металлами. Все элемента расположенные в побочных подгруппах являются металлами

Пункты 3,4 и 6
необходимо воспользоваться таблицей №1, представленной в учебнике.

Пункты 5 и 7,
все формулы высших оксидов и летучих водородных соединений помещены внизу таблицы Д.И.Менделеева.

Азот
- Z=7, е = 7, р = 7, n = A – Z = 14 - 7=7
2 малый период, VА группа, следовательно 2 энергетических уровня, на внешнем энергетическом уровне 5 электронов

Азот
- Возможная степень окисления:
высшая +5, низшая 5 – 8 = -3,
Следовательно может принимать и отдавать свои электроны, проявляя при этом окислительные и восстановительные свойства.
R атома (N) меньше R атома (Р)
R ат (С) больше R ат (N) больше R ат (O)

Азот
- Простое вещество неметалл.
- Неметаллические свойства азота выражены сильнее, чем у фосфора
- Неметаллические свойства азота выражены сильнее, чем у углерода, но слабее, чем у кислорода.
- N 2 O 5 – кислотный оксид
- HNO 3
- H 3 N – нитрид азота

Задачи:
- Научиться характеризовать химический элемент на основании его положения в ПСХЭ
- Узнать закономерности изменения свойств простых веществ на основе ПСХЭ.














































