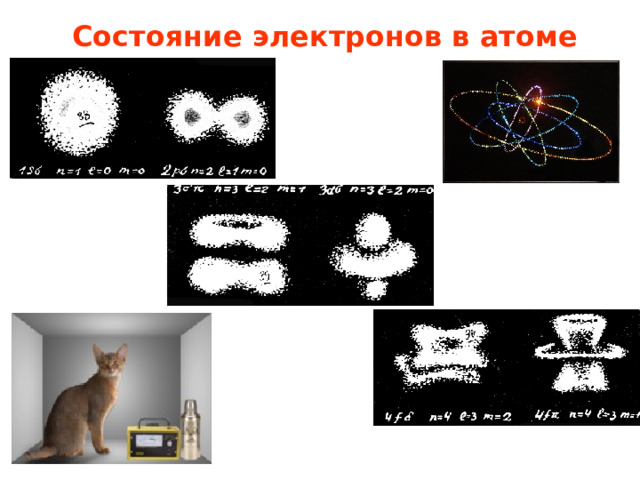
Состояние электронов в атоме

1924 год
Франция
Луи де Бройль
(Луи Виктор Пьер Реймон,
7-й герцог Брольи)
(1892-1987)
Лауреат нобелевской премии
(1929)
Электрон обладает двойственными корпускулярно-волновыми свойствами (как свет), то есть проявляет одновременно свойства частицы и волны.

1927 год
США
Клинтон Дж. Дэвиссон
(1881-1958)
Лауре ат нобелевской премии по физике
(1937)
Лестер Г. Джермер
(1896-1971)
Англия
Джозеф Паджет Томсон
(1892-1975)
Экспериментально доказали
утверждение Луи де Бройля
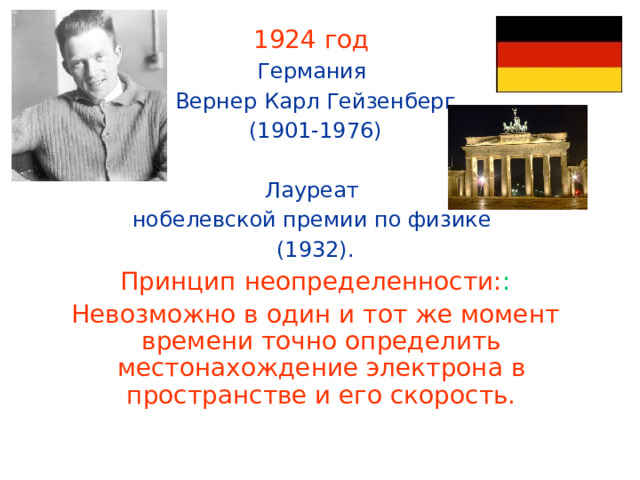
1924 год
Германия
Вернер Карл Гейзенберг
(1901-1976)
Лауреат
нобелевской премии по физике
(1932).
Принцип неопределенности: :
Невозможно в один и тот же момент времени точно определить местонахождение электрона в пространстве и его скорость.

1926 год
Австрия
Эрвин Шредингер
(1887-1961)
Лауреат
нобелевской премии
по физике
(1933)
Уравнение Шредингера
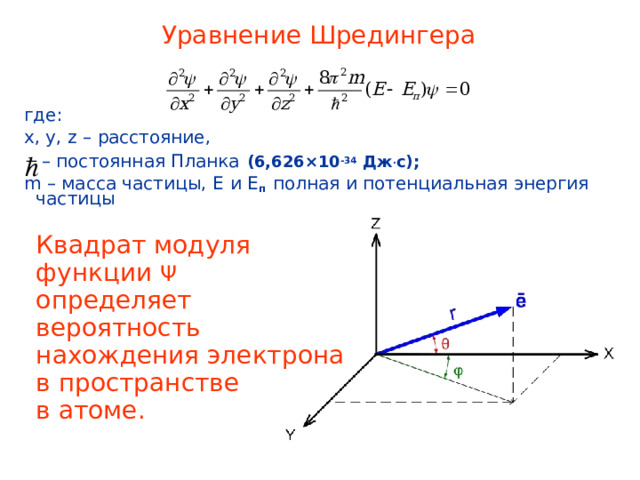
Уравнение Шредингера
где:
x, y, z – расстояние,
– постоянная Планка (6,626 × 10 -34 Дж . с);
m – масса частицы, E и E п полная и потенциальная энергия частицы
Квадрат модуля
функции Ψ
определяет
вероятность
нахождения электрона
в пространстве
в атоме.

Функция Ψ зависит
от пространственных
координат электрона
(радиуса и двух углов)
и определяется
набором квантовых чисел: n, l, m, s
![Квантовые числа Квантовые числа Главное квантовое число Орбитальное (побочное) квантовое число Физический смысл n l Магнитное квантовое число Определяет энергию электрона; Степень его удаления от ядра; Размер электронного облака; Значения Целочисленные значения, совпадающие с номером периода (им соответствуют латинские буквы: K , L , M , N и т.д.) Иллю- страции Определяет форму электронной орбитали m Спиновое квантовое число Целочисленные значения: [0, n -1] (им соответствуют латинские буквы: s , p , d , f и далее по алфавиту) Характеризует положение электронной орбитали в пространстве Слайд 9 s Характеризует магнитный момент, возникающий при вращении электрона вокруг собственной оси – спин Слайд 10 Целочисленные значения от – l до + l , всего (2 l +1) значений Слайд 11 -1/2 и +1/2 Слайд 12](https://fsd.multiurok.ru/html/2023/03/09/s_64099e6c8c56b/img7.jpg)
Квантовые числа
Квантовые числа
Главное квантовое число
Орбитальное (побочное) квантовое число
Физический смысл
n
l
Магнитное квантовое число
Определяет энергию электрона; Степень его удаления от ядра; Размер электронного облака;
Значения
Целочисленные значения, совпадающие с номером периода (им соответствуют латинские буквы: K , L , M , N и т.д.)
Иллю-
страции
Определяет форму электронной орбитали
m
Спиновое квантовое число
Целочисленные значения: [0, n -1] (им соответствуют латинские буквы:
s , p , d , f и далее по алфавиту)
Характеризует положение электронной орбитали в пространстве
Слайд 9
s
Характеризует магнитный момент, возникающий при вращении электрона вокруг собственной оси – спин
Слайд 10
Целочисленные значения от – l до + l , всего (2 l +1) значений
Слайд 11
-1/2 и +1/2
Слайд 12
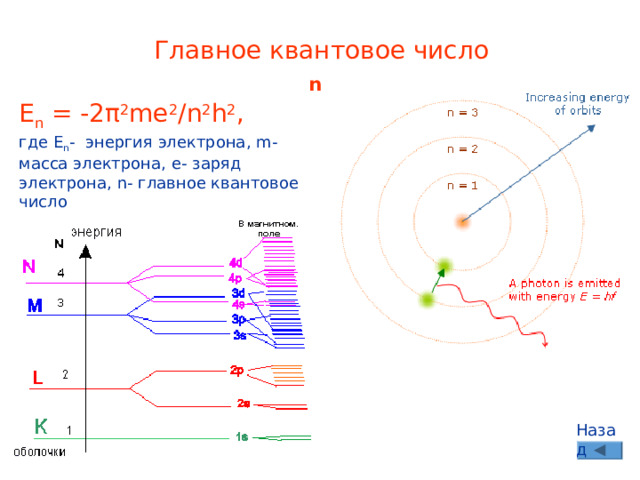
Главное квантовое число
n
E n = -2π 2 me 2 / n 2 h 2 , где E n - энергия электрона, m - масса электрона, e - заряд электрона, n - главное квантовое число
Назад

Орбитальное квантовое число
l
Назад
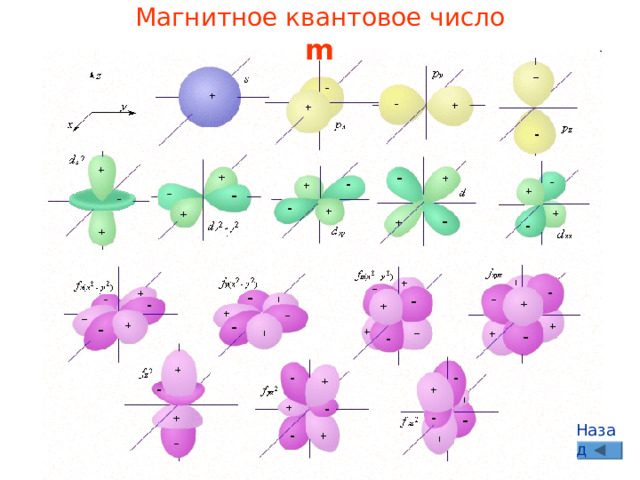
Магнитное квантовое число
m
Назад
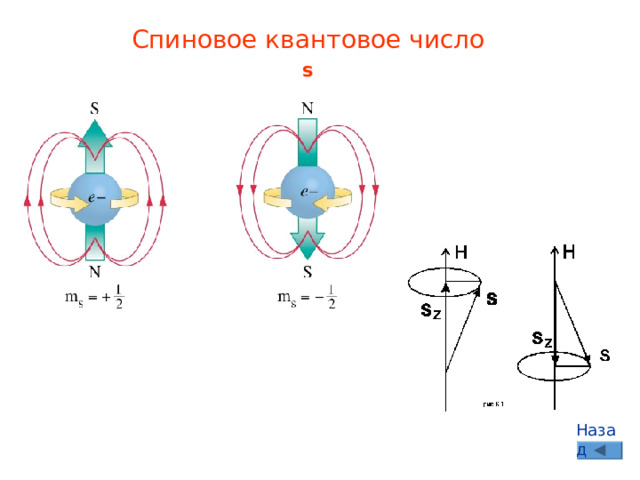
Спиновое квантовое число
s
Назад
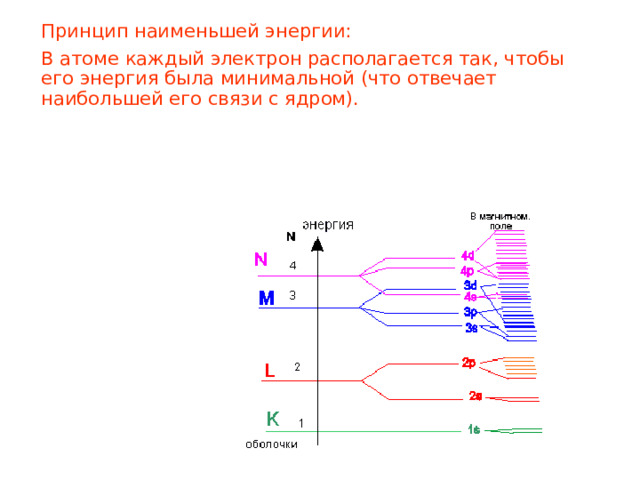
Принцип наименьшей энергии:
В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей его связи с ядром).

1961
Клечковский
Всеволод Маврикиевич
(1900 -1972)
Россия
Правило Клечковского:
Электрон занимает в основном состоянии уровень не с минимально возможным значением n, а с наименьшим значением суммы n + l.

1940
Вольфганг Эрнст Паули
(1900 – 1958)
Австрия
Лауреат нобелевской премии
(1945)
Принцип Паули:
В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.

Фридрих Хунд
(1896 – 1997)
Германия
Правило Хунда:
При данном значении l (т. е. в пределах определенного подуровня) электроны располагаются таким образам, чтобы суммарный спин был максимальным.













![Квантовые числа Квантовые числа Главное квантовое число Орбитальное (побочное) квантовое число Физический смысл n l Магнитное квантовое число Определяет энергию электрона; Степень его удаления от ядра; Размер электронного облака; Значения Целочисленные значения, совпадающие с номером периода (им соответствуют латинские буквы: K , L , M , N и т.д.) Иллю- страции Определяет форму электронной орбитали m Спиновое квантовое число Целочисленные значения: [0, n -1] (им соответствуют латинские буквы: s , p , d , f и далее по алфавиту) Характеризует положение электронной орбитали в пространстве Слайд 9 s Характеризует магнитный момент, возникающий при вращении электрона вокруг собственной оси – спин Слайд 10 Целочисленные значения от – l до + l , всего (2 l +1) значений Слайд 11 -1/2 и +1/2 Слайд 12](https://fsd.multiurok.ru/html/2023/03/09/s_64099e6c8c56b/img7.jpg)


















