
Кристаллические решетки

Цели урока
- ЗНАТЬ понятия о кристаллическом и аморфном состоянии твердых тел, типы кристаллических решеток
- УМЕТЬ по химическим формулам устанавливать строение и свойства веществ
- Иметь представление о законе постоянства состава
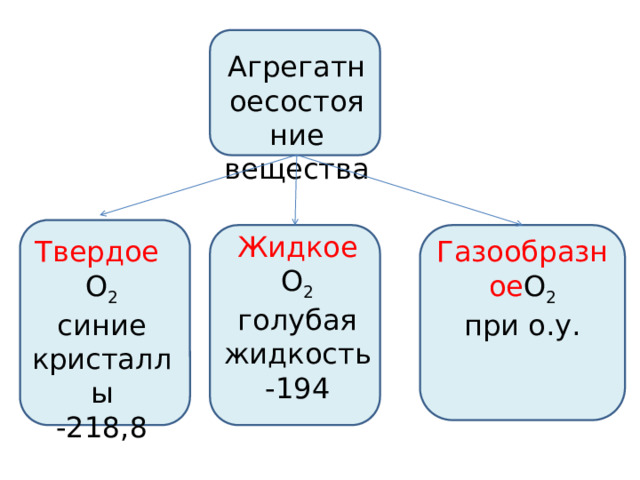
Агрегатноесостояние вещества
Жидкое
O 2
голубая жидкость
-194
Твердое
Газообразное O 2
при о.у.
O 2
синие кристаллы
-218,8

Аморфные вещества
смола
мед
пластилин
стекло
пластмассы, шоколад, воск

Кристаллические вещества
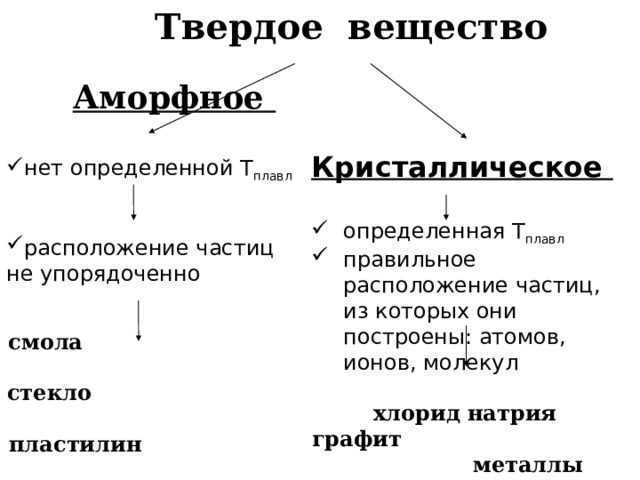
Твердое вещество
Аморфное
- нет определенной Т плавл
- расположение частиц не упорядоченно
смола
стекло
пластилин
воск
пластмассы
Кристаллическое
- определенная Т плавл
- правильное расположение частиц, из которых они построены: атомов, ионов, молекул
хлорид натрия
графит металлы
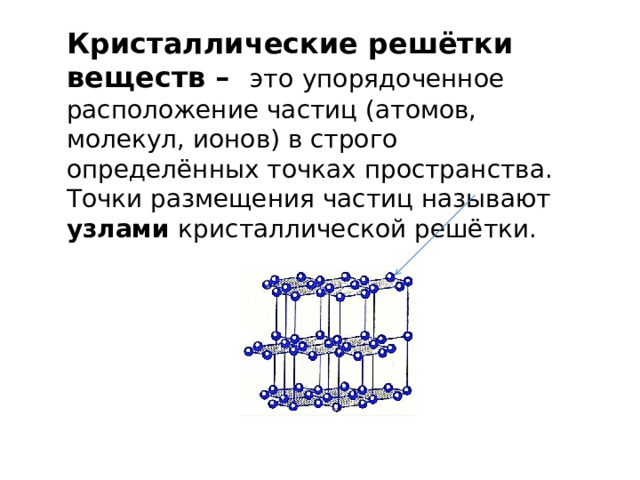
Кристаллические решётки веществ – это упорядоченное расположение частиц (атомов, молекул, ионов) в строго определённых точках пространства. Точки размещения частиц называют узлами кристаллической решётки.
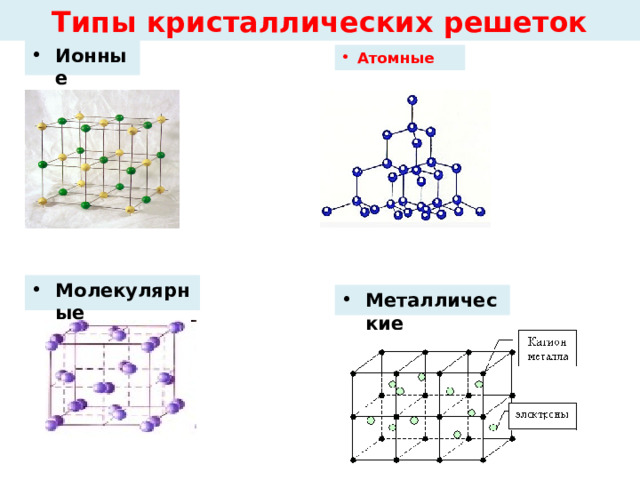
Типы кристаллических решеток
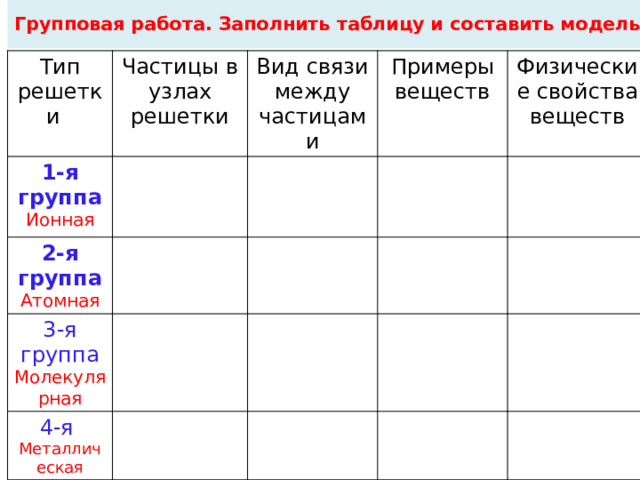
Групповая работа. Заполнить таблицу и составить модель
Тип решетки
Частицы в узлах решетки
1-я группа
2-я группа
Вид связи
Ионная
3-я группа
Атомная
между частицами
Примеры веществ
4-я
Молекулярная
Физические свойства веществ
Металлическая

Ионные кристаллические решетки
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью.
- Ионные кристаллические решётки имеют
- Рассмотрим строение кристалла поваренной соли, в узлах которого находятся ионы хлора и натрия. Связи между ионами в кристалле прочные и устойчивые . Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью , тугоплавки, хрупкие
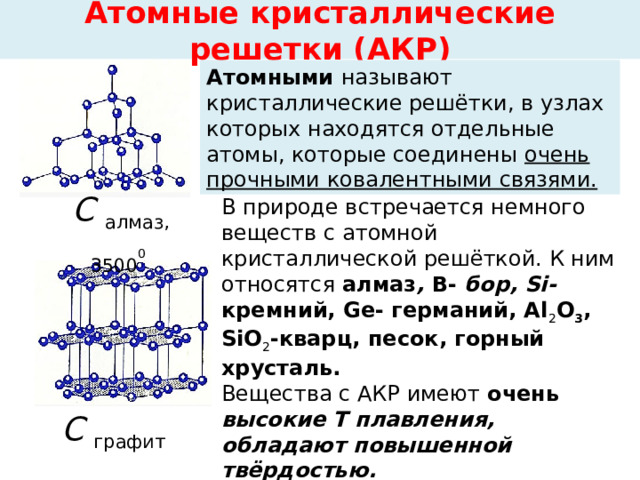
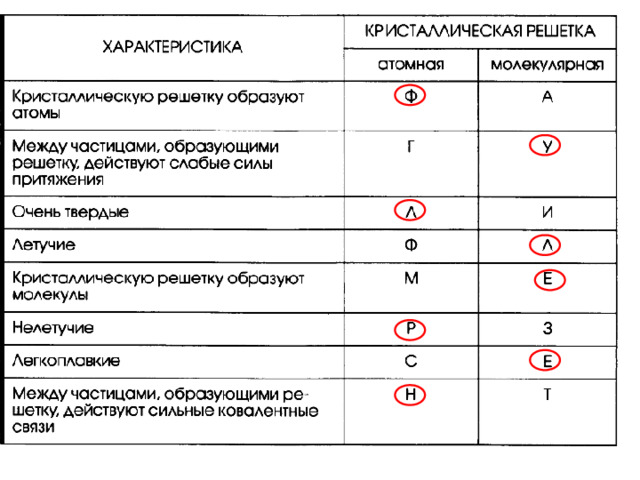
Атомные кристаллические решетки (АКР)
Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены очень прочными ковалентными связями.
С алмаз, 3500 0
В природе встречается немного веществ с атомной кристаллической решёткой. К ним относятся алмаз , В- бор, Si- кремний, Ge- германий, Аl 2 O 3 , SiO 2 -кварц, песок, горный хрусталь.
Вещества с АКР имеют очень высокие T плавления, обладают повышенной твёрдостью.
Алмаз - самый твёрдый природный материал.
С графит
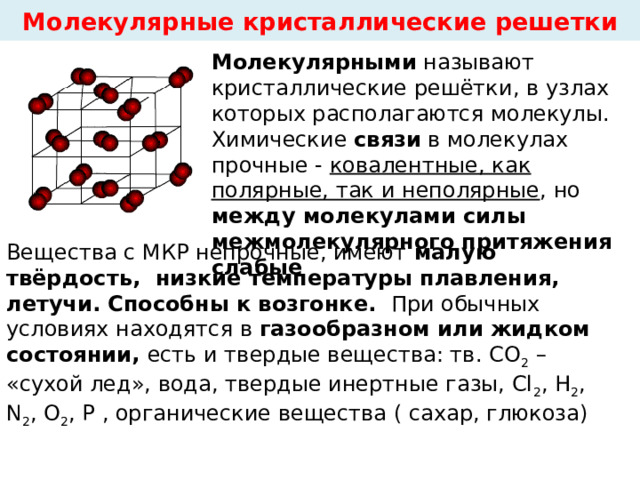
Молекулярные кристаллические решетки
Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в молекулах прочные - ковалентные, как полярные, так и неполярные , но между молекулами силы межмолекулярного притяжения слабые
Вещества с МКР непрочные, имеют малую твёрдость, низкие температуры плавления, летучи. Способны к возгонке. При обычных условиях находятся в газообразном или жидком состоянии, есть и твердые вещества: тв. СО 2 – «сухой лед», вода, твердые инертные газы, Сl 2 , H 2 , N 2 , O 2 , P , органические вещества ( сахар, глюкоза)
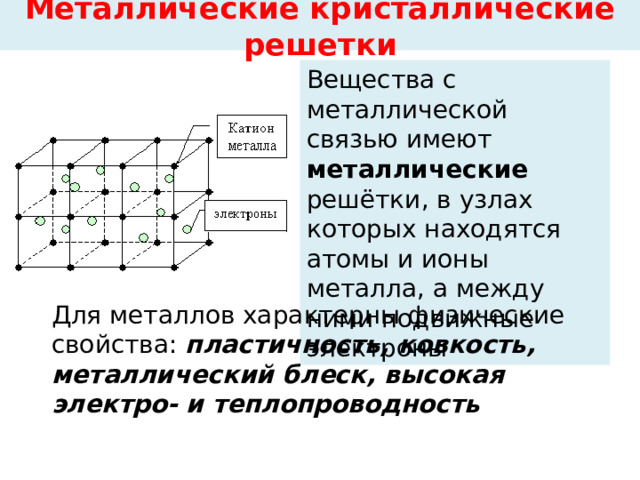
Металлические кристаллические решетки
Вещества с металлической связью имеют металлические решётки, в узлах которых находятся атомы и ионы металла, а между ними подвижные электроны
Для металлов характерны физические свойства: пластичность, ковкость, металлический блеск, высокая электро- и теплопроводность
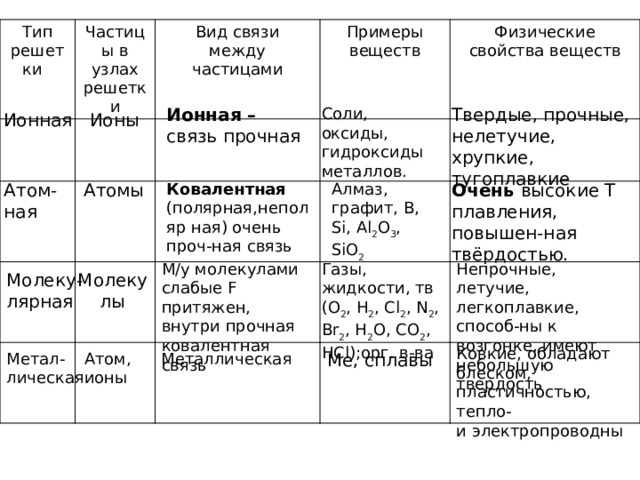
Тип решетки
Частицы в узлах решетки
Вид связи
Примеры веществ
между частицами
Физические свойства веществ
Соли, оксиды, гидроксиды металлов.
Твердые, прочные, нелетучие, хрупкие, тугоплавкие
Ионная – связь прочная
Ионы
Ионная
Атом-
Атомы
Ковалентная (полярная,неполяр ная) очень проч-ная связь
Очень высокие T плавления, повышен-ная твёрдостью.
Алмаз, графит, B, Si, Al 2 O 3 ,
ная
SiO 2
Непрочные, летучие, легкоплавкие, способ-ны к возгонке, имеют небольшую твердость
Газы, жидкости, тв (О 2 , Н 2 , Cl 2 , N 2 , Br 2 , H 2 O, CO 2 , HCl);орг. в-ва
М/у молекулами
слабые F притяжен,
внутри прочная ковалентная связь
Молеку
Молеку-лярная
лы
Ковкие, обладают блеском, пластичностью, тепло-
и электропроводны
Метал-лическая
Атом,
Металлическая
Ме, сплавы
ионы
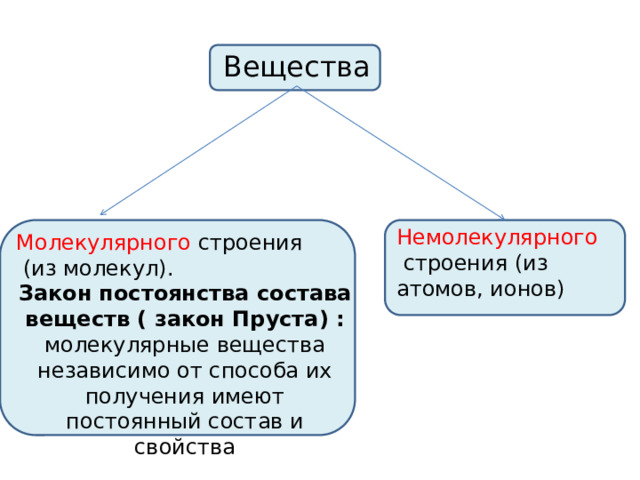
Вещества
Немолекулярного
строения (из атомов, ионов)
Молекулярного строения
(из молекул).
Закон постоянства состава веществ ( закон Пруста) : молекулярные вещества независимо от способа их получения имеют постоянный состав и свойства

По формулам определите соединения
с ионной кристаллической решеткой.
Ионная связь возникает между металлом и неметаллом .
3
2
1
NaF
NH 3
O 2
F 2
H 2
H 2 O
N 2
PH 3
CO
К 2 O
5
6
4
МgCl 2
7
8
9
LiР 3
Na 2 S
12
11
10
BaO
14
13
15
KF

Определите соединения с молекулярной
кристаллической решеткой
Это вещества с ковалентными связями (полярными и неполярными) между неметаллами
3
2
1
NaF
NH 3
К 2 O
6
5
4
O 2
МgCl 2
N 2
9
8
7
LiР 3
Na 2 S
CO
10
11
12
H 2
PH 3
BaO
14
15
13
H 2 O
KF
F 2

Вывод
- Существует следующая закономерность: если известно строение веществ, то можно предсказать их свойства, или наоборот: если известны свойства веществ, то можно определить строение.

Тест с самопроверкой
×
×
×
×
×
×
×
×
×
×





































