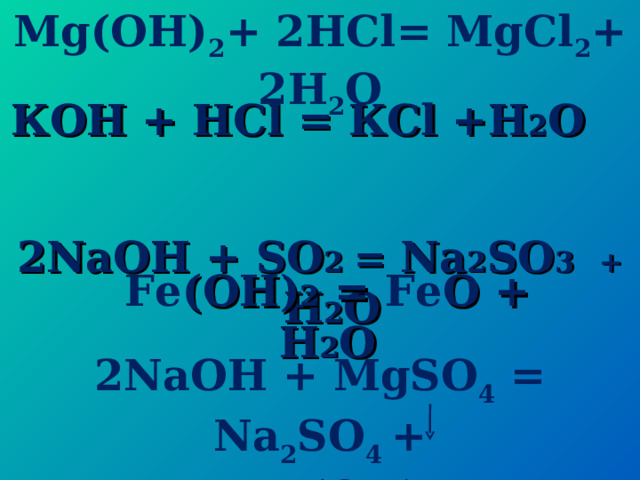Просмотр содержимого документа
«Презентация к уроку по теме "Основания, их классификация и свойства"»
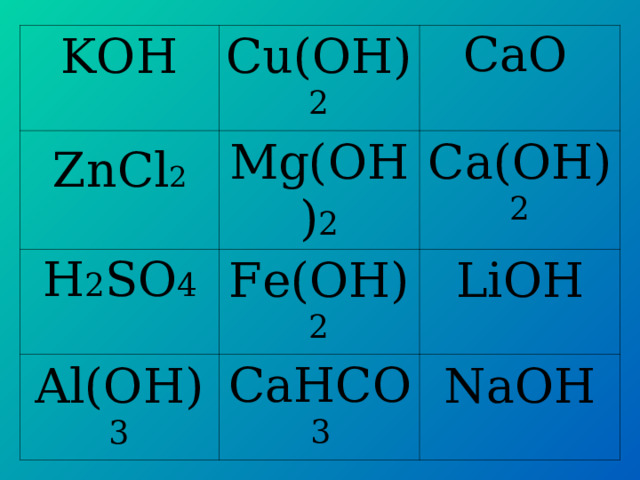
C а O
KO Н
Cu(OH) 2
Mg(OH) 2
Fe(OH) 2
Al(OH) 3
C а( OH) 2
LiOH
NaOH
ZnCl 2
H 2 SO 4
Ca НСО 3
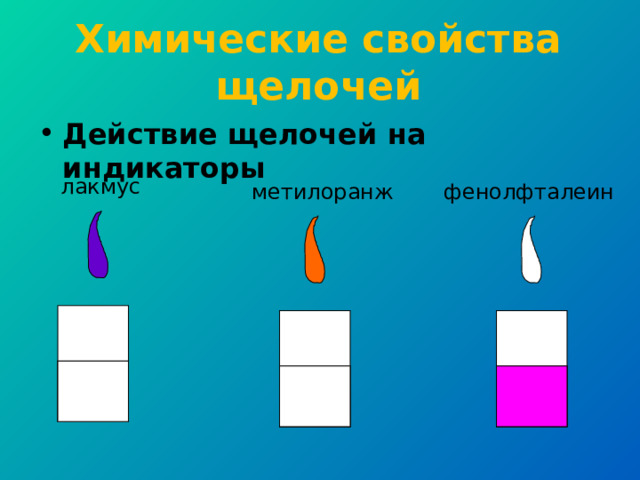
Химические свойства щелочей
- Действие щелочей на индикаторы
лакмус
метилоранж
фенолфталеин

Тема урока ОСНОВАНИЯ, их классификация и свойства

Основания
- это электролиты, диссоциирующие
на катионы металлов и
гидроксид - анионы ОН .
Me(OH) n
n = СО металла
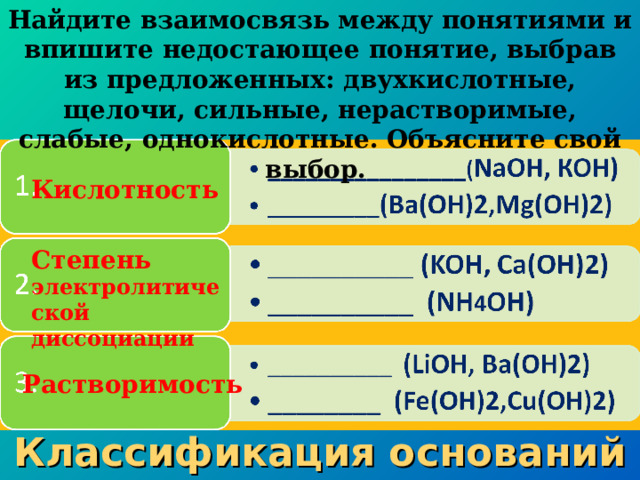
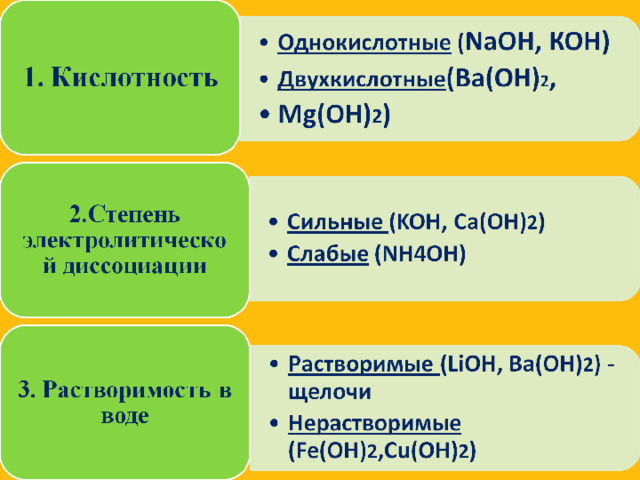
Найдите взаимосвязь между понятиями и впишите недостающее понятие, выбрав из предложенных: двухкислотные, щелочи, сильные, нерастворимые, слабые, однокислотные. Объясните свой выбор.
Кислотность
Степень электролитической диссоциации
Растворимость
Классификация оснований

Физические свойства оснований
Ba(OH) 2
Ca(OH) 2
LiOH
Co(OH) 2
NaOH
Cu(OH) 2

Из них не сваришь супа,
Содержат гидроксогруппу,
И активного металла
В их формуле немало.
Красят лакмус в синий цвет,
Они опасны, спору нет.

Растворимые основания - щёлочи
Гидроксид лития
Гидроксид натрия
Гидроксид калия
Гидроксид рубидия
Гидроксид цезия
Гидроксид кальция
Гидроксид стронция
Гидроксид бария
LiOH
N а OH
КОН
Rb OH
CsOH
Ca(OH) 2
Sr (OH) 2
Ва( OH) 2

Физкульминутка
Вы, наверное, устали?
Основания изучали.
Ну, тогда все дружно встали.
Юноши потопали,
Девушки похлопали.
А теперь наоборот.
Девушки потопали,
Юноши похлопали.
Вместе дружно улыбнулись
И за парты все вернулись.
Глазки крепко закрываем.
Дружно до пяти считаем.
Открываем, поморгаем
И работать продолжаем.

Правила Т.Б. при работе со щелочами
При попадании раствора щелочи на кожу, может образоваться язва. Чтобы этого не случилось, немедленно смойте ее большим количеством проточной воды и протрите поврежденный участок слабым раствором борной кислоты.

Типичные реакции оснований
нерастворимых
щелочей
Основание + = соль + вода
Нерастворимое основание →
оксид металла +
Щёлочь + оксид неметалла =
Щёлочь = новая соль +новое
кислота
С u (OH) 2 + 2HCl= С u Cl 2 + 2H 2 O
NaOH + HCl = NaCl + H 2 O
вода
соль + вода
С u ( OH ) 2 = С u O + H 2 O
2 NaOH + С O 2 = Na 2 С O 3 + H 2 O
+ соль
основание
2NaOH + С u SO 4 = Na 2 SO 4 +
С u (OH) 2 ↓

Для меня сегодняшний урок
О бычный
С кучный
Н епонятный
О птимальный
В сё понятно
А ктивный
Н еинтересный
И нтересный
Я работой своей доволен (а)

Домашнее задание
§3 9
Упр.1- 2 ( устно )
Упр. 3,5 (письменно)
На «4» и «5»
Упр. 4 (задача)
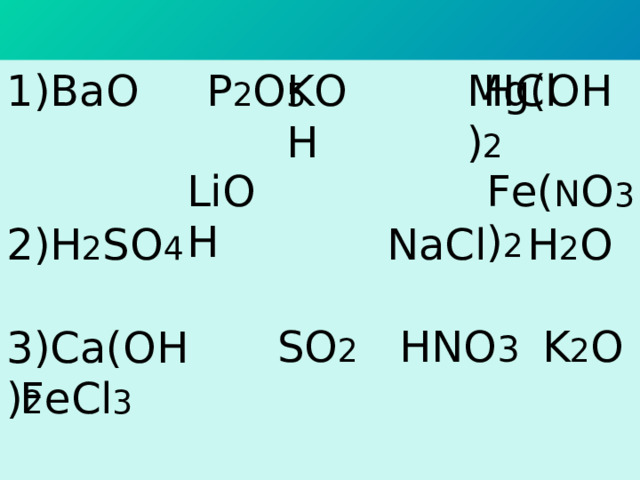
1) BaO P 2 O 5 HCl
2) H 2 SO 4 NaCl H 2 O
SO 2 HN О 3 K 2 O Fe Cl 3
KOH
Mg(OH) 2
LiOH
Fe( N O 3 ) 2
3) Ca(OH) 2
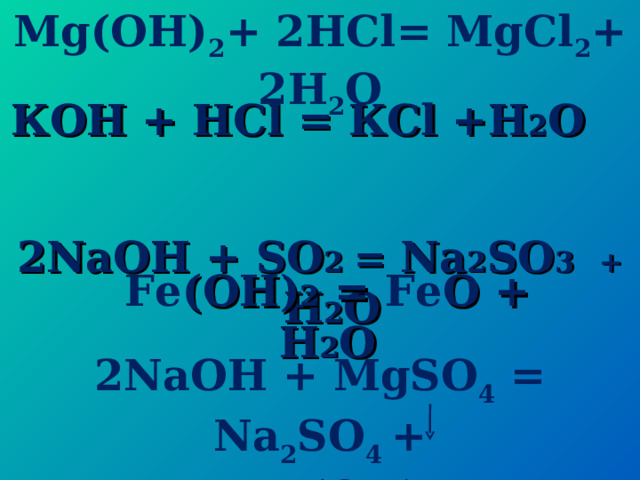
Mg(OH) 2 + 2 HCl = Mg Cl 2 + 2 H 2 O
К OH + HCl = К Cl +H 2 O
2NaOH + SO 2 = Na 2 SO 3 + H 2 O
Fe (OH) 2 = Fe O + H 2 O
2 NaOH + MgSO 4 = Na 2 SO 4 +
Mg (OH) 2