
Основания

Определение. Номенклатура.
Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними гидроксид-ионов.
M(OH) n , где M – металл, n – число групп OH - и в то же время численное значение заряда иона (степени окисления) металла
Например: Na +1 OH , Ca +2 (OH) 2 , Fe +3 (OH) 3
Название: «гидроксид» + «металла» (степень окисления, если переменная)
Cu(OH) 2 – гидроксид меди два

Определение. Номенклатура.
Валентность гидроксогруппы (ОН) – I Количество гидроксогрупп определяется валентностью металла, образующего основание.
Ме(ОН)х

Установите соответствие
KOH
Гидроксид калия
Mg(OH) 2
Гидроксид магния
Ca(OH) 2
Гидроксид кальция
Fe(OH) 3
Гидроксид железа (III)
NaOH
Гидроксид натрия
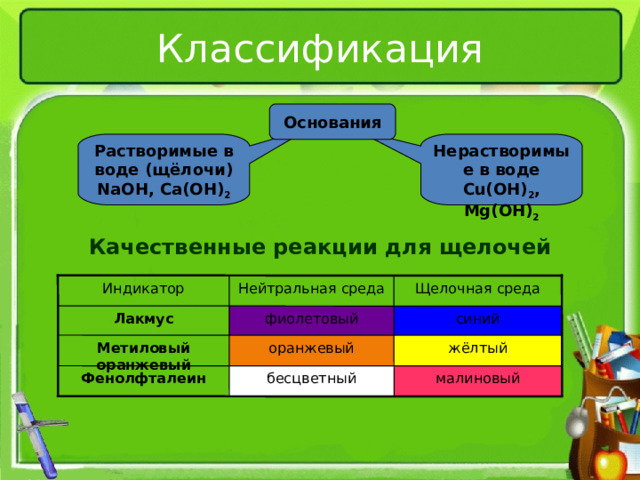
Классификация
Основания
Растворимые в воде (щёлочи)
NaOH , Ca(OH) 2
Нерастворимые в воде
Cu(OH) 2 , Mg(OH) 2
Качественные реакции для щелочей
Щелочная среда
Нейтральная среда
Индикатор
синий
Лакмус
фиолетовый
Метиловый оранжевый
оранжевый
жёлтый
Фенолфталеин
бесцветный
малиновый
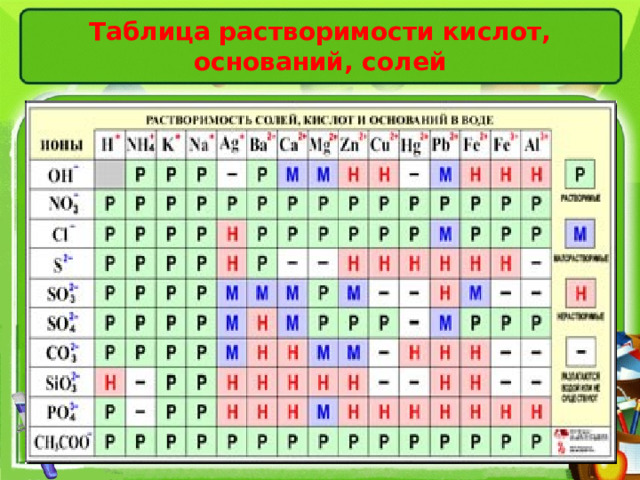
Таблица растворимости кислот, оснований, солей
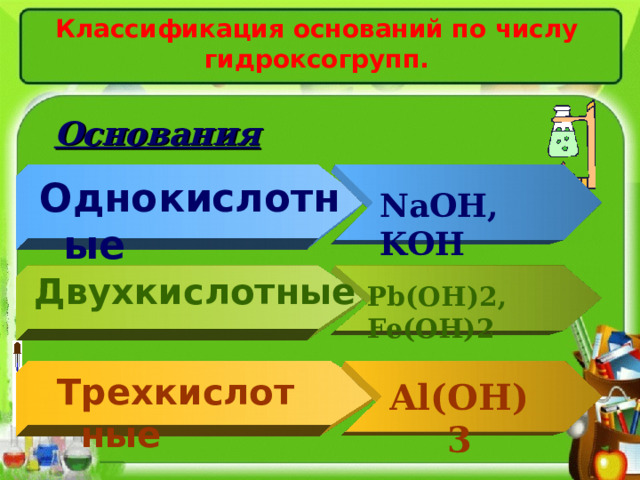
Классификация оснований по числу гидроксогрупп.
Основания
Однокислотные
NaOH , KOH
Двухкислотные
Pb(OH)2 , Fe(OH)2
Трехкислотные
Al(OH)3

Физические свойства оснований
Агрегатное состояние:
Все твердые вещества
Белого – КОН ,
Голубого - Cu(OH) 2
Красно-бурого - Fe(OH) 3
- Запах – ?
- Вкус – ? (горький, солоноватый)
- Растворимость в воде - ?
КОН
Cu(OH)2

Химические свойства нерастворимых оснований.
1). Разлагаются при нагревании.
2). Взаимодействуют с кислотами (реакция нейтрализации).

1. Термическое разложение нерастворимых оснований:
Cu(OH) 2 = t С uO + H 2 O

2. Основание + кислота:
Cu(OH) 2 + 2 HCl = Cu Cl 2 + 2 H 2 O
Реакция нейтрализации – это…

Химические свойства щелочей.
1). Изменяют окраску индикаторов.
Взаимодействуют с:
2). кислотами (реакция нейтрализации),
3). кислотными оксидами,
4). солями.

ПРАВИЛА БЕЗОПАСНОСТИ
Попавшие на кожу капли раствора щелочи немедленно смойте сильной струей холодной воды, а затем обработайте поврежденную поверхность 1% раствором уксусной кислоты.
Едкое вещество—щелочь! Разрушает и раздражает кожу, слизистые оболочки.

Щелочь + кислота :
Ва(ОН) 2 + 2НС l = ВаС l 2 + 2Н 2 О
хлорид бария

Щелочь + кислотный оксид :
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O
В ходе реакции образуется соль и вода
Для написания реакции необходимо знать,
какая кислота соответствует кислотному оксиду.
Реакция не будет протекать, т.к. основной оксид не может реагировать с основанием
Mg(OH) 2 + FeO
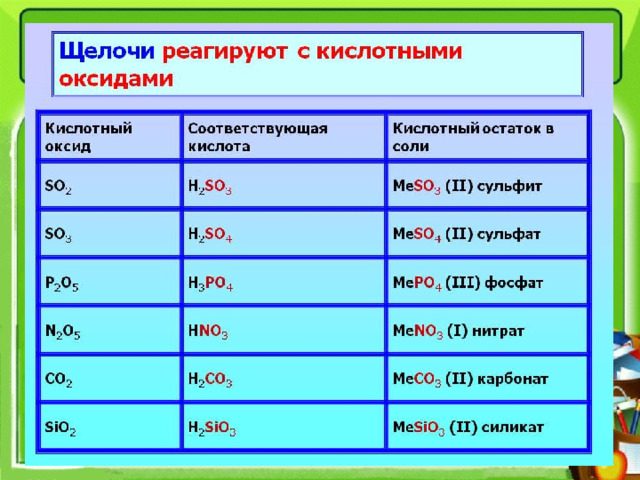

Щелочь + соль =
3
Al(OH) 3 + 3KCl
KOH + AlCl 3
Условия протекания реакции: 1). исходные вещества должны быть растворимыми 2). образование осадка

Химические свойства оснований
- Основание + кислота = соль + вода (р-ция обмена)
NaOH + HCl = NaCl + H 2 O
- Щёлочь + кислотный оксид = соль + вода (р-ция обмена)
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O
- Щёлочь + соль = новое основание + новая соль (р-ция обмена)
2NaOH + CuSO 4 = Na 2 SO 4 + Cu(OH) 2
- Разложение нерастворимых в воде оснований на оксид и воду
Cu(OH) 2 = t С uO + H 2 O

Проверьте ваши знания
- Закончите молекулярные уравнения возможных реакций:
KOH + P 2 O 5
Cu(OH) 2 + H 2 SO 4
Mg(OH) 2 + FeO
KOH + AlCl 3




































