Просмотр содержимого документа
«Презентация химия 10 класс»

СТРОЕНИЕ,ИЗОМЕРИЯ, ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ. СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ.ПРИМЕНЕНИЕ.
Работу выполнили:
- Котова Настя 10 В
- Айдынова Сюзан 10В
- Байшева Настя 10В
- Филимонов Денис 10В
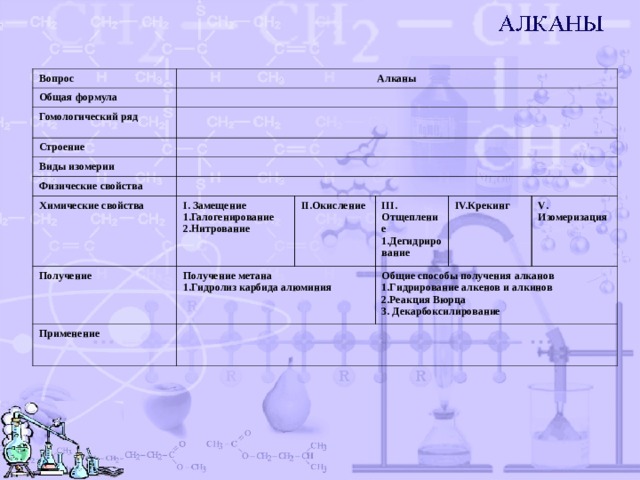
Вопрос
Алканы
Общая формула
Гомологический ряд
Строение
Виды изомерии
Физические свойства
Химические свойства
Получение
I . Замещение
1.Галогенирование
2.Нитрование
Получение метана
1.Гидролиз карбида алюминия
Применение
II .Окисление
III . Отщепление
1.Дегидрирование
IV. Крекинг
Общие способы получения алканов
1.Гидрирование алкенов и алкинов
2.Реакция Вюрца
3. Декарбоксилирование
V . Изомеризация
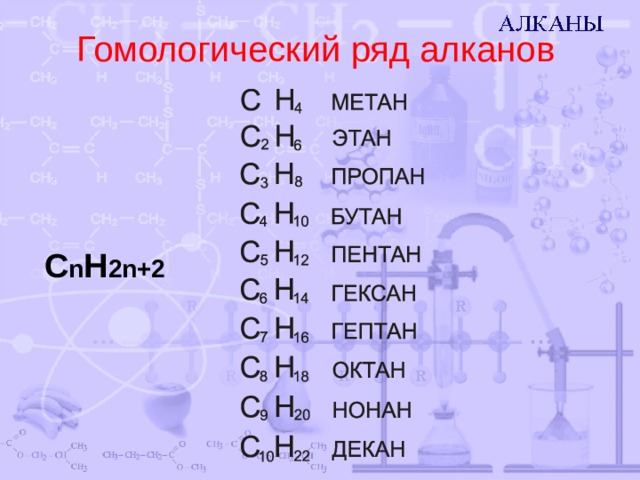
Гомологический ряд алканов
C n H 2n+2
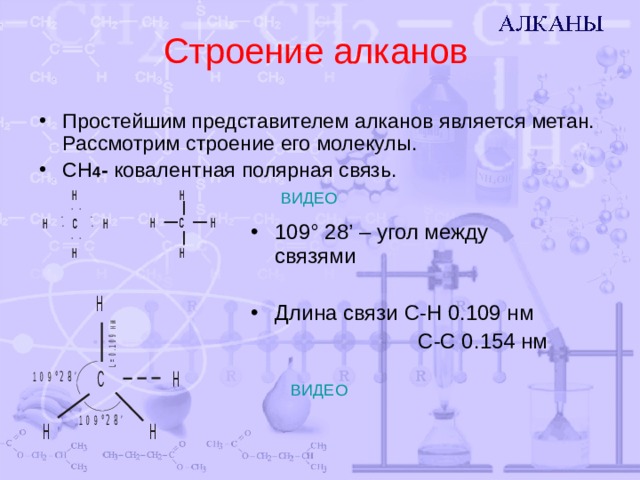
Строение алканов
- Простейшим представителем алканов является метан. Рассмотрим строение его молекулы.
- CH 4 - ковалентная полярная связь.
ВИДЕО
- 109 ° 28 ’ – угол между связями
- Длина связи C-H 0 . 109 нм
C-C 0.154 нм
ВИДЕО

Виды изомерии алканов
Для алканов характерна изомерия углеродного скелета
ВИДЕО

Физические свойства
Алканы имеют молекулярную кристаллическую решетку
- С 1 -С 4 - бесцветные газы
- С 5 -С 17 -бесцветные жидкости, имеющие запах бензина
- С 18 -твердые вещества
![Химические свойства Для алканов характерны реакции: I. Замещения -Галогенирование свет CH 4 + Cl 2 → CH 3 Cl + HCl -Нитрование t СН 4 + HONO 2 → CH 3 NO 2 +H 2 O II .Окисление -Горение СН 4 +2О 2 →СО 2 + 2Н 2 О -Каталитическое окисление СН 3 ОН СН4 + [О] → НСОН НСООН](https://fsd.multiurok.ru/html/2020/11/23/s_5fbb323de2169/img6.jpg)
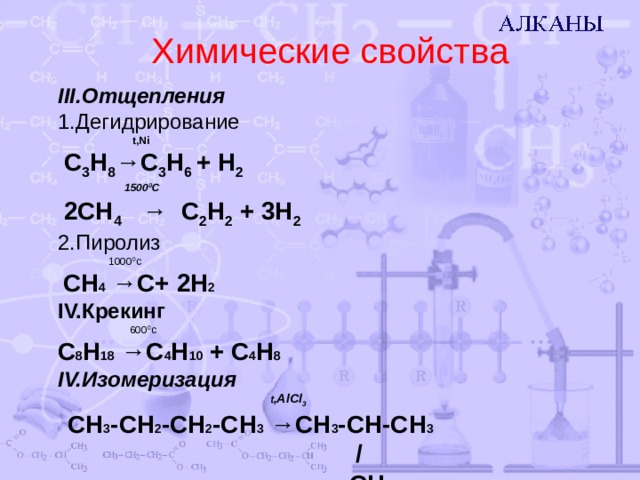
Химические свойства
Для алканов характерны реакции:
I. Замещения
-Галогенирование свет
CH 4 + Cl 2 → CH 3 Cl + HCl
-Нитрование t
СН 4 + HONO 2 → CH 3 NO 2 +H 2 O
II .Окисление
-Горение
СН 4 +2О 2 →СО 2 + 2Н 2 О
-Каталитическое окисление
СН 3 ОН
СН4 + [О] → НСОН
НСООН
Химические свойства
III .Отщепления
1. Дегидрирование
t,Ni
С 3 Н 8 →С 3 Н 6 + Н 2
1500 0 C
2СН 4 → С 2 Н 2 + 3Н 2
2. Пиролиз
1000 0 c
СН 4 →С+ 2Н 2
IV. Крекинг
600 0 c
С 8 Н 18 →С 4 Н 10 + С 4 Н 8
IV. Изомеризация
t ,AlCl 3
СН 3 - СН 2 - СН 2 - СН 3 → СН 3 - СН - СН 3
/
СН 3

Методы получения метана
1.Разложение карбида алюминия водой или кислотой.
Al 4 C 3 +12H 2 O → 4Al(OH) 3 + 3CH 4
Al 4 C 3 +12H С l → 4AlCl 3 + 3CH 4
2 .Синтез из простых веществ
t,Ni
С + 2Н 2 →СН 4
3.Восстановление оксидов углерода:
t,Ni
СО + 3Н 2 → СН 4 + Н 2 О
4 . Декарбоксилирование
CH 3 COONa + NaOH CH 4 + Na 2 CO 3
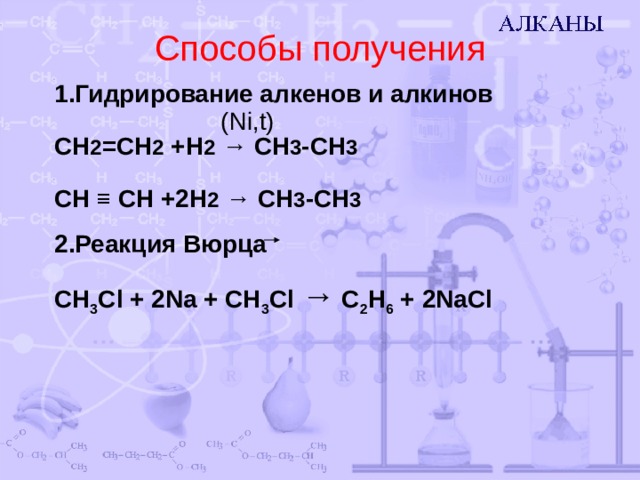
Способы получения
1.Гидрирование алкенов и алкинов
( Ni,t)
СН 2 =СН 2 +Н 2 → СН 3 -СН 3
СН ≡ СН + 2 Н 2 → СН 3 -СН 3
2 .Реакция Вюрца
СН 3 С l + 2Na + CH 3 Cl → C 2 H 6 + 2NaCl

Применение
Для получения:
1. Резины
2.Типографской краски
3.Синтетического бензина
4.Синтез-газа
5.Растворителей
6.Горючего
7.Хладаагентов
Ресурсы
1.И.И. Новошинский, Н.С.Новошинская
«Органическая химия 11»
2. С D –диск «Виртуальная лаборатория, 9 класс»
3.С D -диск «Уроки химии Кирилла и Мефодия»











![Химические свойства Для алканов характерны реакции: I. Замещения -Галогенирование свет CH 4 + Cl 2 → CH 3 Cl + HCl -Нитрование t СН 4 + HONO 2 → CH 3 NO 2 +H 2 O II .Окисление -Горение СН 4 +2О 2 →СО 2 + 2Н 2 О -Каталитическое окисление СН 3 ОН СН4 + [О] → НСОН НСООН](https://fsd.multiurok.ru/html/2020/11/23/s_5fbb323de2169/img6.jpg)























