Просмотр содержимого документа
«Презентация на тему "Амины"»

АМИНЫ
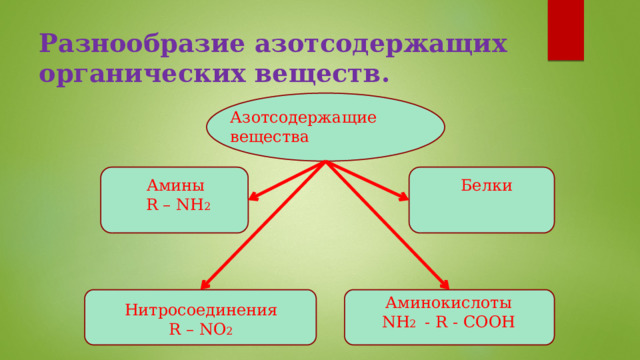
Разнообразие азотсодержащих органических веществ.
Азотсодержащие вещества
Белки
Амины
R – NH 2
Аминокислоты
NH 2 - R - COOH
Нитросоединения
R – NO 2

Амины
Амины – органические производные аммиака , в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы:
RNH 2 , R 2 NH, R 3 N.
Группа – NH 2 называется аминогруппой.
Представитель: метиламин

История изучения аминов.
Первооткрывателями аминов считаются Ш.А. Вюрц и
А. В.Гофман (середина 19 века). Ученые получили первичные, вторичные и третичные амины.
Шарль Адольф Вюрц
(1817 – 1884)
Август Вильгельм Гофман
(1818 – 1892)

История изучения аминов.
Русский химик – органик. Открыл метод получения ароматических аминов восстановлением ароматических нитросоединений (реакция Зинина). Синтезировал анилин, заложил основы анилинокрасочной промышленности.
Николай Николаевич Зинин
( 1812 – 1880)
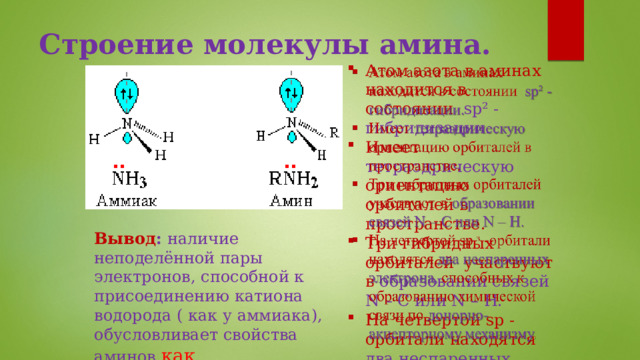
Строение молекулы амина.
- Атом азота в аминах находится в состоянии sp² - гибридизации.
- Имеет тетраэдрическую ориентацию орбиталей в пространстве.
- Три гибридных орбиталей участвуют в образовании связей N – C или N – H.
- На четвертой sp -орбитали находятся два неспаренных электрона, способных к образованию химической связи по донорно-акцепторному механизму .
Вывод : наличие неподелённой пары электронов, способной к присоединению катиона водорода ( как у аммиака), обусловливает свойства аминов как органических оснований.
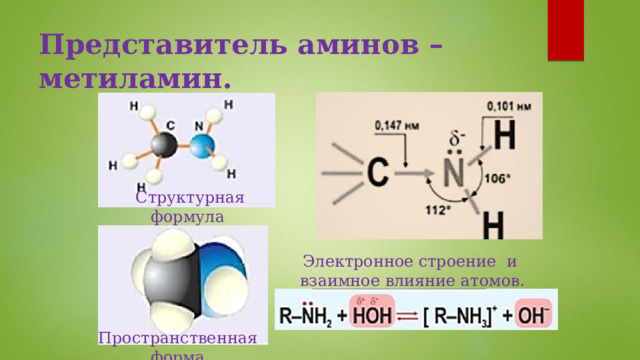
Представитель аминов – метиламин.
Структурная формула
Электронное строение и взаимное влияние атомов.
Пространственная форма



Номенклатура аминов
- В большинстве случаев названия аминов образуют из названий углеводородных радикалов и суффикса амин :
CH 3 -NH 2 Метиламин
CH 3 -CH 2 -NH 2 Этиламин
- Различные радикалы перечисляются в алфавитном порядке:
CH 3 -CH 2 -NH-CH 3 Метилэтиламин
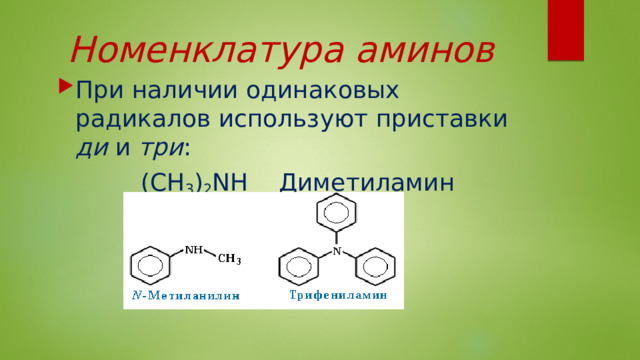
Номенклатура аминов
- При наличии одинаковых радикалов используют приставки ди и три :
(CH 3 ) 2 NH Диметиламин


Получение аминов
1 способ
2 способ
3 способ

Получение аминов.
4 способ
! При реакции Гофмана группа (Ar) R:
мигрирует от атома углерода к
соседнему атому азота.

Физические свойства аминов
- Связь N–H является полярной , поэтому первичные и вторичные амины образуют межмолекулярные водородные связи (несколько более слабые, чем Н-связи с участием группы О–Н):

Физические свойства аминов
- Это объясняет относительно высокую температуру кипения аминов по сравнению с неполярными соединениями со сходной молекулярной массой. Например:
- Третичные амины не образуют ассоциирующих водородных связей (отсутствует группа N–H). Поэтому их температуры кипения ниже, чем у изомерных первичных и вторичных аминов (триэтиламин кипит при 89 °С, а н -гексиламин – при 133 °С).

Физические свойства аминов
- При обычной температуре только низшие алифатические амины CH 3 NH 2 , (CH 3 ) 2 NH и (CH 3 ) 3 N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
- Ароматические амины – бесцветные высококипящие жидкости или твердые вещества.
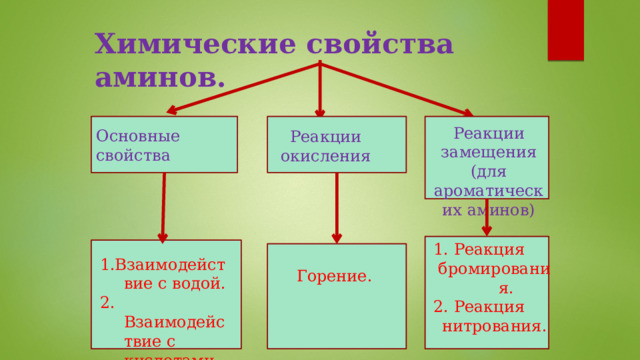
Химические свойства аминов.
Основные свойства
Реакции замещения (для ароматических аминов)
Реакции окисления
1. Реакция
бромирования.
2. Реакция
нитрования.
Горение.
1.Взаимодействие с водой.
2. Взаимодействие с кислотами.
![Химические свойства аминов Взаимодействие с водой ( изменяют цвет индикаторов, проявляя основные свойства): CH 3 – NH 2 + H 2 O = [CH 3 NH 3 ] + + OH ˉ метиламмония 2. Взаимодействие с минеральными кислотами : CH 3 – NH 2 + HCl = [CH 3 NH 3 ] + Clˉ метиламмония хлорид 3. Реакция горения: 4CH 3 NH 2 + 9O 2 = 4CO 2 + 2N 2 + 10H 2 O Взаимодействие с бромной водой: C 6 H 5 NH 2 + 3Br 2 = C 6 H 2 Br 3 NH 2 ↓ + 3HBr 2,4,6-трибромамнилин (белый осадок)](https://fsd.multiurok.ru/html/2022/04/05/s_624c8f7a0592c/img18.jpg)
Химические свойства аминов
- Взаимодействие с водой ( изменяют цвет индикаторов, проявляя основные свойства):
CH 3 – NH 2 + H 2 O = [CH 3 NH 3 ] + + OH ˉ
метиламмония
2. Взаимодействие с минеральными кислотами :
CH 3 – NH 2 + HCl = [CH 3 NH 3 ] + Clˉ
метиламмония хлорид
3. Реакция горения:
4CH 3 NH 2 + 9O 2 = 4CO 2 + 2N 2 + 10H 2 O
- Взаимодействие с бромной водой:
C 6 H 5 NH 2 + 3Br 2 = C 6 H 2 Br 3 NH 2 ↓ + 3HBr
2,4,6-трибромамнилин
(белый осадок)
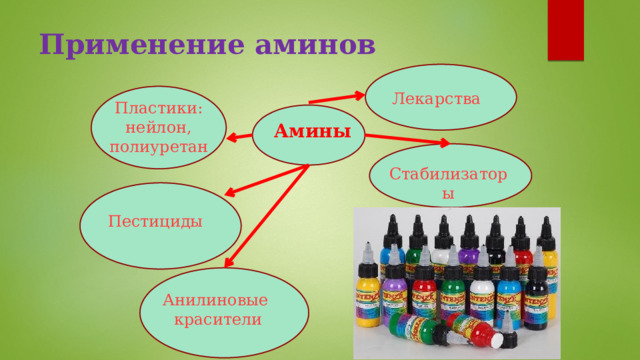
Применение аминов
Лекарства
Пластики:
нейлон, полиуретан
Амины
Стабилизаторы
Пестициды
Анилиновые красители

Домашнее задание:

























![Химические свойства аминов Взаимодействие с водой ( изменяют цвет индикаторов, проявляя основные свойства): CH 3 – NH 2 + H 2 O = [CH 3 NH 3 ] + + OH ˉ метиламмония 2. Взаимодействие с минеральными кислотами : CH 3 – NH 2 + HCl = [CH 3 NH 3 ] + Clˉ метиламмония хлорид 3. Реакция горения: 4CH 3 NH 2 + 9O 2 = 4CO 2 + 2N 2 + 10H 2 O Взаимодействие с бромной водой: C 6 H 5 NH 2 + 3Br 2 = C 6 H 2 Br 3 NH 2 ↓ + 3HBr 2,4,6-трибромамнилин (белый осадок)](https://fsd.multiurok.ru/html/2022/04/05/s_624c8f7a0592c/img18.jpg)




















