
спирты
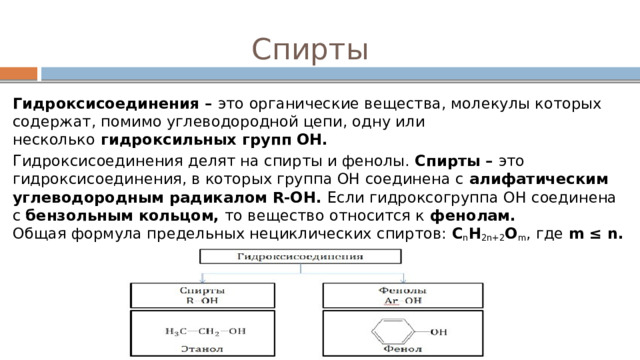
Спирты
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы. Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. Общая формула предельных нециклических спиртов: C n H 2n+2 O m , где m ≤ n.
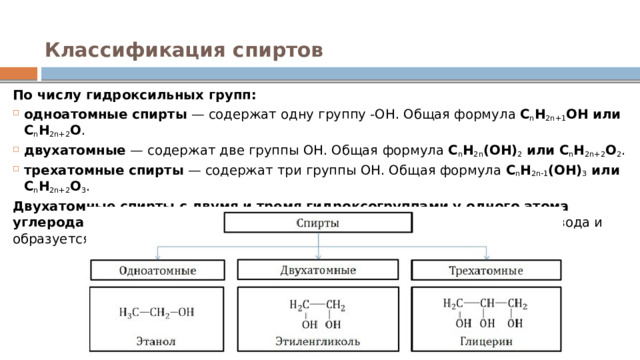
Классификация спиртов
По числу гидроксильных групп:
- одноатомные спирты — содержат одну группу -ОН. Общая формула C n H 2n+1 OH или C n H 2n+2 O .
- двухатомные — содержат две группы ОН. Общая формула C n H 2n (OH) 2 или C n H 2n+2 O 2 .
- трехатомные спирты — содержат три группы ОН. Общая формула C n H 2n-1 (OH) 3 или C n H 2n+2 O 3 .
Двухатомные спирты с двумя и тремя гидроксогруппами у одного атома углерода R‒CH(OH) 2 или R-C(OH) 3 неустойчивы , от них легко отрывается вода и образуется карбонильное соединение.
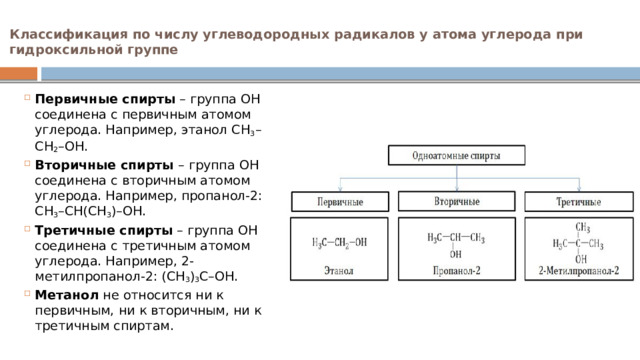
Классификация по числу углеводородных радикалов у атома углерода при гидроксильной группе
- Первичные спирты – группа ОН соединена с первичным атомом углерода. Например, этанол СН 3 –СН 2 –ОН.
- Вторичные спирты – группа ОН соединена с вторичным атомом углерода. Например, пропанол-2: СН 3 –СН(СН 3 )–ОН.
- Третичные спирты – группа ОН соединена с третичным атомом углерода. Например, 2-метилпропанол-2: (СН 3 ) 3 С–ОН.
- Метанол не относится ни к первичным, ни к вторичным, ни к третичным спиртам.

Классификация по строению углеводородного радикала
Предельные спирты – группа ОН соединена с предельным радикалом. Например, пропанол-1: СН 3 –СН 2 –СН 2 –ОН.
Непредельные спирты – группа ОН соединена с непредельным радикалом. Например, алкенолы: СН 2 =СН–СН 2 –ОН. Непредельные спирты, в которых гидроксильная группа соединена с атомом углерода при двойной связи (алкенолы), неустойчивы и изомеризуются в соответствующие карбонильные соединения. Ароматические спирты – содержат в радикале ароматическое кольцо, не связанное непосредственно с группой ОН. Например, бензиловый спирт.

Строение спиртов
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О. Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.

Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи . Водородные связи вызывают притяжение и ассоциацию молекул спиртов: Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения метанола +64,5 о С). Температуры кипения многоатомных спиртов и фенолов значительно выше. Таблица. Температуры кипения некоторых спиртов и фенола.

Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются: Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде.
Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.

Номенклатура спиртов
По систематической номенклатуре к названию углеводорода добавляют суффикс «-ОЛ» и цифру, указывающую номер атома углерода, к которому присоединена гидроксильная группа.
Нумерация ведется от ближайшего к ОН-группе конца цепи. По радикально-функциональной номенклатуре названия спиртов составляют от названий углеводородных радикалов, соединенных с группой ОН, с добавлением слова «спирт».
Например: СН 3 ОН – метиловый спирт, С 2 Н 5 ОН – этиловый спирт и т.д.
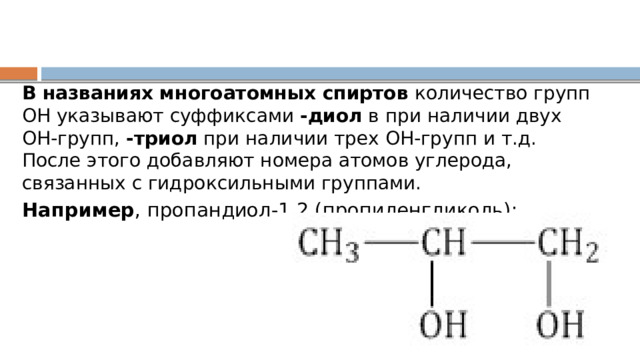
В названиях многоатомных спиртов количество групп ОН указывают суффиксами -диол в при наличии двух ОН-групп, -триол при наличии трех ОН-групп и т.д. После этого добавляют номера атомов углерода, связанных с гидроксильными группами.
Например , пропандиол-1,2 (пропиленгликоль):

Изомерия спиртов Структурная изомерия
Для спиртов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения гидроксильной группы и межклассовая изомерия . Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для спиртов, которые содержат не менее четырех атомов углерода. Например. Формуле С 4 Н 9 ОН соответствуют четыре структурных изомера, из них два различаются строением углеродного скелета
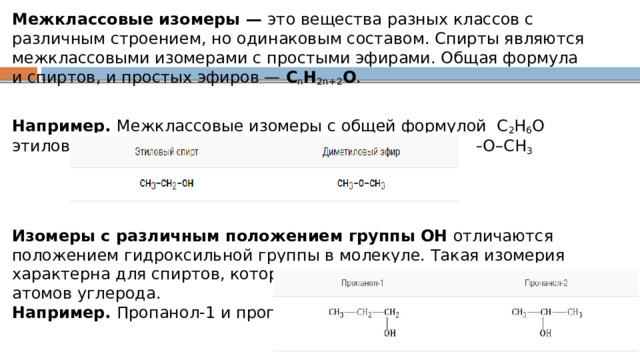
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — C n H 2n+2 О .
Например. Межклассовые изомеры с общей формулой С 2 Н 6 О этиловый спирт СН 3 –CH 2 –OH и диметиловый эфир CH 3 –O–CH 3
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле. Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода. Например. Пропанол-1 и пропанол-2

Химические свойства спиртов
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения , либо реакции отщепления (элиминирования) .
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н + соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.

С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления. Таким образом, для спиртов характерны следующие свойства:
слабые кислотные свойства, замещение водорода на металл;
замещение группы ОН
отрыв воды (элиминирование) – дегидратация
окисление
образование сложных эфиров — этерификация

1. Кислотные свойства 1.1. Взаимодействие с раствором щелочей
Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. При взаимодействии спиртов с растворами щелочей реакция практически не идет , т. к. образующиеся алкоголяты почти полностью гидролизуются водой. Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому спирты не взаимодействуют с растворами щелочей .
Многоатомные спирты также не реагируют с растворами щелочей.

1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Спирты взаимодействуют с активными металлами (щелочными и щелочноземельными) . При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты. Например, этанол взаимодействует с калием с образованием этилата калия и водорода. Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла. Например, этилат калия разлагается водой:
 первичные спирты вторичные спирты третичные спирты Многоатомные спирты также реагируют с активными металлами: " width="640"
первичные спирты вторичные спирты третичные спирты Многоатомные спирты также реагируют с активными металлами: " width="640"
Кислотные свойства одноатомных спиртов уменьшаются в ряду:
CH 3 OH первичные спирты вторичные спирты третичные спирты Многоатомные спирты также реагируют с активными металлами:
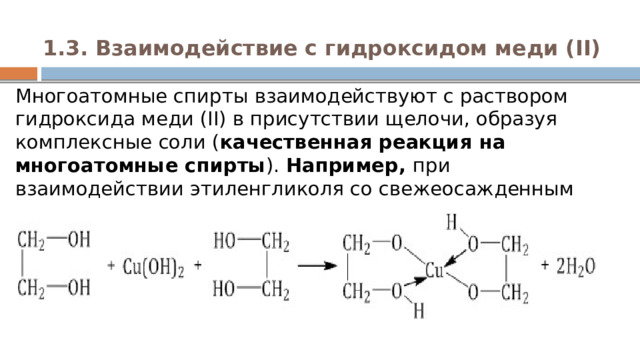
1.3. Взаимодействие с гидроксидом меди (II)
Многоатомные спирты взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соли ( качественная реакция на многоатомные спирты ). Например, при взаимодействии этиленгликоля со свежеосажденным гидроксидом меди (II) образуется ярко-синий раствор гликолята меди:
 вторичные первичные CH 3 OH . Многоатомные спирты также, как и одноатомные спирты, реагируют с галогеноводородами. Например, этиленгликоль реагирует с бромоводородом: " width="640"
вторичные первичные CH 3 OH . Многоатомные спирты также, как и одноатомные спирты, реагируют с галогеноводородами. Например, этиленгликоль реагирует с бромоводородом: " width="640"
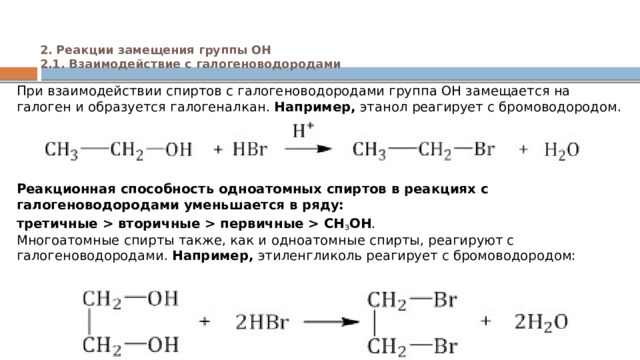
2. Реакции замещения группы ОН 2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан. Например, этанол реагирует с бромоводородом.
Реакционная способность одноатомных спиртов в реакциях с галогеноводородами уменьшается в ряду:
третичные вторичные первичные CH 3 OH . Многоатомные спирты также, как и одноатомные спирты, реагируют с галогеноводородами. Например, этиленгликоль реагирует с бромоводородом:

2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе. Например, при взаимодействии этанола с аммиаком образуется этиламин.
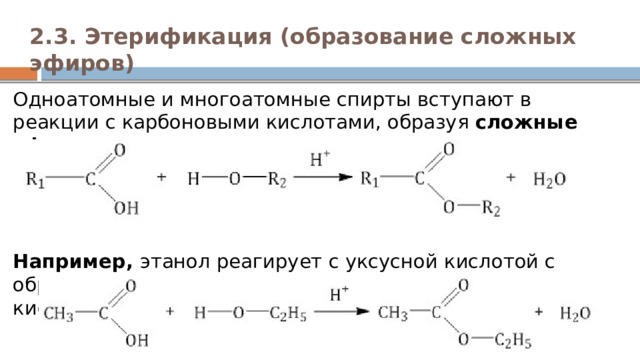
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры . Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):
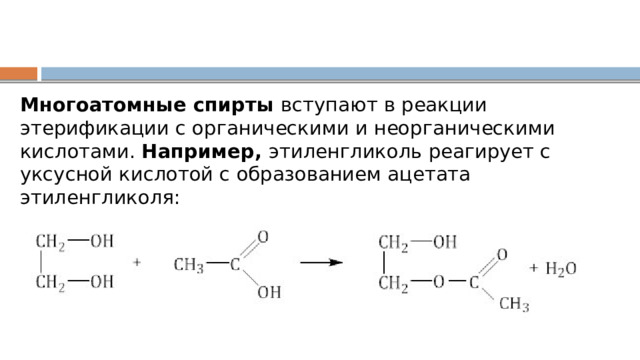
Многоатомные спирты вступают в реакции этерификации с органическими и неорганическими кислотами. Например, этиленгликоль реагирует с уксусной кислотой с образованием ацетата этиленгликоля:

2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной. Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат: Например, глицерин под действием азотной кислоты образует тринитрат глицерина (тринитроглицерин):

3. Реакции замещения группы -ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
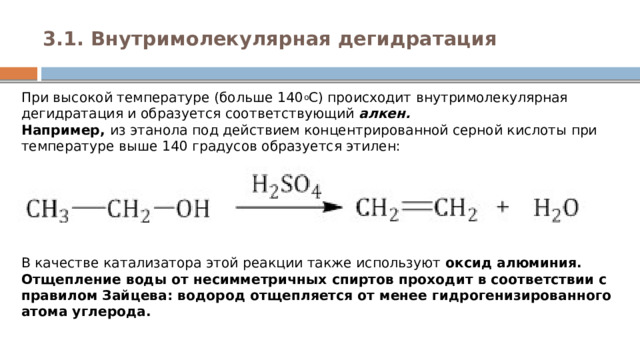
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140 о С) происходит внутримолекулярная дегидратация и образуется соответствующий алкен. Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен:
В качестве катализатора этой реакции также используют оксид алюминия. Отщепление воды от несимметричных спиртов проходит в соответствии с правилом Зайцева: водород отщепляется от менее гидрогенизированного атома углерода.
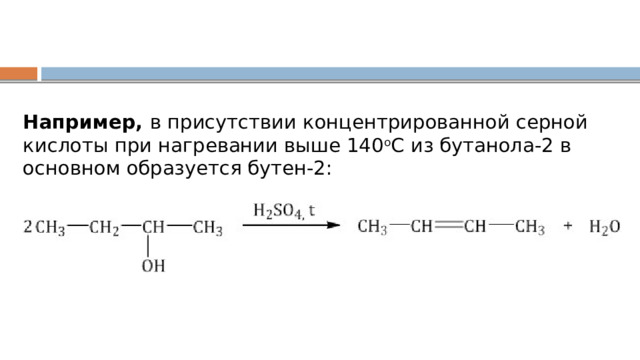
Например, в присутствии концентрированной серной кислоты при нагревании выше 140 о С из бутанола-2 в основном образуется бутен-2:

3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир. Например, при дегидратации этанола при температуре до 140 о С образуется диэтиловый эфир:

4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
При окислении первичных спиртов они последовательно превращаются сначала в альдегиды , а потом в карбоновые кислоты. Глубина окисления зависит от окислителя.
Первичный спирт → альдегид → карбоновая кислота Метанол окисляется сначала в формальдегид, затем в углекислый газ:
Метанол → формальдегид → углекислый газ Вторичные спирты окисляются в кетоны: вторичные спирты → кетоны

Типичные окислители — оксид меди (II), перманганат калия KMnO 4 , K 2 Cr 2 O 7 , кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол
Продукты окисления многоатомных спиртов зависят от их строения. При окислении оксидом меди многоатомные спирты образуют карбонильные соединения.
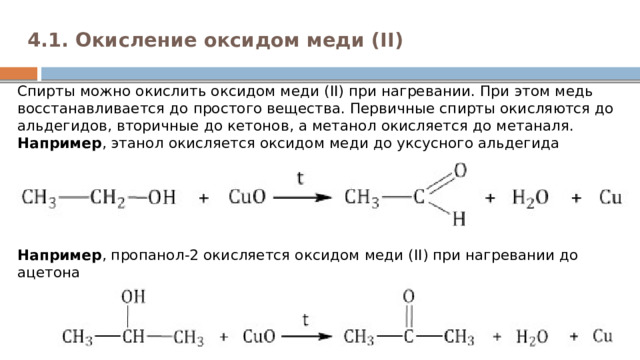
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя. Например , этанол окисляется оксидом меди до уксусного альдегида
Например , пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона
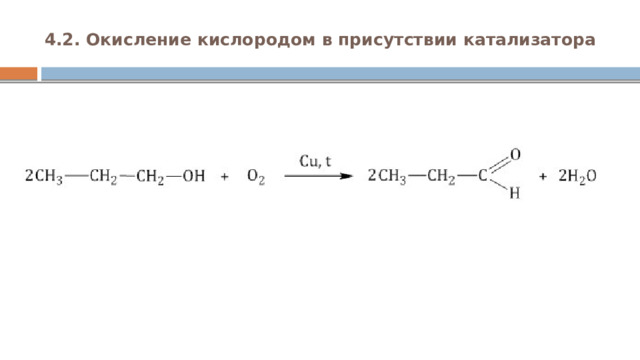
4.2. Окисление кислородом в присутствии катализатора

4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот, вторичные спирты окисляются до кетонов, метанол окисляется до углекислого газа. При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси. Третичные спирты окисляются только в жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов. При этом происходит разрыв углеродной цепи и могут образоваться углекислый газ, карбоновая кислота или кетон , в зависимости от строения спирта.

Например , при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ Например , при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота Например , при взаимодействии изопропанола с перманганатом калия в серной кислоте образуется ацетон

4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты. C n H 2n+1 ОН + (3n+1)/2O 2 → nCO 2 + (n+1)H 2 O + Q Например , уравнение сгорания метанола: 2CH 3 OH + 3O 2 = 2CO 2 + 4H 2 O
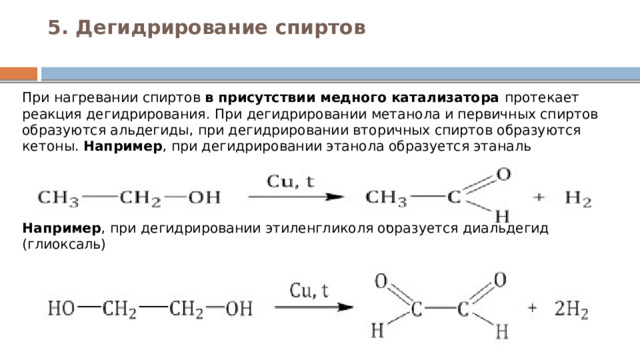
5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола и первичных спиртов образуются альдегиды, при дегидрировании вторичных спиртов образуются кетоны. Например , при дегидрировании этанола образуется этаналь Например , при дегидрировании этиленгликоля образуется диальдегид (глиоксаль)

Получение спиртов 1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу. Например , при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол Например , глицерин можно получить щелочным гидролизом 1,2,3-трихлорпропана:
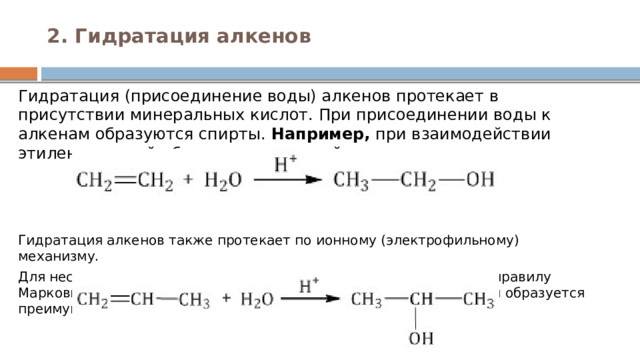
2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты. Например, при взаимодействии этилена с водой образуется этиловый спирт. Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова. Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2.
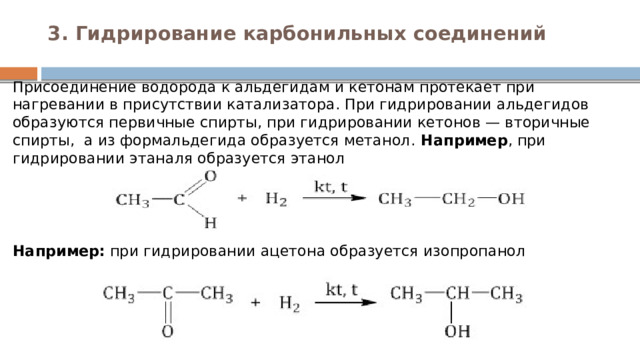
3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол. Например , при гидрировании этаналя образуется этанол
Например: при гидрировании ацетона образуется изопропанол

4. Окисление алкенов холодным водным раствором перманганата калия
Алкены реагируют с водным раствором перманганата калия без нагревания. При этом образуются двухатомные спирты (гликоли).

5. Промышленное получение метанола из «синтез-газа»
- Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
- Сырьем для синтеза метанола служит «синтез-газ» (смесь CO и H 2 ), обогащенный водородом:
CO + 2H 2 ⇄ CH 3 OH
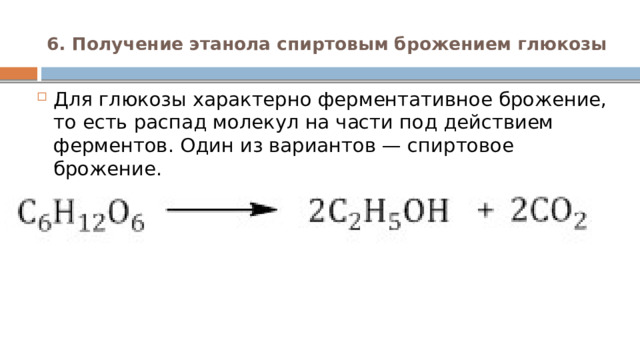
6. Получение этанола спиртовым брожением глюкозы
- Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.

7. Гидролиз жиров – способ получения многоатомных спиртов
Под действием кислоты жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира Например: при гидролизе тристеарата глицерина образуется глицерин и стеариновая кислота.























 первичные спирты вторичные спирты третичные спирты Многоатомные спирты также реагируют с активными металлами: " width="640"
первичные спирты вторичные спирты третичные спирты Многоатомные спирты также реагируют с активными металлами: " width="640"

 вторичные первичные CH 3 OH . Многоатомные спирты также, как и одноатомные спирты, реагируют с галогеноводородами. Например, этиленгликоль реагирует с бромоводородом: " width="640"
вторичные первичные CH 3 OH . Многоатомные спирты также, как и одноатомные спирты, реагируют с галогеноводородами. Например, этиленгликоль реагирует с бромоводородом: " width="640"

































