Просмотр содержимого документа
«Презентация "Общая характеристика неметаллов"»

Общая характеристика неметаллов

Распространенность
- Химических элементов-неметаллов всего 16
- Два из них, кислород и кремний составляют 76 % от массы земной коры.
- Неметаллы составляют 98,5 % от массы растений и 97,6 % от массы человека. Из углерода, водорода, кислорода, серы, фосфора и азота состоят все важнейшие органические вещества, они являются элементами жизни.
- Водород и гелий – основные элементы Вселенной из них состоят все космические объекты, включая Солнце.
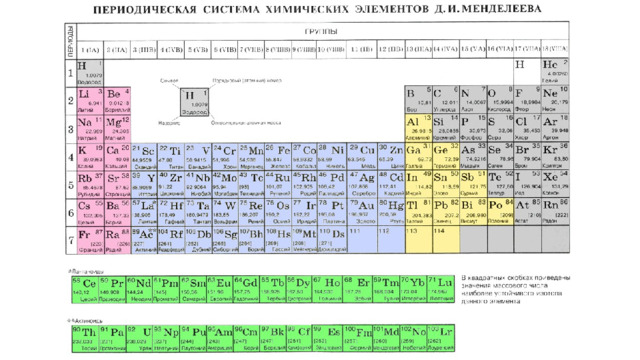

Особенности строения атомов
- Неметаллы – это химические элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы.
- Практически все неметаллы имеют сравнительно малые радиусы и большое число электронов на внешнем энергетическом уровне от 4 до 7 (кроме бора и водорода), для них характерны высокие значения электроотрицательности и окислительные свойства.
- Инертные газы, занимают особое положение, они имеют полностью завершенный внешний электронный слой и занимают промежуточное положение между металлами и неметаллами. Их иногда относят к неметаллам, но формально, по физическим признакам.


Закономерности в изменении свойств элементов
- В периоде:
- заряд ядра увеличивается,
- радиус атома уменьшается,
- число электронов на внешнем энергетическом уровне увеличивается,
- электроотрицательность увеличивается,
- окислительные свойства усиливаются,
- неметаллические свойства усиливаются.
- В группе:
- заряд ядра увеличивается,
- радиус атома увеличивается,
- число электронов на внешнем энергетическом уровне не изменяется,
- электроотрицательность уменьшается,
- окислительные свойства ослабевают,
- неметаллические свойства ослабевают.
Таким образом, чем правее и выше стоит элемент в Периодической системе, тем ярче выражены его неметаллические свойства.

Простые вещества металлы

Особенности простых веществ
- Практически все неметаллы имеют свой цвет.
- Все неметаллы не проводят тепло и электрический ток.
- Кристаллы неметаллов непластичные и хрупкие, так как любая деформация приводит к разрушению химических связей.
- Большинство из неметаллов не имеют металлического блеска.
- Могут проявлять как окислительные, так и восстановительные свойства, в зависимости от химического превращения, в котором они принимают участие.
- Атомы самого электроотрицательного элемента – фтора – не способны отдавать электроны, он всегда проявляет только окислительные свойства, другие элементы могут проявлять и восстановительные свойства, хотя намного в меньшей степени, чем металлы.
- Наиболее сильными окислителями являются фтор, кислород и хлор,
- Преимущественно восстановительные свойства проявляют водород, бор, углерод, кремний, фосфор, мышьяк и теллур. Промежуточные окислительно-восстановительные свойства имеют азот, сера, йод.

Химические свойства
- Взаимодействие с металлами:
2Na + Cl 2 = 2NaCl,
Fe + S = FeS,
6Li + N 2 = 2Li 3 N,
2Ca + O 2 = 2CaO
- Взаимодействие с другими неметаллами:
- взаимодействуя с водородом , большинство неметаллов проявляет окислительные свойства:
- взаимодействуя с водородом , большинство неметаллов проявляет окислительные свойства:
3H 2 + N 2 = 2NH 3 ,
H 2 + Br 2 = 2HBr;
- взаимодействуя с кислородом , все неметаллы, кроме фтора, проявляют восстановительные свойства:
- взаимодействуя с кислородом , все неметаллы, кроме фтора, проявляют восстановительные свойства:
S + O 2 = SO 2 ,
4P + 5O 2 = 2P 2 O 5 ;
- при взаимодействии с фтором фтор является окислителем, а кислород – восстановителем:
- при взаимодействии с фтором фтор является окислителем, а кислород – восстановителем:
2F 2 + O 2 = 2OF 2 ;
- неметаллы взаимодействуют между собой :
- неметаллы взаимодействуют между собой :
S + 3F 2 = SF 6 ,

Взаимодействие сложных веществ с кислородом (горение) Неметалл кислород проявляет окислительные свойства при взаимодействии с некоторыми сложными веществами:
2H 2 S + 3O 2 = 2H 2 O + 2SO 2 ,
4NH 3 +5O 2 = 4NO + 6H 2 O.
Взаимодействие с водородом Водород выступает в качестве восстановителя при взаимодействии, например, с оксидами металлов:
CuO + H 2 = Cu + H 2 O.
Взаимодействие с другими неметаллами В зависимости от химической реакции неметаллы при взаимодействии со сложными веществами могут проявлять свойства:
2FeCl 2 + Cl 2 = 2FeCl 3 ,
2NaBr + Cl 2 = 2NaCl + Br 2 ;
S + 6HNO 3 = H 2 SO 4 + 6NO 2 + 2H 2 O,
3P +5HNO 3 + 2H 2 O = 3H 3 PO 4 + 5NO;
- 3) один и тот же неметалл может выступать в качестве окислителя и восстановителя одновременно:
3Cl 2 + 6KOH = 5KCl + KClO 3 + 3H 2 O.



































