
НЕМЕТАЛЛЫ
ОБЩИЕ СВЕДЕНИЯ

Красный фосфор
сера
алмазы
йод
графит
кремний
неметаллы
Общая характеристика

Неметаллы
Общая характеристика
- Кислород и кремний составляют 76% от массы земной коры (О – 49%, Si – 27%)
- C,H,O,N,P,S – биогенные элементы, составляют 98,5% от массы растений и 97,6% от массы тела человека

Неметаллы
Общая характеристика
- В состав земной атмосферы входят простые и сложные вещества, образованные элементами-неметаллами ( N 2 -75,5% , O 2 -23,2% , а также CO 2 ,H 2 O и др.)
- Водород – главный элемент Вселенной (Солнце и другие звёзды, газовые облака и т.д.) Из каждых 100 атомов на Земле 17 – это атомы водорода.

Элементы в неживой природе.

Нахождение в природе .
Самородные элементы
Азот и кислород, инертные газы в составе воздуха
Сера
Графит С
Алмаз С

Нахождение в природе
← Апатиты Р
Галит NaCl →
← FeS 2 пирит
Кварц SiO 2 →

Неметаллы - это химические элементы, которые могут проявлять свойства как окислителя ( принимают электроны), так и восстановителя (отдают электроны).
НеМ – элементы с высокой ОЭО (2 - 4)
Исключения : фтор – только окислитель,
инертные газы – могут только отдавать электроны.
Гелий, неон и аргон – соединений не образуют.

Соединения неметаллов.
- Оксиды – только кислотные
SO 3 , SO 2 , CO 2 и другие.
- (кроме NO и CO –безразличные)
- Гидроксиды – только кислоты
H 2 SO 4 , H 2 SO 3 ,H 2 CO 3 и другие
Образуют летучие соединения с водородом HCl, NH 3 …

ПОЛОЖЕНИЕ в ПСХЭ
I А
1
II А
2
III А
3
IV А
4
V А
5 B
5
VI А
6 C
6
VII А
14 Si
1 H
7
7 N
VIII А
15 P
8 O
16 S
2 He
9 F
33 As
34 Se
10 Ne
17 Cl
35 Br
52 Te
18 Ar
36 Kr
53 I
54 Xe
85 At
86 Rn

Агрегатное состояние
Газообразное
Жидкое
Не N 2 Н 2 Cl 2 O 2 O 3
Твёрдое
Br 2
I 2 P 4 C Si B S 8
 Характеристики сравнения Атомы металлов Количество электронов на внешнем уровне Атомы неметаллов Радиус атома Электроотрицательность Способность отдавать и принимать электроны с целью завершения внешнего энергетического уровня По периоду – уменьшается, по группе - возрастает По периоду – возрастает, по группе - уменьшается Способны только отдавать электроны Более склонны принимать электроны, чем отдавать их " width="640"
Характеристики сравнения Атомы металлов Количество электронов на внешнем уровне Атомы неметаллов Радиус атома Электроотрицательность Способность отдавать и принимать электроны с целью завершения внешнего энергетического уровня По периоду – уменьшается, по группе - возрастает По периоду – возрастает, по группе - уменьшается Способны только отдавать электроны Более склонны принимать электроны, чем отдавать их " width="640"
Атомы неметаллов
Задание :
Сравните строение электронных оболочек и атомные характеристики (радиус, электроотрицательность, способность отдавать и принимать электроны) металлов и неметаллов.
1 – 3 4 и более
Характеристики сравнения
Атомы металлов
Количество электронов на внешнем уровне
Атомы неметаллов
Радиус атома
Электроотрицательность
Способность отдавать и принимать электроны с целью завершения внешнего энергетического уровня
По периоду – уменьшается, по группе - возрастает
По периоду – возрастает, по группе - уменьшается
Способны только отдавать электроны
Более склонны принимать электроны, чем отдавать их

Простые вещества - неметаллы строение
Задание :
Определите вид химической связи в молекулах N 2 , O 2 , Cl 2 , составьте схемы её образования, укажите её особенности
Химическая связь – ковалентная неполярная:
- Образуется при помощи общих электронных пар;
- Обобществлённые электроны в равной степени принадлежат связываемым атомам.

Типы кристаллических решеток

Химические свойства неметаллов
- Преобладают окислительные свойства:
В соответствии с численными значениями относительной ЭО окислительные способности неметаллов увеличиваются в следующем порядке: Si B H 2 P C S I 2 N 2 Cl 2 O 2 F 2

Аллотропия
- Аллотропия – это способность атомов одного химического элемента образовывать несколько простых веществ

Причины аллотропии
- Различный состав молекул простого вещества ( аллотропия состава )
- Способ размещения атомов или молекул в кристаллической решётке ( аллотропия формы )

Аллотропия состава

Аллотропия формы

ЭЛЕМЕНТЫ - IA,IIIA,IVA
Н

ПНИКТОГЕНЫ -VA
Р

ХАЛЬКОГЕНЫ - VIA

ГАЛОГЕНЫ - VIIA

ИНЕРТНЫЕ ГАЗЫ- VIIIA

Строение атомов НеМ
1. Элементы расположены в главных подгруппах III –VIII групп (А).
2. На последнем уровне 3 – 7(8) электронов.
3. Радиус атома уменьшается
растёт
4. Неметаллические свойства
В периоде – увеличиваются
В группе - уменьшаются

Строение атомов НеМ
- 5. Высокая электроотрицательность.
- 6. Принимают электроны и отдают.
- 7. НеМ → кислотный оксид→кислота
- 8. Летучие водородные соединения
(кислоты, основания и безразличные)

Физические свойства
- Газообразные – азот, кислород, хлор, инертные газы, водород.
- Жидкий – бром,
- Твёрдые – сера, фосфор, углерод…
- Отношение к электрическому току.
- Неэлектропроводные: сера, кислород…
- Проводники: графит
- Полупроводники: кремний

Строение неметаллов .
- Х = 1 Инертные газы He, Ar, Ne…
- X=2 H 2 , Cl 2 , N 2 …
- X=4 P 4 белый
- Х= n P n красный
- (С) n -алмаз, графит;
- (Si) n кремний;
- (B) n бор

Простые вещества - неметаллы строение и физические свойства
Задание :
Распределите вещества C, N 2 ,O 2 , Si, Br 2 ,I 2 на две группы на основании данных об агрегатных состояниях и температурах кипения, определите причину различия в свойствах:
O 2 , N 2 , Br 2 , I 2 C, Si
молекулярная крист. решётка атомная крист. решётка
Газообразные или легколетучие вещества с низкими температурами плавления
Твердые нелетучие вещества с высокими температурами плавления
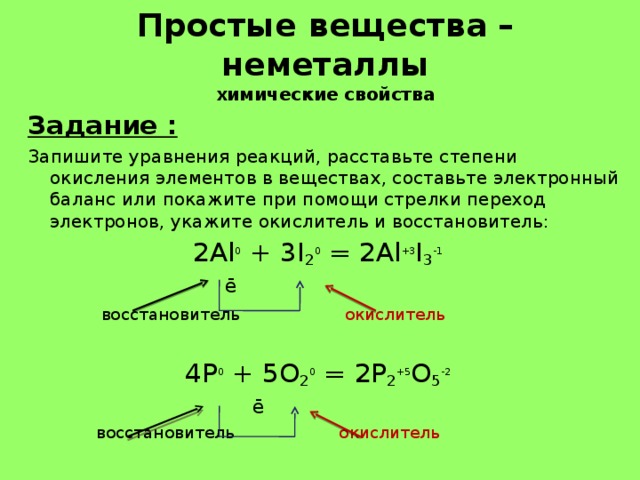
Простые вещества – неметаллы химические свойства
Задание :
Запишите уравнения реакций, расставьте степени окисления элементов в веществах, составьте электронный баланс или покажите при помощи стрелки переход электронов, укажите окислитель и восстановитель:
2Al 0 + 3I 2 0 = 2Al +3 I 3 -1
ē
восстановитель окислитель
4P 0 + 5O 2 0 = 2P 2 +5 O 5 -2
ē
восстановитель окислитель

Подведём итоги
- Символы неМе расположены в периодической системе в главных подгруппах над диагональю B-At .
- На внешнем энергетическом уровне содержат от 4 до 8 электронов; имеют меньший радиус и более высокую электроотрицательность, чем атомы металлов.
- Простые вещества-неметаллы образованы при помощи ковалентной неполярной химической связи, могут иметь атомную или молекулярную кристаллическую решётку.
- В химических реакциях способны выступать как окислителями, так и восстановителями.

Кислород, водород – пример газообразных бесцветных неметаллов

Хлор (как и фтор) – окрашенные газообразные неметаллы.
При растворении хлора в воде получается хлорная вода

Бром – жидкость красно-бурого цвета
При растворении брома в воде получается бромная вода

При растворении брома в воде получается бромная вода

Большинство неметаллов имеют твёрдое агрегатное состояние
Сера – кристаллическое вещество жёлтого цвета
Красный фосфор
Углерод (уголь)

Неметаллы малорастворимы в воде
Уголь
Фосфор
Сера не смачивается водой

Химические свойства.
- 1. Реагируют с металлами .
- 2. С кислородом.
- 3. С водородом .
- 4. С кислотами.
- 5. Со щелочами.
- 6. С солями.

Домашнее задание.
авторы Н.Е.Кузнецова и др.
§ 20,21,22 стр.58 № 1, 2, 3,4. Стр. 65 № 1
Написать уравнения реакций:
- Кислород + сера, кремний, фосфор, медь, алюминий,
- Водород + сера, кислород, хлор, калий
- Сера + фосфор, натрий, алюминий.
- Углерод + кремний, алюминий.
- Указать окислитель и восстановитель.

















 Характеристики сравнения Атомы металлов Количество электронов на внешнем уровне Атомы неметаллов Радиус атома Электроотрицательность Способность отдавать и принимать электроны с целью завершения внешнего энергетического уровня По периоду – уменьшается, по группе - возрастает По периоду – возрастает, по группе - уменьшается Способны только отдавать электроны Более склонны принимать электроны, чем отдавать их " width="640"
Характеристики сравнения Атомы металлов Количество электронов на внешнем уровне Атомы неметаллов Радиус атома Электроотрицательность Способность отдавать и принимать электроны с целью завершения внешнего энергетического уровня По периоду – уменьшается, по группе - возрастает По периоду – возрастает, по группе - уменьшается Способны только отдавать электроны Более склонны принимать электроны, чем отдавать их " width="640"





































