Просмотр содержимого документа
«Презентация по химии "Гидролиз солей"»

Гидролиз солей
Краснянская И.А.,
учитель химии,
ГОУ «Свердловская СШ № 11»
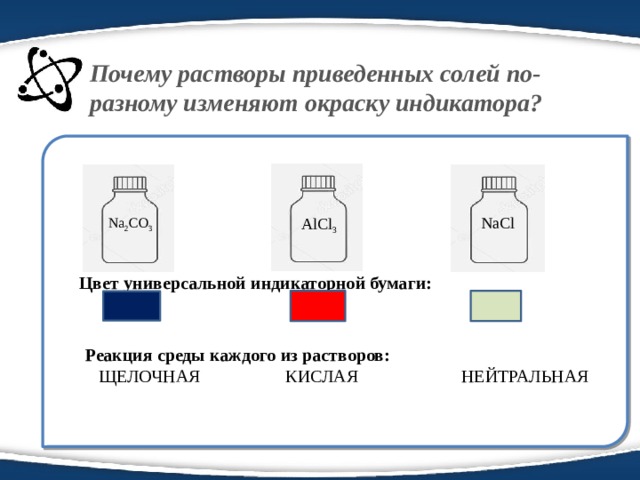
Почему растворы приведенных солей по-разному изменяют окраску индикатора?
Цвет универсальной индикаторной бумаги:
NaCl
AlCl 3
Na 2 CO 3
Реакция среды каждого из растворов:
ЩЕЛОЧНАЯ КИСЛАЯ НЕЙТРАЛЬНАЯ
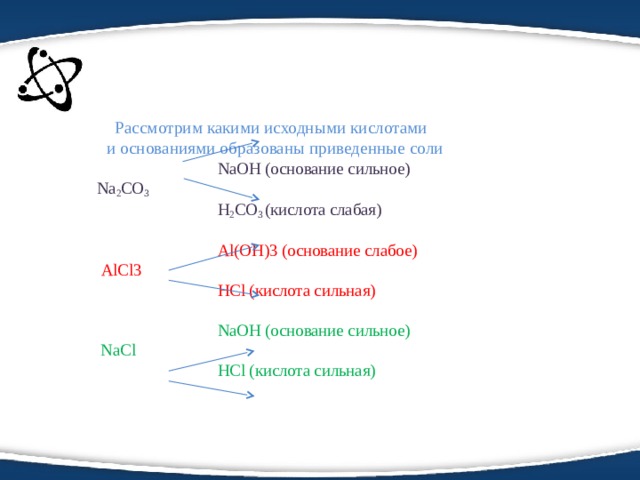
Рассмотрим какими исходными кислотами и основаниями образованы приведенные соли NaOH (основание сильное) Na 2 CO 3 H 2 CO 3 (кислота слабая) Al(OH)3 (основание слабое) AlCl3 HCl (кислота сильная) NaOH (основание сильное) NaCl HCl (кислота сильная)

Первый вывод: гидролизу не подвергаются соли, образованные сильным основанием и сильной кислотой

 7 " width="640"
7 " width="640"
Рассмотрим механизм гидролиза солей, образованных сильным основанием и слабой кислотой
Na 2 CO 3 ↔ 2Na + + CO 3 2- кроме того в растворе находятся
молекулы воды, с которыми взаимодействуют
ионы соли.
Как и любая реакция ионного обмена, гидролиз протекает при условии
образования слабого соединения (в этом случае кислоты)
СО 3 2- + Н 2 О ↔ НСО 3 - + ОН - (первая ступень)
НСО 3 - + Н 2 О↔ Н 2 СО 3 + ОН - (вторая ступень)
--------------------------------------------------------------
СО 3 2- + 2Н 2 О↔ Н 2 СО 3 + 2ОН - (суммарное уравнение) рН 7


Второй вывод: соли, образованные сильным основанием и слабой кислотой, гидролизуются по аниону и имеют щелочную реакцию среды

Рассмотрим механизм гидролиза солей, образованных слабым основанием
и сильной кислотой
AlCl 3 ↔ Al 3+ + 3Cl -
Al 3+ + H 2 O ↔ AlOH 2+ + H + (первая ступень)
AlOH 2+ + H 2 O ↔ Al(OH) 2 + + H + (вторая ступень)
Al(OH) 2 + + H 2 O ↔ Al(OH) 3 + H + (третья ступень)
---------------------------------------------------------------
Al 3+ + 3H 2 O ↔ Al(OH) 3 + 3H + (суммарное уравнение) pH
В силу обратимости процесса с наибольшей вероятностью гидролиз протекает по первой ступени, и только при создании соответствующих условий – до конца.
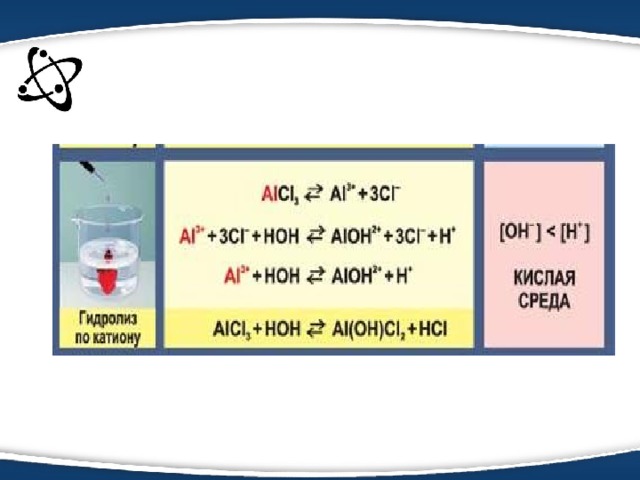

Третий вывод: соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону и имеют кислую реакцию среды

Четвертый вывод: соли, образованные слабым основанием и слабой кислотой гидролизуются и по катиону, и по аниону. В результате образуются малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания.

ГИДРОЛИЗ – это реакция ионного
обмена, протекающая между
молекулами соли и воды
и сопровождающаяся
образованием слабого электролита













 7 " width="640"
7 " width="640"


















