
Карбоновые кислоты
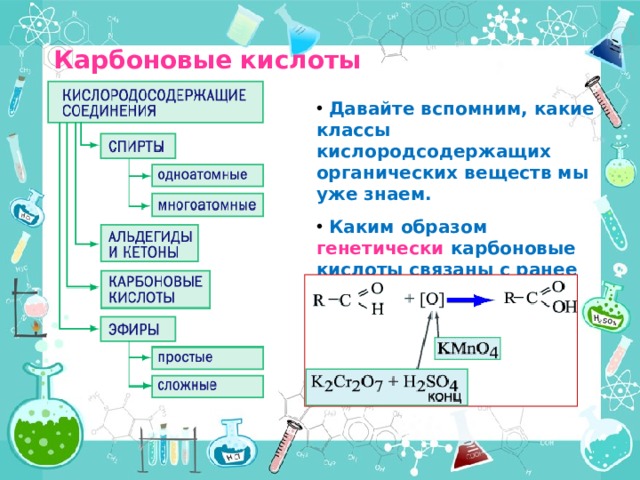
Карбоновые кислоты
- Давайте вспомним, какие классы кислородсодержащих органических веществ мы уже знаем.
- Каким образом генетически карбоновые кислоты связаны с ранее изученным классом альдегидов?

Что мы узнаем на этом уроке
1.Определение карбоновых кислот
2. Классификация
3.Электронное строение
4. Изомерия и номенклатура
5.Нахождение в природе
6. Получение
7.Физичесике свойства
8. Химические свойства
9.Применение

Историческая справка
- С древнейших времен использовали уксус, образующийся при скисании вина, листья щавеля, стебли ревеня, сок лимона, листья кислицы в качестве кислой приправы
фермент
СН 3 – СН 2 – ОН + О 2 → СН 3 – СООН + Н 2 О
Что вызывало кислый вкус?
Никто об этом не задумывался

Кто получил кислоты?
- Уксусная кислота СН 3 СООН –
известна с 8 века
- Безводная уксусная кислота – 1789г., Товий Егорович Ловиц, обезвоживал активированным углем
- При t= 16,5 0 С кристаллизуется, напоминает лед → «ледяная кислота»

Муравьиная кислота
- 16 век – обнаружено, что «кислый пар» из муравейников изменяет цвет растительных красителей на красный
- Дж. Рей – получил муравьиную кислоту перегонкой муравьев и дал ей название

Карл Вильгельм Шееле
- Конец 18 века – выделил и описал лимонную, молочную, бензойную, щавелевую и другие кислоты
- Но до 60-х годов 19 века химическое строение карбоновых кислот оставалось невыясненным

Карбоновые кислоты — класс органических соединений, молекулы которого содержат карбоксильную группу - COOH. Состав предельных одноосновных карбоновых кислот соответствует общей формуле

Номенклатура IUPAC для карбоновых кислот
- Главную цепь выбирают таким образом, чтобы атом углерода карбоксильной группы оказался в ней.
- Нумерация атомов углерода главной цепи начинается с атома углерода карбоксильной группы.
- Полное название данной кислоты образуется от названия алкана с тем же числом атомов углерода в молекуле с добавлением «-овая кислота».
- Если углеводородный радикал разветвлен, то сначала называют номер атома углерода, при котором находится радикал, затем через дефис называют сам радикал.
- Отсутствие дефиса считается за ошибку. Если с основной цепью соединены два различных радикала, то первым из них указывается наиболее простой.
- Если с основной цепью соединены два или более одинаковых радикалов, то их количество указывается с использованием соответствующих префиксов: -ди, -три, -тетра и т. д.
Выведите общую формулу предельных одноосновных карбоновых кислот
Общая формула предельных одноосновных карбоновых кислот – С n H 2n O 2
Уксусная
Щавелевая
Назовите вещество
Лимонная
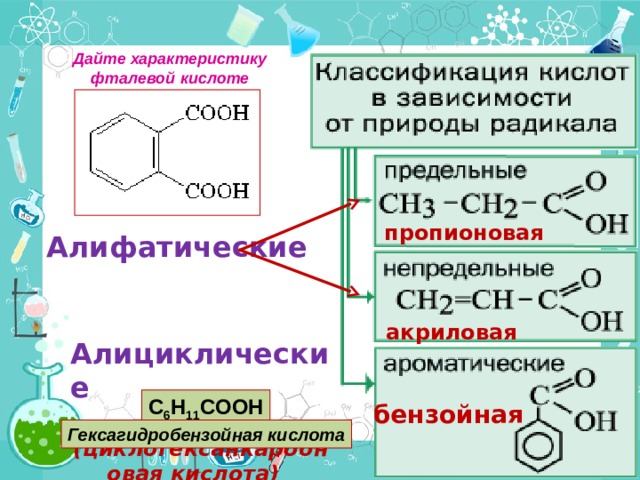
Дайте характеристику фталевой кислоте
Алифатические
Алициклические
(циклогексанкарбоновая кислота)
пропионовая
акриловая
C 6 H 11 COOH
бензойная
Гексагидробензойная кислота
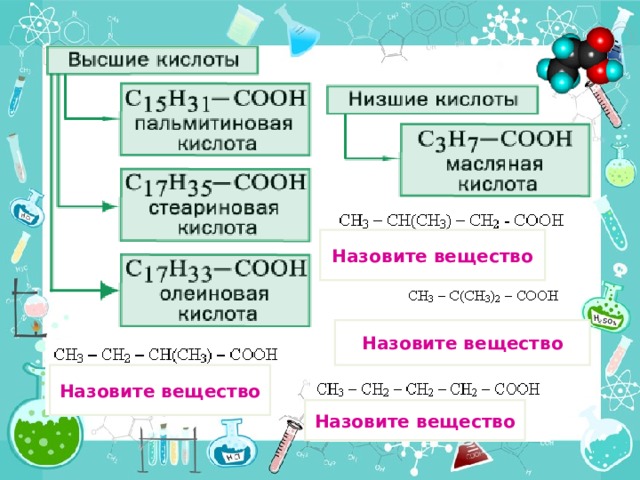
Назовите вещество
Назовите вещество
Назовите вещество
Назовите вещество

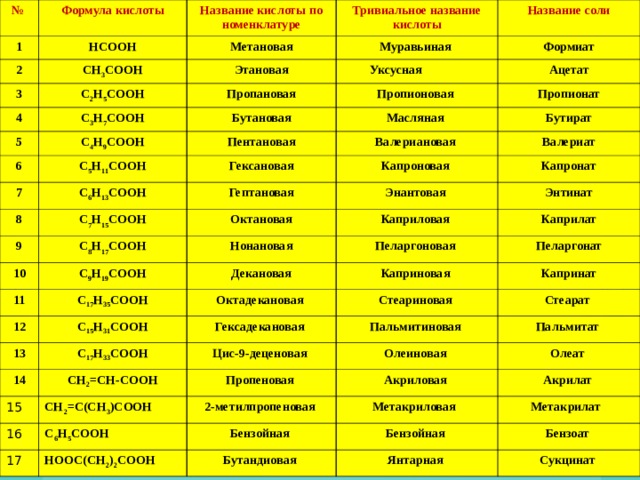
№
Формула кислоты
1
HCOOH
2
Название кислоты по номенклатуре
Тривиальное название
кислоты
3
Метановая
CH 3 COOH
Этановая
4
Название соли
Муравьиная
C 2 H 5 COOH
5
Пропановая
Формиат
C 3 H 7 COOH
Уксусная
6
C 4 H 9 COOH
Бутановая
Пропионовая
Ацетат
7
C 5 H 11 COOH
Пентановая
Пропионат
Масляная
8
C 6 H 13 COOH
Гексановая
Бутират
Валериановая
9
C 7 H 15 COOH
Гептановая
Валериат
Капроновая
10
C 8 H 17 COOH
Октановая
Энантовая
Капронат
C 9 H 19 COOH
Нонановая
11
Энтинат
Каприловая
12
C 17 Н 35 СООН
Декановая
Каприлат
Пеларгоновая
13
Октадекановая
С 15 Н 31 СООН
Пеларгонат
Каприновая
14
С 17 Н 33 СООН
Гексадекановая
Капринат
Стеариновая
СН 2 =СН-СООН
15
Цис-9-деценовая
Пальмитиновая
Стеарат
Пропеновая
Пальмитат
Олеиновая
16
СН 2 =С(СН 3 )СООН
2-метилпропеновая
Олеат
Акриловая
С 6 Н 5 СООН
17
Акрилат
Метакриловая
Бензойная
НООС(СН 2 ) 2 СООН
Метакрилат
Бутандиовая
Бензойная
Бензоат
Янтарная
Сукцинат

соли - лактаты
Оксифенилуксусная, фенилгликолевая,
фенилэтиловая
бутанолдикислотасоли - малаты
Метан диовая кислота
(дикарбоновая кислота)
2- гидрокси пропан триовая кислота
(2- гидрокси – 1,2,3 -пропан трикарбоновая кислота)
Изомерия
1.Изомерия углеродной цепи
Составьте изомеры по углеродному скелету для валериановой кислоты и назовите вещества
2. Изомерия положения кратной связи :
СН 2 =СН—СН 2 —СООН Бутен-3-овая кислота (винилуксусная
кислота)
СН 3 —СН=СН—СООН Бутен-2-овая кислота (кротоновая кислота)
3. Геометрическая (цис-, транс-) изомерия :
4. Межклассовая изомерия : например: С 4 Н 8 О 2
СН 3 — СН 2 — СО — О — СНз метиловый эфир пропановой кислоты
СН 3 — СО — О — CH 2 — СН 3 этиловый эфир этановой кислоты
С 3 Н 7 – СООН бутановая кислота

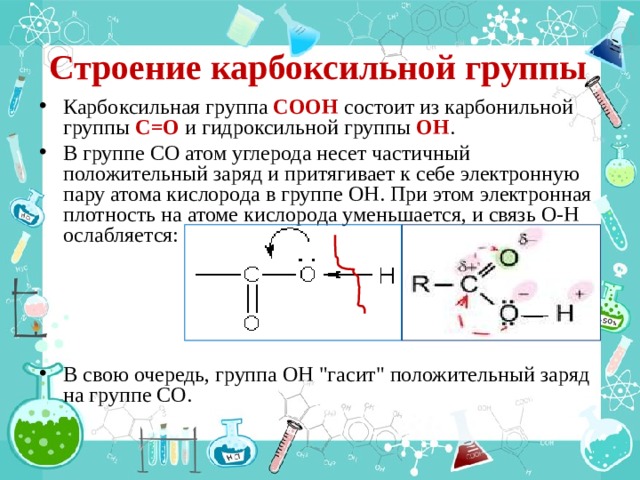
Строение карбоксильной группы
- Карбоксильная группа СООН состоит из карбонильной группы С=О и гидроксильной группы ОН .
- В группе СО атом углерода несет частичный положительный заряд и притягивает к себе электронную пару атома кислорода в группе ОН . При этом электронная плотность на атоме кислорода уменьшается, и связь О-Н ослабляется:
- В свою очередь, группа ОН "гасит" положительный заряд на группе СО.

● Влияние атома С на ОН-группу .
Электронная плотность в карбонильной группе (особенно σ -связи) смещена в сторону О, как более электроотрицательного элемента. Карбонильный атом С приобретает частичный положительный заряд. Чтобы его компенсировать, он притягивает к себе электроны атома О ОН- группы. Электронная плотность на атоме О понижается и он смещает в свою сторону электронную плотность связи О – Н. Полярность связи в ОН-группе возрастает, Н становится подвижнее и легче отщепляется в виде протона , что обуславливает общие свойства карбоновых кислот.
● Влияние радикала на карбоксильную группу объясняется сдвигом электронной плотности к центральному атому С. В результате его частичный положительный заряд уменьшается и его действие на электронную плотность атома кислорода –ОН- группы ослабляется, а, значит, отщепление ионов Н затрудняется. Как следствие – самая сильная органическая кислота -муравьиная кислота.
● Карбоксильная группа влияет на радикал таким образом, что наиболее легко замещаемым становится водород при α -углеродном атоме .

Физические свойства
- Низшие карбоновые кислоты — жидкости с острым запахом, хорошо растворимые в воде.
- С повышением относительной молекулярной массы растворимость кислот в воде уменьшается, а температура кипения повышается.
- Высшие кислоты, начиная с пеларгоновой
С 8 Н 17 СООН — твердые
вещества, без запаха,
нерастворимые в воде.

Возгонка – переход вещества из твердого состояния в газообразное, минуя жидкое
Бензойная кислота и некоторые другие сублимируют

Межмолекулярная водородная связь
Почему среди карбоновых кислот нет газообразных веществ?

Карбоновые кислоты являются более сильными кислотами, чем спирты и фенолы из-за делокализации заряда в карбоксилат-ионе
Вспомните свойства неорганических кислот:
- Диссоциация HCl = H + + Cl -
- Взаимодействие с металлами
Mg + 2 HCl = MgCl 2 + H 2 ↑
- Взаимодействие с основными оксидами
MgO + 2 HCl = MgCl 2 + H 2 O
4. Взаимодействие с основаниями
Mg(OH) 2 + 2 HCl = MgCl 2 + 2 H 2 O
5. Взаимодействие с солями более слабых кислот
MgCO 3 + 2 HCl = MgCl 2 + H 2 O + CO 2 ↑
RCOOH + M е RCOOM е + H 2
СH 3 COOH + M е CH 3 COOM е + H 2
СH 3 COOH + Ме O CH 3 COO Ме + H 2 O
HCOOH + Ме OH HCOO Ме + H 2 O
Формиаты – соли муравьиной кислоты
Ацетаты – соли уксусной кислоты
HCOOH + соль слабой кислоты HCOO Ме +
H 2 O

С увеличением углеводородного радикала сила кислот уменьшается

Химические свойства карбоновых кислот
Общие свойства карбоновых кислот аналогичны соответствующим свойствам неорганических кислот:
1. Диссоциация в водных растворах (среда кислая, индикаторы меняют окраску).
2. Карбоновые кислоты вступают в реакцию замещения с металлами, стоящими в ряду напряжений до водорода.

Химические свойства карбоновых кислот
3. Карбоновые кислоты реагируют с основными оксидами с образованием соли и воды.
4. Вступают в реакцию нейтрализации с основаниями (щелочами и нерастворимыми) и амфотерными гидроксидами.
Задание: Напишите уравнение реакции взаимодействия уксусной кислоты с гидроксидом меди, назовите получившуюся соль.

2СН 3 -СООН +С u(OH) 2 → (СН 3 -СОО) 2 С u + 2H 2 O
Ацетат меди (II)
Составьте уравнение реакции гидроксида натрия с муравьиной кислотой, разберите его как ионное уравнение (составьте полное ионное и сокращенное ионное уравнение). Назовите получившееся вещество.
НСООН + NaOH → НСОО Na + H 2 O
Молекулярное уравнение
НСООН + Na + + OH - → НСОО - + Na + + H 2 O
Полное ионное уравнение
НСООН + OH - → НСОО - + H 2 O
Сокращенное ионное уравнение

Химические свойства карбоновых кислот
5. Взаимодействуют с солями более слабых и летучих кислот, вытесняя их из солей.
6. Реакция этерификации – образование сложных эфиров при взаимодействии карбоновых кислот со спиртами.
Карбоновая кислота
Задание: Напишите уравнение реакции взаимодействия уксусной кислоты с пропанолом-1, назовите получившийся эфир.

Химические свойства карбоновых кислот
7. Кислоты могут образовывать кислотные оксиды
(или ангидриды кислот).
Особые свойства кислот, обусловленных наличием в их молекулах радикалов. Реакция с галогенами.
Какая из этих кислот сильнее? Почему?

Хлоруксусная кислота сильнее уксусной, так как за счет атома хлора происходит перераспределение электронной плотности в молекуле и водород в виде протона отщепляется легче, а, значит, кислота будет более активной.
Галогензамещённые кислоты – более сильные кислоты, чем карбоновые, за счёт -I эффекта атома галогена
Галогензамещенные кислоты
CH 3 –CH 2 –COOH
+ Br 2
CH 3 –
CH – COOH + HBr I Br
Образуются при замещении водорода на галоген в углеводородном радикале
( в α -положении )
Назовите полученное вещество и напишите с ним реакцию дальнейшего бромирования

Примеры химических реакций для уксусной кислоты
Изменяет окраску индикатора
- CH 3 COOH
- Zn + 2CH 3 COOH =
- ZnO + 2CH 3 COOH =
4) Zn(OH) 2 +2CH 3 COOH =
5)ZnCO 3 +2CH 3 COOH =
CH 3 COO - + H +
Уксусная кислота
Ацетат- ион
Ацетат цинка
Zn(CH 3 COO) 2 + H 2
Zn(CH 3 COO) 2 + H 2 O
Zn(CH 3 COO) 2 +2H 2 O
Zn(CH 3 COO) 2 +CO 2 +
H 2 O
![Получение карбоновых кислот 1. Окислением спиртов [O] – оксид хрома ( VI ) в H 2 SO 4 2. Окислением альдегидов Существуют и другие способы получения карбоновых кислот](https://fsd.multiurok.ru/html/2020/03/24/s_5e79ff19e8354/img30.jpg)
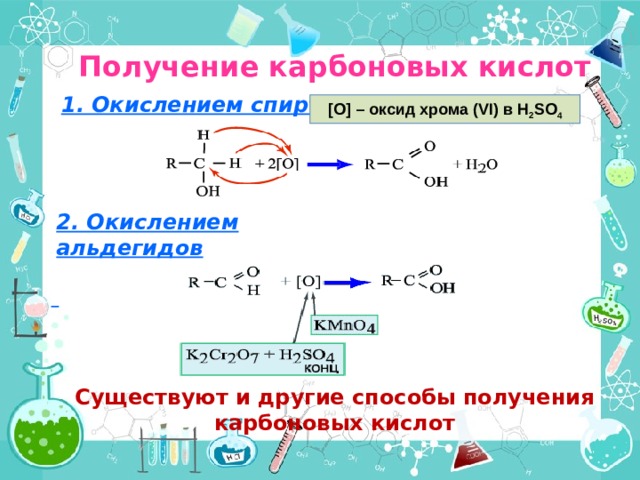
Получение карбоновых кислот
1. Окислением спиртов
[O] – оксид хрома ( VI ) в H 2 SO 4
2. Окислением альдегидов
Существуют и другие способы получения карбоновых кислот
 C 25 ) под действием О 2 воздуха в (ж) фазе в присутствии солей тяжелых Ме превращаются в смесь к/кислот с С 12 -С 18 → МЫЛО и ПАВ kat. С 36 Н 74 + 2,5О 2 → 2 С 17 Н 35 СООН + Н 2 О +2,5 + Н 2 О Николай Маркович Эмануэль – получил уксусную кислоту окислением бутана " width="640"
C 25 ) под действием О 2 воздуха в (ж) фазе в присутствии солей тяжелых Ме превращаются в смесь к/кислот с С 12 -С 18 → МЫЛО и ПАВ kat. С 36 Н 74 + 2,5О 2 → 2 С 17 Н 35 СООН + Н 2 О +2,5 + Н 2 О Николай Маркович Эмануэль – получил уксусную кислоту окислением бутана " width="640"
Получение карбоновых кислот
3. Окислением углеводородов
- Практическое значение имеет каталитическое окисление метана до муравьиной кислоты. Другие алканы при окислении претерпевают разрыв С-С цепи примерно посередине.
- УВ с длинной цепью ( C 25 ) под действием О 2 воздуха в (ж) фазе в присутствии солей тяжелых Ме превращаются в смесь к/кислот с С 12 -С 18 → МЫЛО и ПАВ
kat.
С 36 Н 74 + 2,5О 2 → 2 С 17 Н 35 СООН + Н 2 О
+2,5
+ Н 2 О
Николай Маркович Эмануэль – получил уксусную кислоту окислением бутана
![Получение карбоновых кислот 4. Окислением алкенов [O] – KMnO 4 (кипящий р-р), О 2 (кат., t ) СН 3 – СН = СН – СН 3 + 4 [O] → 2 СН 3 - СООН 5 . Реакции гидролиза производных кислот R -СН 2 - Cl + NaCN →R-CH 2 -C ≡ N + NaCl H + + HCl R-CH 2 -C ≡ N + 2 H 2 O→R–CH 2 –COONH 4 → R–CH 2 –COOH + NH 4 Cl Существуют и другие специфические способы получения карбоновых кислот](https://fsd.multiurok.ru/html/2020/03/24/s_5e79ff19e8354/img32.jpg)
Получение карбоновых кислот
4. Окислением алкенов
[O] – KMnO 4 (кипящий р-р), О 2 (кат., t )
СН 3 – СН = СН – СН 3 + 4 [O] → 2 СН 3 - СООН
5 . Реакции гидролиза производных кислот
R -СН 2 - Cl + NaCN →R-CH 2 -C ≡ N + NaCl
H + + HCl
R-CH 2 -C ≡ N + 2 H 2 O→R–CH 2 –COONH 4 → R–CH 2 –COOH + NH 4 Cl
Существуют и другие специфические способы получения карбоновых кислот

Специфические способы получения отдельных кислот
Для получения
Уксусную кислоту
Муравьиную кислоту
бензойной кислоты
получают в промышленных масштабах каталитическим окислением бутана кислородом воздуха
получают нагреванием оксида углерода (II) с порошкообразным гидроксидом натрия под давлением и обработкой полученного формиата натрия сильной кислотой
можно использовать
окисление
монозамещенных
гомологов бензола кислым
раствором
перманганата калия

Получение карбоновых кислот
Молочную кислоту получают молочнокислым брожением глюкозы (ферментативная реакция):
C 6 H 12 O 6 → 2CH 3 CH(OH)COOH +
21,8·10 4 Дж
![Особенности муравьиной кислоты H 2 SO 4 ( конц. ) HCOOH → CO + H 2 O ( получение СО в лаборатории ) Двойственность свойств - альдегидокислота Альдегидная группа Карбоксильная группа О О || || Н – С – ОН + [ О ] → НО – С – ОН → СО 2 + Н 2 О О О СО 2 || || Н – О – С – Н + Ag 2 O → 2 Ag + Н – О – С – О – Н Н 2 О Реакция серебряного зеркала угольная кислота Сильный восстановитель аммиачный р-р](https://fsd.multiurok.ru/html/2020/03/24/s_5e79ff19e8354/img35.jpg)
Особенности муравьиной кислоты
H 2 SO 4 ( конц. )
HCOOH → CO + H 2 O ( получение СО в лаборатории )
Двойственность свойств - альдегидокислота
Альдегидная группа
Карбоксильная группа
О О
|| ||
Н – С – ОН + [ О ] → НО – С – ОН → СО 2 + Н 2 О
О О СО 2
|| ||
Н – О – С – Н + Ag 2 O → 2 Ag + Н – О – С – О – Н
Н 2 О
Реакция серебряного зеркала
угольная кислота
Сильный восстановитель
аммиачный р-р

Генетическая связь карбоновых кислот с другими классами органических соединений
Составьте уравнения реакций по данной цепочке превращений, взяв за основу этан
Найдите информацию о наиболее распространенных и используемых карбоновых кислотах

СН 3 – CH 2 –Cl
![Акриловая и метакриловая кислоты являются непредельными карбоновыми кислотами и проявляют свойства алкенов СН 2 =СН-СООН и СН 2 =С(СН 3 )-СООН MoO 3 , t СН 2 =СН-СН 3 + 3 [O] → СН 2 =СН-СООН + H 2 O пропен t СН 2 =СН-С N + 2 H 2 O → СН 2 =СН-СООН + NH 3 нитрил акриловой кислоты](https://fsd.multiurok.ru/html/2020/03/24/s_5e79ff19e8354/img38.jpg)
Акриловая и метакриловая кислоты
- являются непредельными карбоновыми кислотами и проявляют свойства алкенов
- СН 2 =СН-СООН и СН 2 =С(СН 3 )-СООН
MoO 3 , t
СН 2 =СН-СН 3 + 3 [O] → СН 2 =СН-СООН + H 2 O
пропен
t
СН 2 =СН-С N + 2 H 2 O → СН 2 =СН-СООН + NH 3
нитрил акриловой кислоты

Высшие карбоновые кислоты
- Число атомов С – больше 10
- Обычно имеют четное число атомов С
- Встречаются обычно в виде сложных эфиров с низшими спиртами – в эфирных маслах , с высшими спиртами – в воске , с глицерином – в жирах
- Важнейшие: стеариновая, пальмитиновая с неразветвленной цепью, нерастворимые в воде
- Получают каталитическим окислением парафина или гидролизом жиров
- Используются: изготовление мыла, ПАВ, стеариновых свечей
- Кислотные свойства можно обнаружить, если капнуть расплавленную свечу на индикаторную бумагу → покраснеет
- Получение стеариновой кислоты из мыла :
р-р мыла + HCl = белые хлопья на поверхности жидкости

Высшие карбоновые кислоты
- Высшие непредельные карбоновые кислоты:
- С 17 Н 33 СООН – олеиновая (1 двойная связь)
- С 17 Н 31 СООН – линолевая (2 двойные связи)
- С 17 Н 29 СООН – линоленовая (3 двойные связи)
- Имеют цис-расположение заместителей при двойных связях
- Проявляют свойства карбоновых кислот и алкенов :
- Реагируют по карбоксильной группе (св-ва кислот)
- Реагируют по двойной связи (св-ва алкенов)
- Линоленовая и линолевая кислоты не синтезируются в организме, поступают с растительными маслами, способствуют снижению уровня холестерина
- Способность окисляться используется при изготовлении олифы из льняного и конопляного масла (в составе сложных эфиров олеиновая и линолевая кислоты)

Стеариновая кислота и ее соли стеараты
- С 17 Н 35 СООН относится к высшим карбоновым кислотам
- Стеараты кальция, магния и железа, как и кислота, в воде нерастворимы.
- Стеараты щелочных металлов, например, стеарат натрия С 17 Н 35 СОО Na , хорошо растворимы в воде. Они являются основой мыл: хозяйственного,
банного, туалетного, детского.

Бензойная кислота
- С 6 Н 5 -СООН , в составе природных смол, в плодах, ягодах, сильнее алифатических кислот
- Применяется в оргсинтезе для получения лекарств, душистых в-в, красителей, в качестве консерванта (пищевая промышленность)
- В промышленности получают каталитическим окислением толуола:
t , Р, ка t . (соли Со)
2 С 6 Н 5 -СН 3 + 3 О 2 → 2 С 6 Н 5 -СООН + 2 Н 2 О
- Склонность к декарбоксилированию ( t ):
С 6 Н 5 -СООН → С 6 Н 6 + СО 2

Щавелевая кислота
- НООС-СООН – двухосновная кислота, содержится в листьях щавеля, ревеня, кислицы
- Соли – оксалаты
- Оксалат Са – образуется в виде камней в почках при нарушении обмена в-в
- Сильнее, чем монокарбоновые кислоты
- Окисляется р-ром перманганата калия в кислой среде:
5 Н 2 С 2 О 4 + 2 KMnO 4 + 3 H 2 SO 4 → 10 CO 2 + 2 MnSO 4 + K 2 SO 4
+ 8 H 2 O
- При нагревании с H 2 SO 4 (к) разлагается:
Н 2 С 2 О 4 → CO 2 + СО + H 2 O
- Применяется в текстильной, кожевенной, пищевой промышленности

Применение карбоновых кислот
Гербициды
Консервант,
приправа
Парфюмерия, косметика

Муравьиная кислота - в качестве восстановителя, в медицине -муравьиный спирт ( 1,25% спиртовой раствор муравьиной кислоты ) – дезинфицирующее ср-во, протрава при крашении шерсти, консервант фруктовых соков, отбеливатель, пропитка тканей ( формиат алюминия ), сложные эфиры – растворители, душистые в-ва.

синтез красителей
(индиго)
Синтез
медицинских препаратов
ацетатное волокно
Синтез
сложных эфиров
Негорючая кинопленка
СН 3 - СООН
ядохимикаты
Консервант, вкусовое ср-во
2,4 - Д
оргстекло

Выводы:
- Карбоновыми кислотами называются органические вещества, молекулы которых содержат одну или несколько карбоксильных групп, соединенных с углеводородным радикалом.
- Для карбоновых кислот, как и для альдегидов, характерна изомерия углеродного скелета.
- Молекулы карбоновых кислот образуют димеры.
- Общие свойства, характерные для класса карбоновых кислот, обусловлены наличием в молекулах гидроксильной группы, которая содержит резко полярную связь между атомами водорода и кислорода. Для карбоновых кислот характерны свойства как общие с неорганическими кислотами, так и специфические, присущие только для органических кислот.

Решите задачи
Задача 1.
Одноосновная карбоновая кислота имеет следующий состав: углерод – 40%, водород – 6,67%, кислород – 53,33%. Плотность паров этой кислоты по аргону равна 1,5. Исходя из этих данных, найдите молекулярную формулу этой кислоты.
Задача 2.
Одноосновная карбоновая кислота имеет следующий состав: углерод – 48,65%, водород – 8,11%, кислород – 43,24%. Плотность паров этой кислоты по водороду равна 37. Найдите формулу этой карбоновой кислоты .
Ответьте на вопросы:
- Как происходит перераспределение электронной плотности в карбоксильной группе?
- В чем заключается взаимное влияние атомов в молекулах карбоновых кислот?
- Как это отражается на химических свойствах карбоновых кислот?

Решите задачи
Задача 3.
Одноосновная карбоновая кислота имеет следующий состав: углерод – 62%, кислород – 27,6%. Составьте структурные формулы всех возможных изомеров и назовите их по международной номенклатуре.
Задание 4.
Расположите в порядке усиления кислотных свойств перечисленные соединения:
1уровень: а) фенол, б) муравьиная кислота, в) соляная кислота, г) пропанол-1, д) вода .
2 уровень: а) этанол, б) п-крезол, в) бромоводородная кислота, г) вода, д) уксусная кислота, е) угольная кислота
С какими из ниже перечисленных веществ будет реагировать уксусная кислота? Напишите уравнения возможных реакций и назовите вещества.
Al(OH) 3 , Cu, NaCl, Mg, BaCO 3 , FeO, CO 2 , KOH , СН 3 ОН, НСОН, Na 2 SO 4 , О 2
Допишите
реакции

Задания
- Расположите в ряд по усилению кислотных свойств перечисленные кислоты и их производные: а) уксусная, б) пропионовая, в) хлоруксусная, г) дихлоруксусная, д) стеариновая.
- Какая из кислот будет реагировать с металлическим магнием с максимальной скоростью, а какая – с минимальной: а) пропановая, б) 2-хлорпропановая, в) 3-хлорпропановая? Напишите уравнения соответствующих реакций.

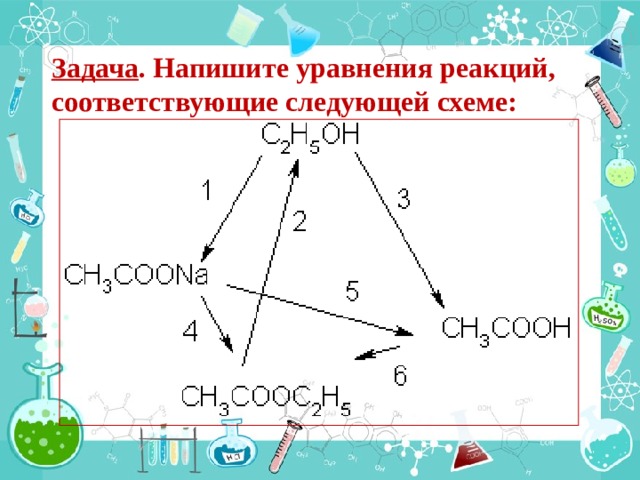
Задача . Напишите уравнения реакций, соответствующие следующей схеме:
![Решение. 1) Этанол окисляется до ацетата натрия хроматом натрия в щелочном растворе: ЗС 3 Н 5 ОН + 4Na 2 CrO 4 + 7NaOH + 4H 2 O 3CH 3 COONa + 4Na 3 [Cr(OH) 6 ]. 2) Этилацетат гидролизуется под действием щелочей: СН 3 СООС 2 Н 5 + NaOH CH 3 COONa + С 2 Н 5 ОН. 3) Этанол окисляется до уксусной кислоты дихроматом калия в кислом растворе: 5С 2 Н 5 ОН + 4KMnO 4 + 6H 2 SO 4 5СН 3 СООН + 2K 2 SO 4 +4MnSO 4 + + 11H 2 O. 4) Этилацетат можно получить из ацетата натрия действием этилиодида: CH 3 COONa + C 2 H 5 I СН 3 СООС 2 Н 5 + Nal. 5) Уксусная кислота — слабая, поэтому сильные кислоты вытесняют ее из ацетатов: CH 3 COONa + HCl СН 3 СООН + NaCl 6) Сложный эфир образуется при нагревании уксусной кислоты с этанолом в присутствии серной кислоты: СН 3 СООН + С 2 Н 5 ОН СН 3 СООС 2 Н 5 + Н 2 О](https://fsd.multiurok.ru/html/2020/03/24/s_5e79ff19e8354/img53.jpg)
Решение.
1) Этанол окисляется до ацетата натрия хроматом натрия в щелочном растворе:
ЗС 3 Н 5 ОН + 4Na 2 CrO 4 + 7NaOH + 4H 2 O 3CH 3 COONa + 4Na 3 [Cr(OH) 6 ].
2) Этилацетат гидролизуется под действием щелочей:
СН 3 СООС 2 Н 5 + NaOH CH 3 COONa + С 2 Н 5 ОН.
3) Этанол окисляется до уксусной кислоты дихроматом калия в кислом растворе:
5С 2 Н 5 ОН + 4KMnO 4 + 6H 2 SO 4 5СН 3 СООН + 2K 2 SO 4 +4MnSO 4 +
+ 11H 2 O.
4) Этилацетат можно получить из ацетата натрия действием этилиодида:
CH 3 COONa + C 2 H 5 I СН 3 СООС 2 Н 5 + Nal.
5) Уксусная кислота — слабая, поэтому сильные кислоты вытесняют ее из ацетатов:
CH 3 COONa + HCl СН 3 СООН + NaCl
6) Сложный эфир образуется при нагревании уксусной кислоты с этанолом в присутствии серной кислоты:
СН 3 СООН + С 2 Н 5 ОН СН 3 СООС 2 Н 5 + Н 2 О
Из перечисленных формул выберите формулу карбоновой кислоты

- СН 3 -СН 2 -СН 2 -СН-СН-СООН
l l
СН 3 СН 3
СН 3 СН 3
l l
2. СН 3 -СН-С-СООН
l
СН 3
Назовите
карбоновые кислоты
Проверь себя:
- 3,4 – диметилгексановая кислота
- 2,2,3 – триметилбутановая кислота

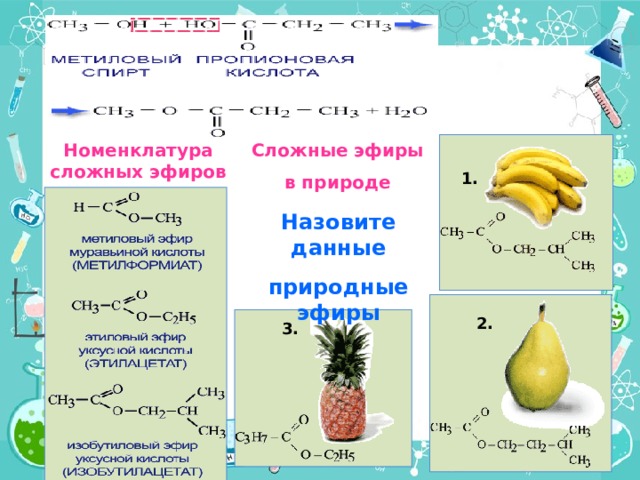
Сложные эфиры
в природе
Номенклатура сложных эфиров
1.
Назовите данные
природные эфиры
2.
3.

1.
2.
Изобутилацетат или изобутиловый эфир уксусной кислоты
3.
Изопентилацетат или изопентиловый эфир уксусной кислоты
Этилпропионат или этиловый эфир пропионовой кислоты.





































![Получение карбоновых кислот 1. Окислением спиртов [O] – оксид хрома ( VI ) в H 2 SO 4 2. Окислением альдегидов Существуют и другие способы получения карбоновых кислот](https://fsd.multiurok.ru/html/2020/03/24/s_5e79ff19e8354/img30.jpg)
 C 25 ) под действием О 2 воздуха в (ж) фазе в присутствии солей тяжелых Ме превращаются в смесь к/кислот с С 12 -С 18 → МЫЛО и ПАВ kat. С 36 Н 74 + 2,5О 2 → 2 С 17 Н 35 СООН + Н 2 О +2,5 + Н 2 О Николай Маркович Эмануэль – получил уксусную кислоту окислением бутана " width="640"
C 25 ) под действием О 2 воздуха в (ж) фазе в присутствии солей тяжелых Ме превращаются в смесь к/кислот с С 12 -С 18 → МЫЛО и ПАВ kat. С 36 Н 74 + 2,5О 2 → 2 С 17 Н 35 СООН + Н 2 О +2,5 + Н 2 О Николай Маркович Эмануэль – получил уксусную кислоту окислением бутана " width="640"
![Получение карбоновых кислот 4. Окислением алкенов [O] – KMnO 4 (кипящий р-р), О 2 (кат., t ) СН 3 – СН = СН – СН 3 + 4 [O] → 2 СН 3 - СООН 5 . Реакции гидролиза производных кислот R -СН 2 - Cl + NaCN →R-CH 2 -C ≡ N + NaCl H + + HCl R-CH 2 -C ≡ N + 2 H 2 O→R–CH 2 –COONH 4 → R–CH 2 –COOH + NH 4 Cl Существуют и другие специфические способы получения карбоновых кислот](https://fsd.multiurok.ru/html/2020/03/24/s_5e79ff19e8354/img32.jpg)


![Особенности муравьиной кислоты H 2 SO 4 ( конц. ) HCOOH → CO + H 2 O ( получение СО в лаборатории ) Двойственность свойств - альдегидокислота Альдегидная группа Карбоксильная группа О О || || Н – С – ОН + [ О ] → НО – С – ОН → СО 2 + Н 2 О О О СО 2 || || Н – О – С – Н + Ag 2 O → 2 Ag + Н – О – С – О – Н Н 2 О Реакция серебряного зеркала угольная кислота Сильный восстановитель аммиачный р-р](https://fsd.multiurok.ru/html/2020/03/24/s_5e79ff19e8354/img35.jpg)


![Акриловая и метакриловая кислоты являются непредельными карбоновыми кислотами и проявляют свойства алкенов СН 2 =СН-СООН и СН 2 =С(СН 3 )-СООН MoO 3 , t СН 2 =СН-СН 3 + 3 [O] → СН 2 =СН-СООН + H 2 O пропен t СН 2 =СН-С N + 2 H 2 O → СН 2 =СН-СООН + NH 3 нитрил акриловой кислоты](https://fsd.multiurok.ru/html/2020/03/24/s_5e79ff19e8354/img38.jpg)














![Решение. 1) Этанол окисляется до ацетата натрия хроматом натрия в щелочном растворе: ЗС 3 Н 5 ОН + 4Na 2 CrO 4 + 7NaOH + 4H 2 O 3CH 3 COONa + 4Na 3 [Cr(OH) 6 ]. 2) Этилацетат гидролизуется под действием щелочей: СН 3 СООС 2 Н 5 + NaOH CH 3 COONa + С 2 Н 5 ОН. 3) Этанол окисляется до уксусной кислоты дихроматом калия в кислом растворе: 5С 2 Н 5 ОН + 4KMnO 4 + 6H 2 SO 4 5СН 3 СООН + 2K 2 SO 4 +4MnSO 4 + + 11H 2 O. 4) Этилацетат можно получить из ацетата натрия действием этилиодида: CH 3 COONa + C 2 H 5 I СН 3 СООС 2 Н 5 + Nal. 5) Уксусная кислота — слабая, поэтому сильные кислоты вытесняют ее из ацетатов: CH 3 COONa + HCl СН 3 СООН + NaCl 6) Сложный эфир образуется при нагревании уксусной кислоты с этанолом в присутствии серной кислоты: СН 3 СООН + С 2 Н 5 ОН СН 3 СООС 2 Н 5 + Н 2 О](https://fsd.multiurok.ru/html/2020/03/24/s_5e79ff19e8354/img53.jpg)














