
ХИМИЯ, 11 КЛАСС
Кристаллические решётки и их виды

Алгоритм определения вида химической связи
Вещества
Простые
Сложные
Неметаллы
Металлы
Неметаллы
Металл и
неметалл
Ионная связь
Ковалентная
полярная
связь
Металлическая
связь
Ковалентная
неполярная
связь

Агрегатное состояние веществ
вещество
газ
жидкое
твердое
аморфное
кристаллическое

- Вещества в твердом состоянии, как правило, имеют кристаллическое строение , для которого характерно определенное расположение частиц в пространстве относительно друг друга.
- Кристаллические структуры достаточно часто встречаются в природе. Так, многие вещества образуют кристаллогидраты, включающие в свой состав молекулы воды.
Медный купорос
Каменная соль
Сульфат никеля

- Кристаллы – твердые вещества, частицы которых образуют периодически повторяющуюся в пространстве структуру – кристаллическую решетку.
- Кристаллические решётки веществ - это упорядоченное расположение частиц(атомов, молекул, ионов) в строго определённых точках пространства.
- Точки размещения частиц называют узлами кристаллической решётки.
- В узлах кристаллической решетки могут быть молекулы, атомы или ионы.

Типы кристаллических решеток

Кристаллы
Молекулярные
Немолекулярные
Атомные
Ионные
Кристаллические

Ионными называют решётки, в узлах которых находятся положительно и отрицательно заряженные ионы , между которыми существуют ионные связи.
Хлорид натрия (масштабная модель)

Модели ионных кристаллов:
Фторид кальция
Карбонат кальция
Нитрат калия
Хлорат ( VII) калия

Физические свойства ионных кристаллических решеток
Ионные кристаллы с ионной связью (большинство солей ) обладают высокой твёрдостью, и тугоплавкостью, малолетучи, растворимы только в полярных растворителях (воде), т. к. силы притяжения между ионами весьма значительны.
7

Вещества с ионной кристаллической решеткой
Каменная соль
Мел
Малахит
Поташ

Атомные кристаллические решетки
Атомной называется решётка, в узлах которой находятся отдельные атомы , соединённые между собой прочными ковалентными связями.
Структурный фрагмент алмаза - тетраэдр
В узлах решётки алмаза находятся атомы углерода
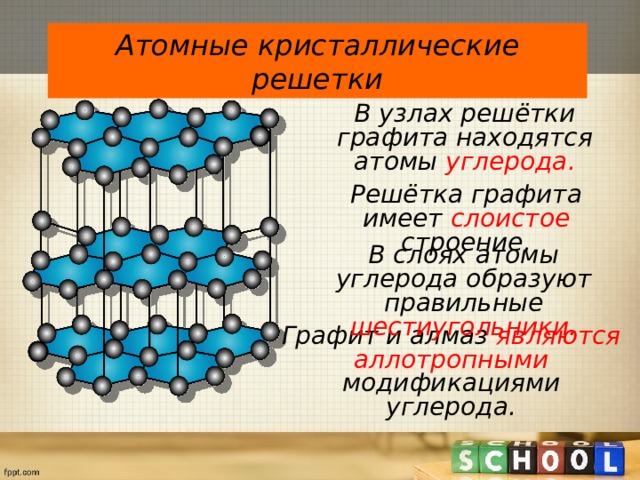
Атомные кристаллические решетки
В узлах решётки графита находятся атомы углерода.
Решётка графита имеет слоистое строение.
В слоях атомы углерода образуют правильные шестиугольники.
Графит и алмаз являются аллотропными модификациями углерода.

Атомнве решётки способны образовать и сложные вещества
Оксид кремния ( IV)
Кварц, горный хрусталь, песок, кремнезём
Структурный фрагмент диоксида кремния – кремнекислородный тетраэдр.
В узлах решётки находятся атомы кремния и кислорода .

Физические свойства атомных кристаллических решеток
Атомные кристаллы ( алмаз, кремний, германий, бор, оксид и карбид кремния ) обладают исключительно большой прочностью и твёрдостью, высокими температурами плавления, практически нерастворимы , т. к. между атомами существуют прочные ковалентные связи.

Вещества с атомной кристаллической решеткой
Сложные:
Простые:
Кварц SiO 2
Графит
Алмаз
Кремний
Карборунд SiC
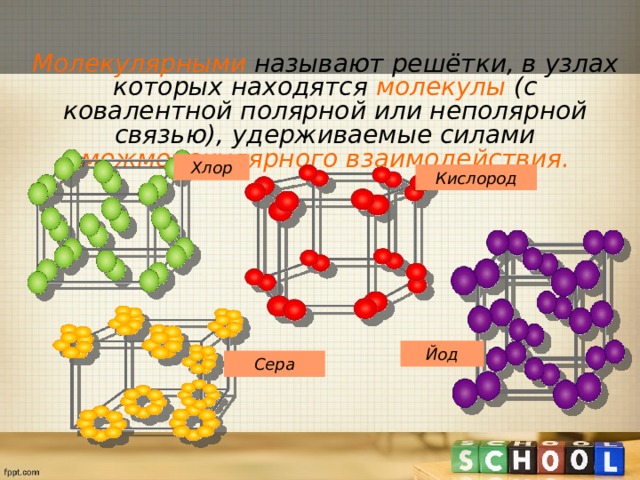
Молекулярными называют решётки, в узлах которых находятся молекулы (с ковалентной полярной или неполярной связью), удерживаемые силами межмолекулярного взаимодействия.
Хлор
Кислород
Йод
Сера

Модели молекулярных кристаллов –сложных веществ
Оксид c еры (VI)
Оксид углерода (IV)

Физические свойства молекулярных кристаллических решеток
Молекулярные кристаллы с неполярной связью (водород, сера, фосфор и др. ) обладают весьма низкими температурами плавления, многие вещества летучи, т. к. связь между атомами слабая межмолекулярная.
- Молекулярные кристаллы с неполярной связью (водород, сера, фосфор и др. ) обладают весьма низкими температурами плавления, многие вещества летучи, т. к. связь между атомами слабая межмолекулярная.

Органические:
Вещества с молекулярной кристаллической решеткой
Простые:
Сложные:
Йод
Неорганические:
Вода
Бром
Сахароза

Металлическими называют решётки, в узлах которых находятся отдельные атомы или ионы металлов , которые связаны между собой металлической связью - за счёт обобществлённых электронов
Для металлов характерны:
проводимость.
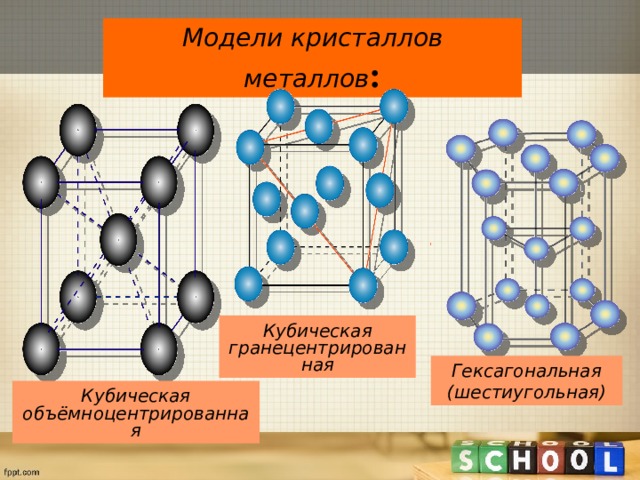
Модели кристаллов металлов :
Кубическая гранецентрированная
Гексагональная (шестиугольная)
Кубическая объёмноцентрированная

Вещества с металлической кристаллической решеткой
Алюминий
Магний
Золото
Медь

Обратите внимание
Тип химической
связи
- Ионная (NaCI, K 2 S, CaO…)
- Ковалентная
- а) неполярная ( алмаз, SiC.., H 2 , F 2 , Cl 2 …)
- б) полярная (CH 4 , PH 3 , CCI 4 …)
- Металлическая (Na, Fe, Al , сплавы …)
Тип кристаллической решетки
Ионная
Атомная
Молекулярная
Металлическая

Определение свойств вещества на основании кристаллической решетки
Вещества
Простые
Сложные
Металлы
Неметаллы
Неметаллы
Металл и
неметалл
Ионная связь
Металлическая
связь
Ковалентная
неполярная связь
Ковалентная
полярная связь
Металлическая
решетка
Атомная решетка
C, Si, Ge, SiO2
Молекулярная
решетка
Ионная решетка
Твердые, блестят,
проводят ток
и тепло,
ковкие, пластичные
Твердые,
тугоплавкие,
часто электролиты
Летучие,
легкоплавкие,
непрочные .
Очень твердые,
очень прочные,
не растворяются

Типы кристаллических решёток простых веществ











































