Просмотр содержимого документа
«Презентация по химии на тему "Сера" (9 класс)»

СЕРА И ЕЁ СОЕДИНЕНИЯ

СЕРА- химический элемент:
- VI группа главная подгруппа ;
- III малый период ;
- Порядковый № 16 – значит заряд ядра атома серы
(+ 16), 16 протонов в ядре, 16 электронов в атоме ;
- Относительная атомная масса 32 .

S
+ 16
8
6
2

Для серы характерны степени окисления
-2, 0, +4, +6;
атом серы может быть и окислителем , и восстановителем:
Или окислитель,
или восстановитель
Окислитель
Восстановитель
-2
H 2 S
K 2 S
0
S
+4
SO 2
H 2 SO 3
K 2 SO 3
+6
SO 3
H 2 SO 4
K 2 SO 4

СЕРА – простое вещество :
Аллотропные модификации серы :
- Ромбическая сера -кристаллы в виде октаэдров со срезанными углами, лимонно- жёлтого цвета, полупрозрачны, температура плавления +112,8 ;
- Моноклинная сера- игольчатые кристаллы, темп.плавл.119,3 ;
- Пластическая сера – прозрачная резинообразная масса тёмно-коричневая.

Нахождение соединений серы
в природе
Самородная
сера
Сульфидная сера
Сульфатная сера
Халькопирит
Киноварь
Гипс
HgS
CuFeS 2
Сфалерит
Галенит
CaSO 4 •2H 2 O
PbS
ZnS

Сера в природе:
Самородная сера
известна человеку с
древнейших времен.
Считалось, что голубое
пламя и запах,
распространяемый
при горении серы,
отгоняет демонов.

Сера - биогенный элемент.
0,5-2 %
0,3-1,2 %,
1402 г

Биологическое значение серы
- Входит в состав белков- одних из основных химических компонентов клеток всех живых организмов. Это белки волос, рогов, шерсти;
- Сера – составная часть БАВ организма: витаминов и гормонов (н-р, инсулин);
- Недостаток серы – хрупкость и ломкость костей, выпадение волос.
- Серой богаты: яйца, овсяные хлопья,горох

Химические свойства серы
S
1. Взаимодействие с металлами.
2
восстановитель
1
окислитель

2.Взаимодействие с водородом
S
1
окислитель
1
восстановитель

S
3.Взаимодействие с кислородом
восстановитель
1
окислитель
1

Химические свойства
- со фтором , S + 3F 2 = SF 6
- Расплав серы реагирует с хлором ,
2 S + Cl 2 = S 2 Cl 2
- При нагревании сера также реагирует с фосфором , 5S + 2P = P 2 S 5
- с водородом , углеродом ,
S + H 2 = H 2 S (сероводород)
C + 2S = CS 2 (сероуглерод)

Химические свойства
- При нагревании сера взаимодействует со многими металлами, 2 Na + S = Na 2 S
- С концентрированными кислотами-окислителями
S + 6HNO 3( конц .) = H 2 SO 4 + 6NO 2 ↑ + 2H 2 O
S + 2 H 2 SO 4(конц.) = 3 SO 2 ↑ + 2 H 2 O

Сероводород
FeS + 2 HCl = FeCl 2 + H 2 S
- Газ
- бесцветный
- запах тухлых яиц
- ядовит
- хорошо растворим в воде
(сероводородная кислота)

O ксид серы (IV)
4 Fe S 2 + 11 O 2 = 2 Fe 2 O 3 + 8 S O 2
- газ
- бесцветный
- запах резкий, удушающий
- t кип = -10С
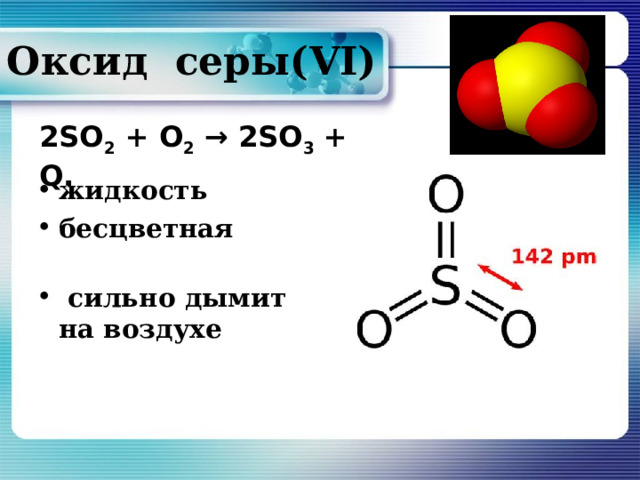
O ксид серы( VI)
2SO 2 + O 2 → 2SO 3 + Q.
- жидкость
- бесцветная
- сильно дымит на воздухе
 H 2 SO 4 РЯД АКТИВНОСТИ МЕТАЛЛОВ : Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb , H 2 , Cu, Hg, Ag, Au " width="640"
H 2 SO 4 РЯД АКТИВНОСТИ МЕТАЛЛОВ : Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb , H 2 , Cu, Hg, Ag, Au " width="640"
Серная кислота
H 2 O + SO 3 = H 2 SO 4
РЯД АКТИВНОСТИ МЕТАЛЛОВ :
Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb , H 2 , Cu, Hg, Ag, Au

Взаимодействие раствора серной кислоты с металлами :
- Металлы, стоящие в ряду активности до водорода, вытесняют водород из раствора серной кислоты ;
- Металлы, стоящие в ряду активности после водорода, не вытесняют водород из разбавленной серной кислоты (раствор кислоты)

Серная кислота-окислитель :
- Концентрированная серная кислота ,особенно горячая ,- энергичный окислитель
- 8 HJ + H 2 SO 4 = 4 J 2 + H 2 S + 4 H 2 О
- 2HBr + H 2 SO 4 = Br 2 +SO 2 + 2H 2 О
- C + 2 H 2 SO 4 = CO 2 + 2 SO 2 + 2 H 2 O
- 3 S + 2 H 2 SO 4 = 3 SO 2 + 2 H 2 O

Сера и окружающая среда :
96% серы
в виде S О 2

Кислотные дожди.

Кислотные дожди :
Кислотные осадки разрушают сооружения из мрамора и известняка.
Исторические памятники Греции и Рима, простояв тысячелетия, за последние годы разрушаются прямо на глазах.

Сероводород в атмосфере.
Сероводород
4-16 млн. т
соединений серы

Зачем нужна сера ?

Домашнее задание :
- & 22,23 учебник О.С.Габриелян «ХИМИЯ- 9»
























 H 2 SO 4 РЯД АКТИВНОСТИ МЕТАЛЛОВ : Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb , H 2 , Cu, Hg, Ag, Au " width="640"
H 2 SO 4 РЯД АКТИВНОСТИ МЕТАЛЛОВ : Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb , H 2 , Cu, Hg, Ag, Au " width="640"


















