
Решение экспериментальных задач по теме «Металлы»
Цель урока: Ознакомиться со свойствами металлов и их соединений, научиться определять качественный состав веществ и распознавать их.
Оборудование: штатив,пробирка.
Реактивы: железо, цинк, соляная кислота, хлорид натрия, гидроксид натрия азотная кислота, нитрат серебра, лакмус, сульфат меди.
Орг.момент: 1. Деление на группы (2)
2. Соблюдение правила работы в группе
Ход урока: 1. Ознакомление с правилами техники безопасности
2. тест
3.Выполнение практической работы
4.Закрепление
5.Д/з

Соблюдение правил техники безопасности при работе с химическим оборудованием и реактивами

Тест по технике безопасности:
1.Что должен сделать ученик при попадании на кожу кислоты?
а) промыть под струей воды и обработать раствором гидрокарбоната натрия;
б)обработать раствором питьевой соды;
в)обработать раствором щелочи;
г)дождаться конца урока и спросить совета учителя;
2.При попадании на кожу раствора щелочи нужно?
а)Смазать обожженное место мазью от ожогов;
б)промыть водой;
в)промыть большим количеством воды и обработать слабым
раствором уксусной кислоты;
г)обработать соляной кислотой ;

3. Почему обычно не проводят реакции взаимодействия кислот с металлами, расположенными в ряду напряжений от Li до Ca а)эти металлы недоступны учащимся и учителям; б)реакции идут очень активно, возможен взрыв; в)эти реакции не идут из-за пассивации названных металлов; г)такие реакции невозможно провести в виду отсутствия необходимого оборудования; 4.Какой объем жидкости надо приливать в пробирку, чтобы опыт был наиболее безопасен а)не более 1/3 объема пробирки; б)не более 1/2объема; в)не более 3/4 объема; г)2/3 объема; 5. При растворении некоторых металлов в азотной кислоте выделяется оксид азота(NO2) , поэтому такие опыты нужно проводить в вытяжном шкафу при включенной тяге. а)утверждение верно , т.к. газ обладает неприятным запахом; б)утверждение верно , т.к. газ взрывоопасен; в)утверждение неверно, т.к.NO2 образуется небольших количествах и это не опасно; г)утверждение верно,т.к. газ ядовит и вызывает отравление

Ответы 1.а 2.б 3.б 4.а 5.г
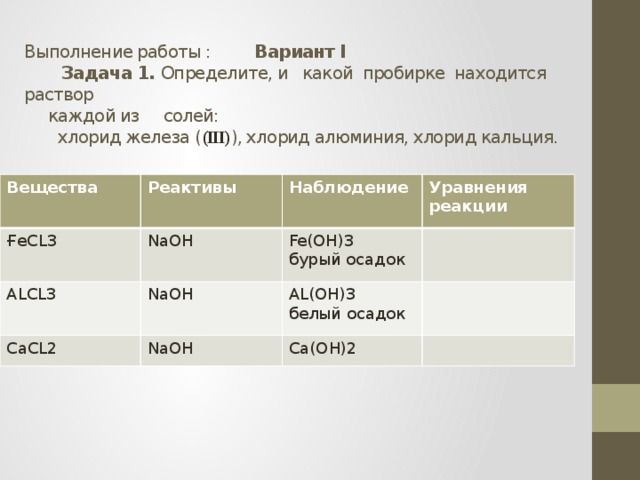
Выполнение работы : Вариант I Задача 1. Определите, и какой пробирке находится раствор каждой из солей: хлорид железа ( (III) ), хлорид алюминия, хлорид кальция.
Вещества
Реактивы
ҒеCL3
NaOH
ALCL3
Наблюдение
CaCL2
NaOH
Fe(OH)3
Уравнения реакции
бурый осадок
NaOH
AL(OH)3
белый осадок
Ca(OH)2

Задача 2. Определите , в какой из пробирок находится раствор каждой соли: сульфата железа (II), сульфата калия, сульфата алюминия.
Вещества
Реактивы
FeSO4
NaOH
Наблюдение
Na2SO4
AL2(SO4)3
Уравнение реакции
Fe(OH)2
NaOH
NaOH
зеленый осадок
нет видимых изменений
AL(OH)3
Белый осадок
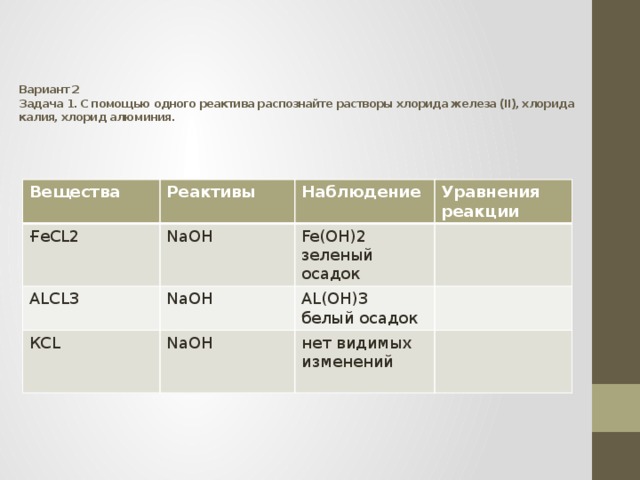
Вариант 2 Задача 1. С помощью одного реактива распознайте растворы хлорида железа (II), хлорида калия, хлорид алюминия.
Вещества
ҒеCL2
Реактивы
NaOH
ALCL3
Наблюдение
Уравнения реакции
Fe(OH)2
NaOH
КСL
зеленый осадок
NaOH
AL(OH)3
белый осадок
нет видимых изменений
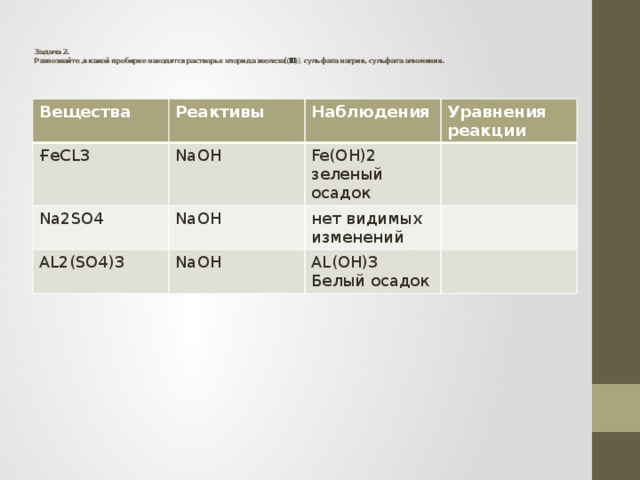
Задача 2. Разпознайте ,в какой пробирке находятся растворы: хлорида железа( (III) ), сульфата натрия, сульфата алюминия.
Вещества
Реактивы
ҒеCL3
Наблюдения
NaOH
Na2SO4
AL2(SO4)3
Уравнения реакции
Fe(OH)2
NaOH
NaOH
зеленый осадок
нет видимых изменений
AL(OH)3
Белый осадок

Закрепление
Найдите соответствие
1.Соотнесите окраску свежеполученных осадков оснований и их названия
голубая гидроксид алюминия
красно-бурая гидроксид кальция
белая гидроксид железа (II)
зеленая гидроксид меди (II)
cтуденистая гидроксид железа (III
2.Выберите способ получения железа (III)
a)Ғе 2SO4+NaOH
б)Ғе+H2O
в)Ғе2O3+ H2O
г)ҒеCL3+NaOH
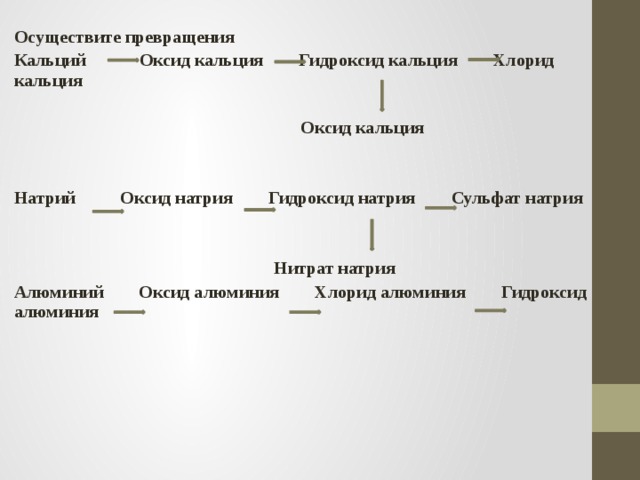
Осуществите превращения
Кальций Оксид кальция Гидроксид кальция Хлорид кальция
Оксид кальция
Натрий Оксид натрия Гидроксид натрия Сульфат натрия
Нитрат натрия
Алюминий Оксид алюминия Хлорид алюминия Гидроксид алюминия

Д/З Глава III «Металлы»
Подготовка к контрольной работе.
Повторение : Глава ІІІ «Металлы»
Упражнения для повторения темы «Металлы»





























