Просмотр содержимого документа
«Презентация по теме "Фенол"»

Фенол
Химия – 10
Автор: Кунова Г.В. – учитель химии ЦОРиО
г. Липецк

- Функциональная группа фенолов такая же, как и у спиртов, –ОН .
- Наиболее известный представитель этого класса соединений ‒ фенол С 6 Н 5 –ОН.
- Радикал фенола C 6 H 5 – называется фенил.
Историческая справка
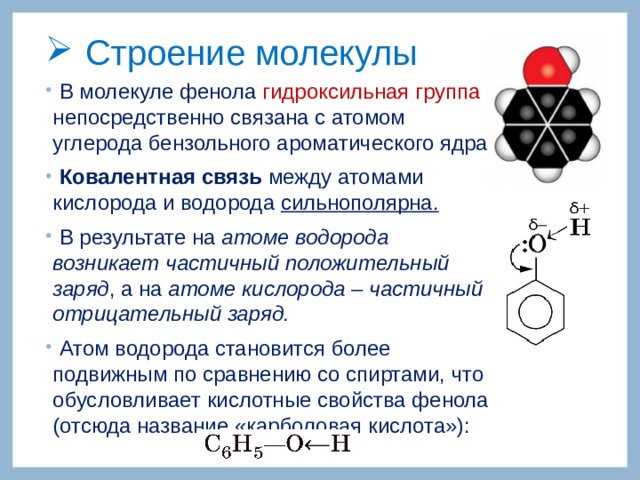
- В молекуле фенола гидроксильная группа непосредственно связана с атомом углерода бензольного ароматического ядра.
- Ковалентная связь между атомами кислорода и водорода сильнополярна.
- В результате на атоме водорода возникает частичный положительный заряд , а на атоме кислорода – частичный отрицательный заряд.
- Атом водорода становится более подвижным по сравнению со спиртами, что обусловливает кислотные свойства фенола (отсюда название «карболовая кислота»):
 реакции замещения идут по положению 2, 4, 6. " width="640"
реакции замещения идут по положению 2, 4, 6. " width="640"
- Влияние гидроксила на фенил состоит в том, что он делает атомы водорода в положениях 2, 4 и 6 более подвижными:
= реакции замещения идут по положению 2, 4, 6.

- Твёрдое, бесцветное, кристаллическое вещество, очень гигроскопичное, с характерным резким запахом.
- На воздухе фенол окисляется, поэтому его кристаллы приобретают вначале розоватый оттенок, а при длительном хранении темнеют и становятся красноватыми.
- Малорастворим в воде при комнатной температуре, но быстро и хорошо растворяется при 60-70°С.
- Легкоплавок, его температура плавления 43°С.
- Фенол обладает антисептическими (обеззараживающими) свойствами.
- Токсичен!

Наличие в молекуле фенола как гидроксильной группы , так и бензольного кольца в углеводородном радикале фениле обусловливает его химические свойства.
- Химические свойства по группе ─ОН
Наличие группы –ОН в молекуле делает некоторые его свойства схожими со свойствами спиртов.
1. Фенол реагирует с щелочными металлами
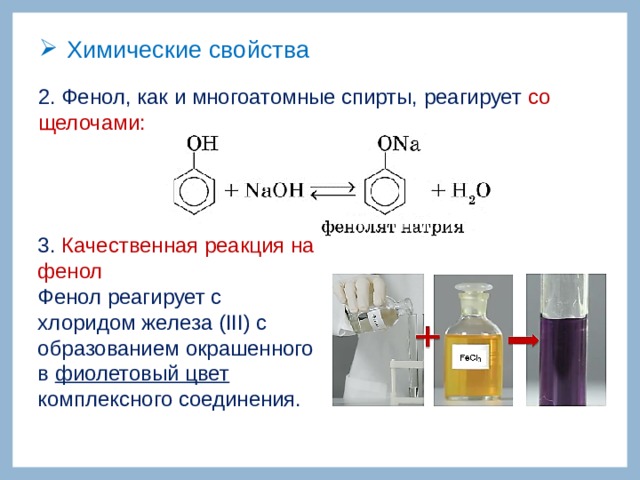
2. Фенол, как и многоатомные спирты, реагирует со щелочами:
3. Качественная реакция на фенол
Фенол реагирует с хлоридом железа (III) с образованием окрашенного в фиолетовый цвет комплексного соединения.
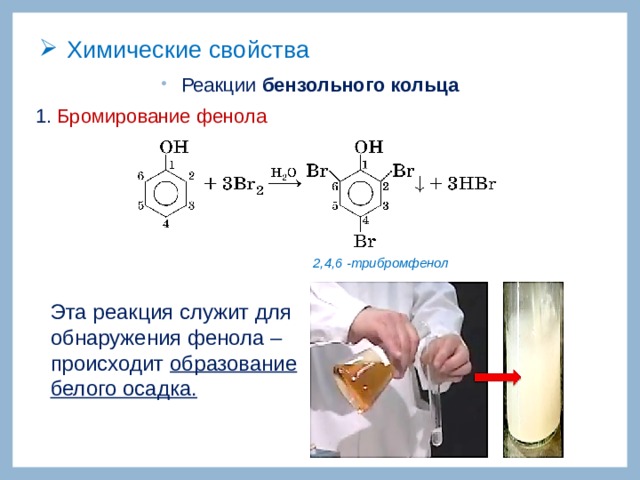
- Реакции бензольного кольца
1. Бромирование фенола
2,4,6 -трибромфенол
Эта реакция служит для обнаружения фенола – происходит образование белого осадка.
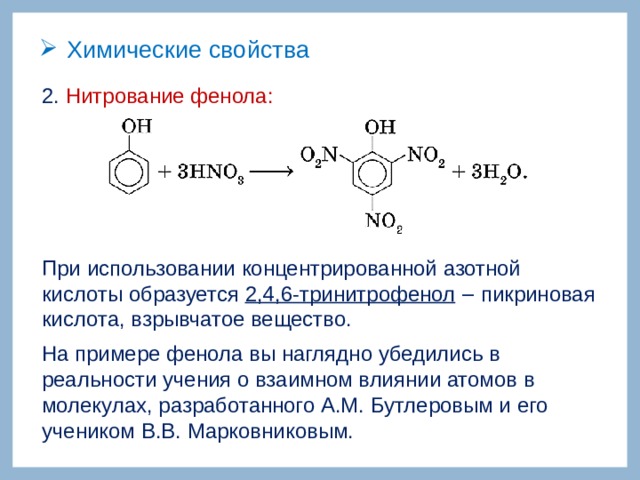
2. Нитрование фенола:
При использовании концентрированной азотной кислоты образуется 2,4,6-тринитрофенол ‒ пикриновая кислота, взрывчатое вещество.
На примере фенола вы наглядно убедились в реальности учения о взаимном влиянии атомов в молекулах, разработанного А.М. Бутлеровым и его учеником В.В. Марковниковым.

Вывод:
Для фенола характерны
реакции замещения
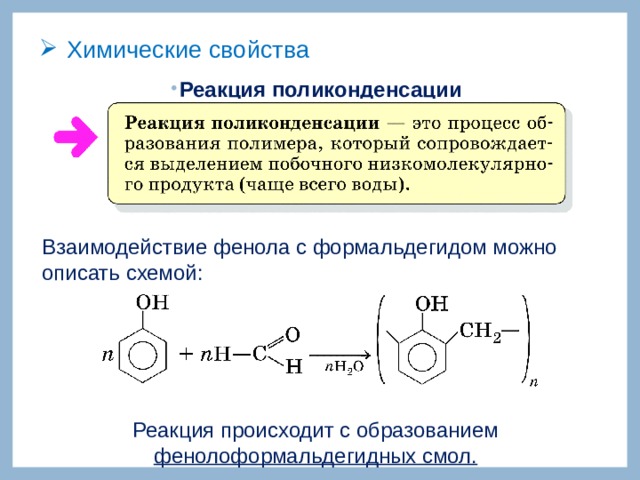
Взаимодействие фенола с формальдегидом можно описать схемой:
Реакция происходит с образованием фенолоформальдегидных смол.

- Получение фенола из каменного угля.
Способ, открытый ещё в XIX в., до сих пор широко используется в промышленности. Фенол извлекают из каменноугольной смолы.
В настоящее время это основной промышленный метод получения фенола.
Это довольно сложный многоступенчатый процесс.
В уравнении реакции мы приведём лишь исходные вещества и конечные продукты:
фенол
ацетон

- Получение из галогенаренов.
При нагревании хлор- или бромпроизводных аренов с щелочами при повышенном давлении получают фенолят щелочного металла, который после обработки сильной кислотой превращают в фенол:
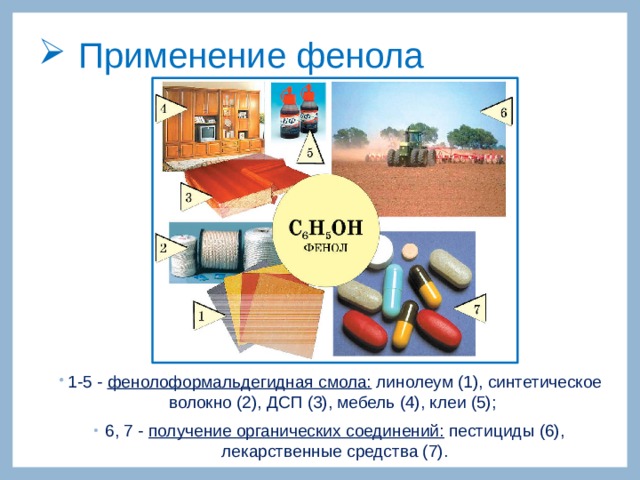
- 1-5 - фенолоформальдегидная смола: линолеум (1), синтетическое волокно (2), ДСП (3), мебель (4), клеи (5);
- 6, 7 - получение органических соединений: пестициды (6), лекарственные средства (7).

Источники
Н.Е. Кузнецова, Н.Н. Гара.
Химия. 10 класс. Базовый уровень: учебник для общеобразовательных школ. – 3-е издание, переработанное – М. : Вентана-Граф, 2015.










 реакции замещения идут по положению 2, 4, 6. " width="640"
реакции замещения идут по положению 2, 4, 6. " width="640"





















