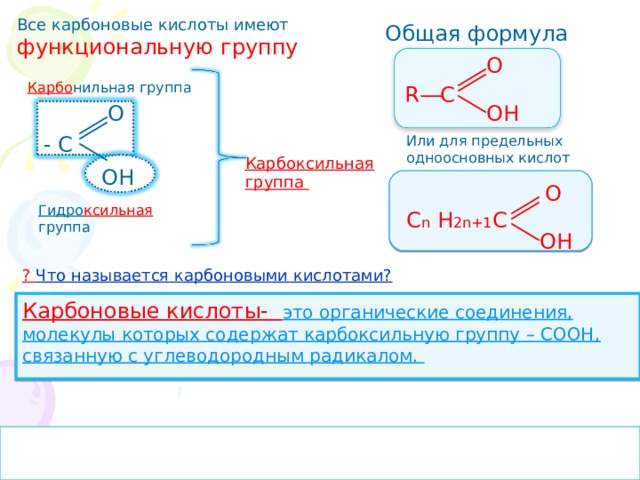
Все карбоновые кислоты имеют
функциональную группу
Общая формула
О
R C
Карбо нильная группа
ОН
О
- С
Или для предельных одноосновных кислот
Карбоксильная
группа
ОН
О
Гидро ксильная группа
С n Н 2n +1 С
ОН
? Что называется карбоновыми кислотами?
Карбоновые кислоты- это органические соединения, молекулы которых содержат карбоксильную группу – СООН, связанную с углеводородным радикалом.



Проклассифицируйте предложенные кислоты
1.Одноосновная, предельная
1) С H 3 – СН 2 – СН 2 – СН 2 - COOH
2) HOOC - СН 2 - СН 2 - COOH
2. Двухосновная, предельная
3 ) COOH
3.Одноосновная, ароматическая
СН 3
4. Одноосновная, непредельная
4 ) CH 3 – ( C Н 2 ) 7 – СН = СН - (СН 2 ) 7 - COOH
5.Многоосновная, предельная
5 ) HOOC – СН 2 - CH – СН 2 - COOH
COOH


НОМЕНКЛАТУРА КАРБОНОВЫХ КИСЛОТ
КИСЛОТА
АЛКАН + ОВ + АЯ
МЕТАН ОВ АЯ КИСЛОТА
(МУРАВЬИНАЯ КИСЛОТА)

1
2
3
4
5
СН3 – СН2 – СН2 – СН2 – СООН
ПЕНТАН ОВ АЯ КИСЛОТА
(ВАЛЕРИАНОВАЯ КИСЛОТА)
1
2
НООС – СООН
ЭТАН ДИ ОВ АЯ КИСЛОТА
(ЩАВЕЛЕВАЯ КИСЛОТА)
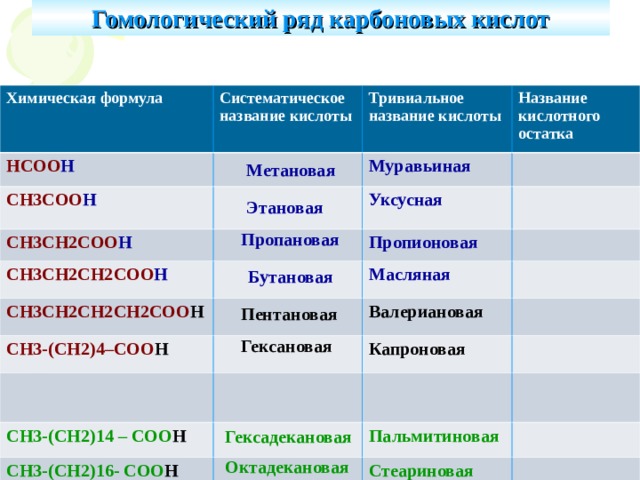
Гомологический ряд карбоновых кислот
Химическая формула
Систематическое название кислоты
НСОО Н
Тривиальное название кислоты
СН3СОО Н
Название кислотного остатка
Муравьиная
СН3СН2СОО Н
Уксусная
СН3СН2СН2СОО Н
Пропионовая
СН3СН2СН2СН2СОО Н
Масляная
СН3-(СН2)4–СОО Н
Валериановая
Капроновая
СН3-(СН2)14 – СОО Н
СН3-(СН2)16- СОО Н
Пальмитиновая
Стеариновая
Метановая
Этановая
Пропановая
Бутановая
Пентановая
Гексановая
Гексадекановая
Октадекановая


Алгоритм названия карбоновых кислот:
1 . Находим главную цепь атомов углерода и нумеруем её, начиная с карбоксильной группы.
2. Указываем положение заместителей и их название (названия).
3. После корня, указывающего число атомов углерода в цепи, идет суффикс «-овая» кислота.
4. Если карбоксильных групп несколько, то перед «- овая» ставится числительное ( -ди, - три…)
Пример:
3- метил бутан + -овая = 3-метил бутан овая
кислота
кислота

ДАЙТЕ НАЗВАНИЕ ВЕЩЕСТВАМ ПО МЕЖДУНАРОДНОЙ НОМЕНКЛАТУРЕ
(2 – МЕТИЛ ПРОПАН ОВАЯ КИСЛОТА)
СН3
2. СН3 – СН2 – СН – СН – СООН
( 2, 3 – ДИМЕТИЛ ПЕНТА-
Н ОВАЯ КИСЛОТА )
СН3
СН3
( 2 – МЕТИЛ ПЕНТ ЕН – 3 – ОВАЯ
КИСЛОТА )
3. СН3 – СН = СН – СН – СООН
СН3
4. НООС – СН2 – СН – СООН
( 2 –ЭТИЛ БУТАН ДИ ОВАЯ КИСЛОТА )
С 2 Н 5

ФИЗИЧЕСКИЕ СВОЙСТВА
С 1 – С 3
Жидкости с характерным резким запахом,
хорошо растворимые в воде
Вязкие маслянистые жидкости с
неприятным запахом, плохо
растворимые
в воде
С 4 – С 9
Твердые вещества,
не имеющие запаха,
не растворимые
в воде
C 10 и более


Зависимость физических свойств карбоновых кислот от строения молекулы:
Низшие карбоновые кислоты – жидкости ; высшие – твердые вещества
Чем больше относительная молекулярная масса кислоты, тем меньше ее запах.
С увеличением относительной молекулярной массы кислоты растворимость уменьшается
- Гомологический ряд альдегидов начинается с двух газообразных веществ (при комнатной температуре), а среди карбоновых кислот газов нет. С чем это связано?

Химические свойства карбоновых кислот
І. Общие с неорганическими кислотами
- Растворимые карбоновые кислоты в водных растворах диссоциируют:
СН 3 – СООН СН 3 – СОО + Н
+
Среда кислая
Лакмус (фиолетовый) – краснеет
Метилоранжевый- розовеет
Фенофталеин – не меняет цвет
? Как изменятся окраска
индикаторов в кислой среде ?
2. Взаимодействие с металлами , стоящими в электрохимическом ряду напряжений до водорода:
2СН 3 – СООН +М g
+ Н 2
(СН 3 –СОО) 2 М g
Ацетат магния
Уксусная кислота
2СН 3 - СООН + Zn Уксусная кислота
(СН 3 –СОО)2 Zn
Ацетат цинка
+ Н 2
При взаимодействии металла с раствором карбоновой кислоты образуется
водород и соль

3.Взаимодействие с основными оксидами:
2 СН 3 – СООН + С u О
Уксусная кислота
t
+ Н 2 О
(СН 3 – СОО) 2 С u
Ацетат меди
4. Взаимодействие с гидроксидами металлов (реакция нейтрализации)
СН 3 СОО Na
СН 3 – СООН + НО – Na
+ Н 2 О
Ацетат натрия
Уксусная кислота
( СН3СОО ) 2 Cu
Ацетат меди
+ Н2О
2 СН3 – СООН + Cu( ОН ) 2
Уксусная кислота
5.Взаимодействие с солями более слабых и летучих кислот кислот (н-р, угольной, кремниевой, сероводородной, стеариновой, пальмитиновой…)
СО 2
+ Н 2 СО 3
2СН 3 СОО Na
Ацетат натрия
2СН 3 – СООН
+ Na 2 CO 3
карбонат натрия
Уксусная кислота
Н 2 О

Специфические свойства муравьиной кислоты
Реакция «Серебряного зеркала»
СО 2
О
t
2Ag
+ Н 2 СО 3
+ Ag 2 O
Н- С
Н 2 О
ОН
Оксид серебра
серебро
Муравьиная кислота


Нахождение в природе и применение карбоновых кислот
Муравьиная кислота ( Метановая кислота)
- Химическая формула СН2О2, или НСООН.
- Муравьиная кислота открыта в кислых выделениях рыжих муравьев в 1670 г. английским естествоиспытателем Джоном Реем.
Муравьиная кислота присутствует также в тончайших волосках крапивы, в пчелином яде, сосновой хвое, в небольших количествах найдена в различных фруктах, тканях, органах, выделениях животных и человека.

Применение муравьиной кислоты
Муравьиная кислота обладает ярко выраженными бактерицидными свойствами . Поэтому ее водные растворы используют как:
- Пищевой консервант;
- Парами дезинфицируют тару для продовольственных товаров
( в том числе винные бочки);
- В пчеловодстве - эффективное средство от варроатоза – болезни пчел, вызываемой клещами-паразитами ;
- Консервант при заготовке силоса;
- В медицине слабый водно-спиртовой раствор муравьиной кислоты(муравьиный спирт) используется при ревматических и неврологических болях для растирания;
- В органическом синтезе в качестве восстановителя ;
-Протрава при крашении тканей;
-В кожевенном производстве – для отмывания извести, используемой при обработке шкур;
-При изготовлении тяжелых жидкостей – водных растворов, обладающих большой плотностью, в которых не тонут даже камни. Такие жидкости нужны геологам для разделения минералов по плотности. Насыщенный раствор формиата таллия НСООТ l в зависимости от температуры может иметь плотность от 3,40г / см³ (при 20°С) до 4,76 г / см³( при 90°С)

Вопрос : Почему нельзя смачивать водой место муравьиного укуса или ожога крапивой? Это приводит только к усилению болевых ощущений. Почему боль утихает, если пораненное место смочить нашатырным спиртом? Что ещё можно использовать в данном случае?
При растворении муравьиной кислоты в воде происходит процесс электролитической диссоциации:
НСООН НСОО + Н
В результате кислотность среды повышается, и процесс разъедания кожи усиливается.
Чтобы боль утихла, нужно нейтрализовать кислоту, для чего необходимо использовать растворы, обладающие щелочной реакцией, н-р, раствор нашатырного спирта.
НСООН + N Н4ОН НСОО NH4 + Н2О или
НСООН + NaHCO3 НСОО Na + CO2 + H2O

Уксусная кислота (этановая кислота)
- Это – первая кислота, полученная и использованная человеком.
- «Родилась» более 4 тыс.лет назад в Древнем Египте.
- На рубеже Х VII – Х VIII вв.в России ее называли «кислая влажность».
- Впервые получили при скисании вина.
- Латинское название – Acetum acidum , отсюда название солей – ацетаты.
- Ледяная уксусная кислота при температуре ниже 16,8 º С твердеет и становится похожей на лед
- Уксусная эссенция - 70 % -раствор кислоты.
- Столовый уксус - 6 % или 9 % -й раствор кислоты.
Уксусная кислота
- содержится в выделениях животных (моче, желчи, испражнениях), в растениях (в частности ,в зеленых листьях) , в кислом молоке и сыре;
- образуется при брожении, гниении, скисании вина и пива, при окислении многих органических веществ;

Применение уксусной кислоты
- Водные растворы уксусной кислоты широко используются в пищевой промышленности (пищевая добавка E- 260 ) и бытовой кулинарии, а также в консервировании;
при производстве:
- лекарств, н-р, аспирина;
- искусственных волокон, н-р, ацетатного шелка;
- красителей-индиго, негорючей кинопленки, органического стекла;
- растворителей лаков;
- химических средств защиты растений ,
- стимуляторов роста растений;
- Ацетат натрия СН3СОО N а применяется в качестве консерванта крови, предназначенной для переливания;
- Ацетат калия СН3СООК – как мочегонное средство;
- Ацетат свинца (СН3СОО) 2 Pb - для определения сахара в моче;
Ацетаты железа ( III) ( СН3СОО )3Fe , алюминия (СН3СОО) 3Al и хрома ( III) (СН3СОО) 3 С r используют в текстильной промышленности для протравного крашения;
- Ацетат меди ( II ) (СН3СОО) 2 С u входит в состав препарата для борьбы с вредителями растений, так называемой парижской зелени;

Применение уксусной кислоты
Известно применение спиртового уксуса в косметологии. А именно для придания мягкости и блеска волосам после химической завивки и перманентной окраски. Для этого волосы рекомендуется ополаскивать теплой водой с добавлением спиртового уксуса (на 1 литр воды - 3-4 ложки уксуса).
В народной медицине уксус используется как неспецифическое жаропонижающее средство.
при головных болях методом примочек.
при укусах насекомых посредством компрессов.
Знаете ли вы , что
- Если потребуется отвинтить ржавую гайку, то рекомендуется вечером положить на нее тряпку, смоченную в уксусной кислоте ? Утром отвинтить эту гайку будет значительно легче.
- В течении суток в организме образуется 400г уксусной кислоты ? Этого хватило бы для изготовления 8 л обычного уксуса
незаменима в производстве парфюмерных продуктов

СН 3 СООН
СН3СООН
Из всех кислот
Она, конечно, прима.
Присутствует везде
И зримо и незримо.
В животных и растениях есть она,
С ней техника и медицина навсегда.
Её потомство – ацетаты-
Очень нужные «ребята».
Всем известный аспирин,
Он, как добрый господин,
Жар больного понижает
И здоровье возвращает.
Это – меди ацетат.
Он растеньям друг и брат,
Убивает их врагов.
От кислоты ещё есть толк –
Нас одевает в ацетатный шелк.
А пельмени любит кто,
Знает уксус тот давно.
Есть ещё вопрос кино:
Хорошо всем надо знать,
Что без пленки ацетатной нам кино не увидать.
Конечно, есть и другие применения.
И вам они известны без сомнения.
Но главное, что сказано, друзья,
«Хлеб промышленности» уксусная кислота.
Водный раствор ацетата меди

Лимонная кислота
COOH
HOOC – CH 2 – C – CH 2 – COOH
OH
Карбо-
новые
кислоты
в
порядке
увеличе-
ния их
кислот-
ности
Щавелевая кислота
HOOC –– COOH
Муравьиная кислота
Н –– COOH
Ацетилсалициловая
кислота
СООН
ОСОСН 3
Винная кислота
HOOC – СН - СН –– COOH
ОН ОН
Молочная кислота
СН 3 - СН –– COOH
ОН
Яблочная кислота
HOOC – СН - СН 2 –– COOH
ОН
Янтарная кислота
HOOC – СН 2 - СН 2 –– COOH
Аскорбиновая
кислота
НО ОН
Н
=О
НОН 2 С-НОНС
О
Бензойная
кислота
СООН
Уксусная кислота
H 3 C –– COOH









































