
Кислотные дожди
Составила: учитель химии
Ярмоленко Екатерина Сергеевна

Впервые термин «кислотный дождь» был введен в 1872 году английским учёным Робертом Ангусом Смитом в книге «Воздух и дождь: начало химической климатологии».
Его внимание привлек смог в
Манчестере

Ежегодно в атмосферу Земли выбрасывается около 200 млн. т твердых частиц (пыль, сажа и др.), 200 млн.т сернистого газа (SO2), 700 млн. т оксида углерода (II), 150 млн. т оксидов азота (NOx), что составляет в сумме более 1 млрд. т вредных веществ.
Кислотный дождь, причины :
все виды метеорологических осадков – дождь, снег, град, туман, дождь со снегом, – при которых наблюдается понижение pH (водородного показателя) дождевых осадков
из-за загрязнений воздуха кислотными оксидами
(массовые выбросы оксида серы( IV ) SO 2 и оксидов азота NO в атмосферу).

Источники поступления SO 2
- природные: вулканы, лесные пожары (20 млн.тонн в год);
- антропогенные: печи в частном секторе, мусорные свалки (100 млн. тонн в год);
- техногенные: сжигание угля, мазута на электро- и теплостанциях, металлургические производства, машиностроение, химические технологические процессы (5707 млн.тонн в год).
Источники поступления NO и NO 2
- природные ( 700 млн. тонн в год);
- антропогенные: сельское хозяйство
(минеральные азотные удобрения);
- техногенные: автотранспорт и моторный
транспорт, энергетика, металлургическая
химическая промышленность.
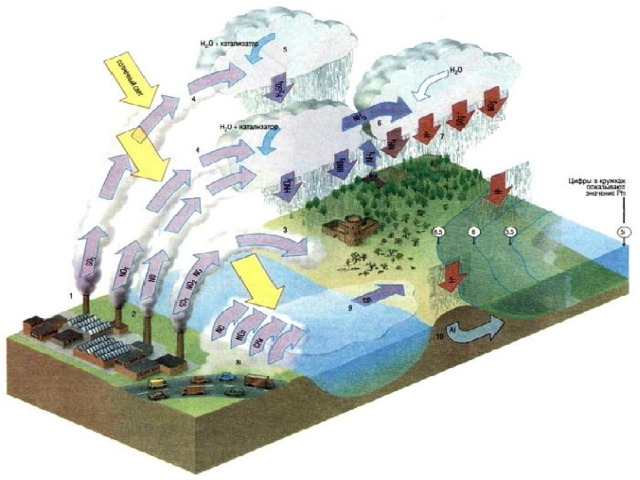

Как образуются кислоты
SO 2 + H 2 O = H 2 SO 3
2 SO 2 + O 2 = 2 SO 3
SO 3 + H 2 O = H 2 SO 4
4 NO 2 + O 2 + 2 H 2 O = 4 HNO 3
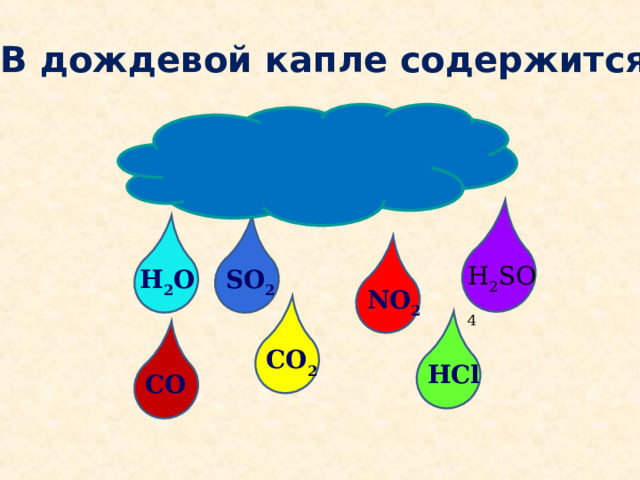
В дождевой капле содержится:
H 2 SO 4
SO 2
H 2 O
NO 2
CO 2
HCl
CO

Выпадение кислотных дождей:
- впервые было отмечено в Скандинавии и Северной Америке в 50-х годах (рН 4,5 – 3,7);
- мировой рекорд принадлежит шотланскому городу Питлохри, где в 1974 году выпал дождь с рН 2,4.
Кислотные дожди в России:
- Челябинск (рН 3,4 - 3,1);
- Красноярск (рН 4,9 – 3,80);
- Казань (рН 4,8 - 3,3);
- Санкт–Петербург(рН 4,8 - 3,7).
Особенно тревожная ситуация сложилась в Центральном и
Центрально - Черноземном районах, а также в Кемеровской
области и Алтайском крае, в Норильске. В Москве и Санкт-
Петербурге с кислотными дождями на землю в год выпадает до
1500 кг серы на 1 кв.м. Заметно меньше кислотность осадков в
прибрежной зоне северных, западно - и восточносибирских
морей. Самым благоприятным регионом в этом отношении
признана Республика Саха (Якутия).

Последствия кислотных дождей
2)Изменения в почве:
-закисление почвы,
-разрушение корневой системы,
-нарушение процессов всасывания воды и питательных веществ,
-вымывание биогенов и питательных веществ,
-высвобождение ионов токсичных металлов,
-угнетение и гибель почвенной биоты,в частности азотфиксируюших бактерий.
1)Изменения в водных экосистемах:
-повышение кислотности воды,
-выщелачивание тяжелых металлов,
-интоксикация воды,
-связывание фосфатов,
-утрата рыбных ресурсов,
-сокращение животных и птиц, живущих около воды,
-дефицит чистой пресной воды.
3)Изменение растительности:
-повреждение листовой поверхности и хвойных игл,
-нарушение транспирации,
-нарушение фотосинтеза,
-снижение сопротивляемости патогенным организмам,
-накопление в камбии токсичных тяжелых металлов,
-ослабление, нарушение роста,
-деградация,усыхание,гибель .

Страдают от кислотных дождей и люди, вынужденные потреблять питьевую воду, загрязненную токсическими металлами — ртутью, свинцом, кадмием и т.п.
Спасать природу от закисления необходимо. Для этого придется резко снизить выбросы в атмосферу окислов серы и азота, но в первую очередь сернистого газа, так как именно серная кислота и ее соли на 70-80 % обусловливают кислотность дождей, выпадающих на больших расстояниях от места промышленного выброса.

Охрана природы :
- создание очистных сооружений и правовая защита атмосферы;
- известкование водоёмов и лесов;
в водоемы, пострадавшие от кислотных дождей, новую жизнь могут вдохнуть небольшие количества фосфатных удобрений; они помогают планктону усваивать нитраты, что ведет к снижению кислотности воды. Использование фосфата дешевле, чем извести, кроме того, фосфат оказывает меньшее воздействие на химию воды.
- для защиты памятников культуры использование покрытий из силиконов или производных эфиров кремниевой кислоты;
- использование экологически чистых энергетических ресурсов (солнечная энергия, ветер, морские приливы).





































