
Классификация и свойства оксидов

Классы неорганических соединений
Оксиды
Кислоты
Соли
Основания

оксиды
Бинарные соединения, состоящие из двух элементов, одним из которых является кислород

Классификация оксидов
Солеобразующие
Несолеобразующие
Это оксиды, которые взаимодействуют с кислотами или со щелочами с образованием солей и воды: N 2 O 5 , CO 2 , CaO, Na 2 O
Это оксиды, которые не взаимодействуют ни с кислотами, ни с основаниями и не образуют солей. Оксиды образованы атомами неметаллов:
CO, NO, N 2 O, SiO 2

Классификация оксидов
Кислотные
Основные
Амфотерные
+ Н 2 О = основания
и кислоты
+ Н 2 О = основания
+ Н 2 О = кислоты
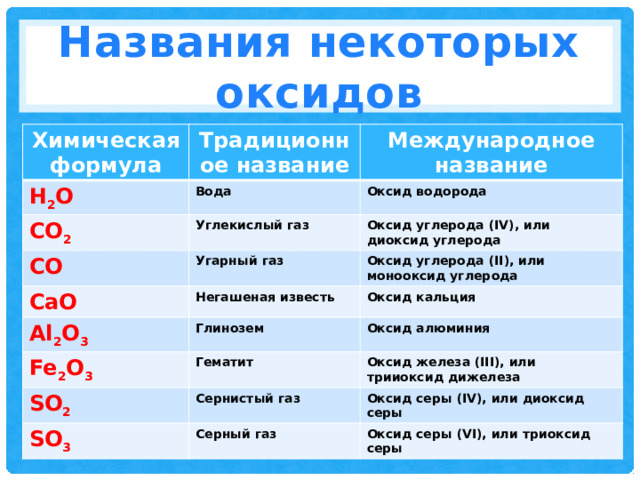
Названия некоторых оксидов
Химическая формула
Традиционное название
Н 2 О
Международное название
Вода
CO 2
Углекислый газ
Оксид водорода
CO
CaO
Оксид углерода (IV), или диоксид углерода
Угарный газ
Негашеная известь
Оксид углерода (II), или монооксид углерода
Al 2 O 3
Оксид кальция
Глинозем
Fe 2 O 3
Гематит
Оксид алюминия
SO 2
Оксид железа (III), или трииоксид дижелеза
Сернистый газ
SO 3
Серный газ
Оксид серы (IV), или диоксид серы
Оксид серы (VI), или триоксид серы

Структурные формулы оксидов
SO 2
Al 2 O 3
К 2 O
О
К
О
О
Al
О
О
S
К
Al
О

Получение оксидов 1. Взаимодействие простых веществ с кислородом:
С + O 2 = CO 2
Cu + O 2 = CuO
2
2
Ca + O 2 = CaO
2
2

Получение оксидов 2. Горение сложных веществ:
CH 4 + O 2 = CO 2 + H 2 O
2
2
Метан

Получение оксидов 3. Окисление оксидов:
FeO + O 2 = Fe 2 O 3
2
4
CO + O 2 = CO 2
2
2

Получение оксидов 4. Разложение нерастворимых оснований при нагревании:
Mg(OH) 2 = MgO + H 2 O
Fe(OH) 3 = Fe 2 O 3 + H 2 O
2
3

Получение оксидов 5. Разложение солей:
CaCO 3 = CaO + CO 2
CaSO 4 = CaO + SO 3

Агрегатное состояние оксидов:
Немолекулярное строение
Молекулярное строение
(твердые)
(жидкие или газообразные)

Взаимодействие оксидов с водой
Активно взаимодействуют с водой
Слабо взаимодействуют с водой

Химические свойства основных оксидов
1. Взаимодействие основных оксидов с водой и образованием щелочи:
Na 2 O + H 2 O = NaOH
2
CaO + H 2 O = Ca(OH) 2

Химические свойства основных оксидов
2. Взаимодействие основных оксидов с сильными кислотами с образованием соли и воды:
MgO + H 2 SO 4 = MgSO 4 + H 2 O
BaO + HCL = BaCL 2 + H 2 O
2

Химические свойства основных оксидов
3. Взаимодействие основных и кислотных оксидов между собой с образованием соли:
CaO + CO 2 = CaCO 3
BaO + SiO 2 = BaSiO 3

Химические свойства кислотных оксидов
1. Взаимодействие с водой с образование кислот:
SO 3 + H 2 O = H 2 SO 4
P 2 O 5 + H 2 O = H 3 PO 4
2
3
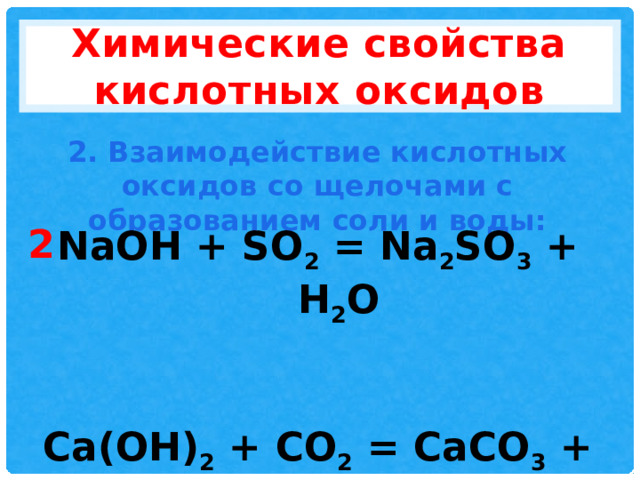
Химические свойства кислотных оксидов
2. Взаимодействие кислотных оксидов со щелочами с образованием соли и воды:
2
NaOH + SO 2 = Na 2 SO 3 + H 2 O
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O

Химические свойства кислотных оксидов
3. Взаимодействие кислотных оксидов с основными оксидами с образованием соли:
SiO 2 + CaO = CaSiO 3

Характерные химические свойства оксидов
+
=
Вода
Щелочь
Основной
оксид
+
Сильная
Вода
=
Соль
кислота
+
Соль
+
+
=
Вода
Кислота
Кислотный
оксид
+
+
Щелочь
Соль
Вода
=

Химические свойства амфотерных оксидов
Основные свойства
ZnO + H 2 SO 4 = ZnSO 4 + H 2 O
Кислотные свойства
ZnO + NaOH = Na 2 ZnO 2 + H 2 O
2
Цинкат
натрия

Характерны химические свойства амфотерных оксидов
=
Амфотерный
оксид
+
+
Сильная кислота
Соль
Вода
+
=
Щелочь
Соль
+
Вода

Домашнее задание
- § 44, 45 прочитать;
- Стр. 116 № 5-10









































