Просмотр содержимого документа
«Презентация по теме: Строение электронной оболочки атомов»

Электроны в атоме. Орбитали.

Электронная оболочка (энергетический уровень)
- это совокупность электронов, близких по значению энергии.
Число электронных оболочек у атома химического элемента равно номеру периода (n) , в котором он находится.
Максимальное число электронов на уровне (N) = 2n 2 .

1 период - одна оболочка
)
Максимум 2*1 2 = 2 e -
2 период - две оболочки
Максимум 2*2 2 = 8 e -
3 период - три оболочки
Максимум 2*3 2 = 18 e -
4 период - четыре оболочки
Максимум 2*4 2 = 32 e -
+Z
)
)
+Z
)
)
)
+Z
)
)
)
)
+Z

Число электронов на внешней оболочке определяется номером группы , в которой находится химический элемент ( не может быть больше 8 ).
)
)
+Z
I группа - один электрон
II группа - два электрона
1e -
)
)
+Z
2e -
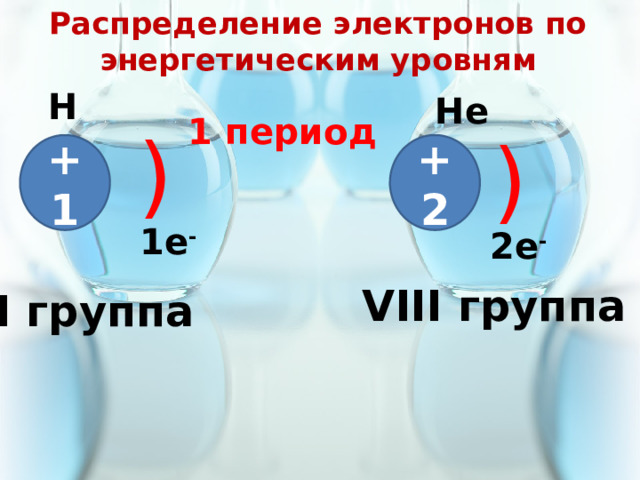
Распределение электронов по энергетическим уровням
Н
Не
1 период
)
)
+1
+2
1e -
2e -
VIII группа
I группа
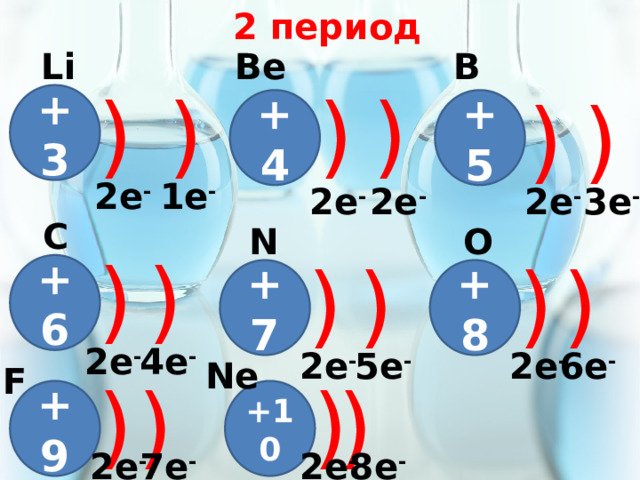
2 период
B
Li
Bе
)
)
)
)
)
)
+3
+4
+5
1e -
2e -
2e -
2e -
3e -
2e -
C
O
N
)
)
)
)
)
)
+6
+7
+8
4e -
2e -
5e -
2e -
2e -
6e -
Ne
F
)
)
)
)
+10
+9
2e -
7e -
2e -
8e -

Энергетические уровни
Завершённые
Незавершённые
8 электронов - внешний уровень.
Максимальное число электронов - любой другой уровень.
Не максимальное число электронов

Электронная орбиталь (энергетический подуровень)
- это область пространства вокруг ядра атома химического элемента в которой наиболее вероятно находится электрон .
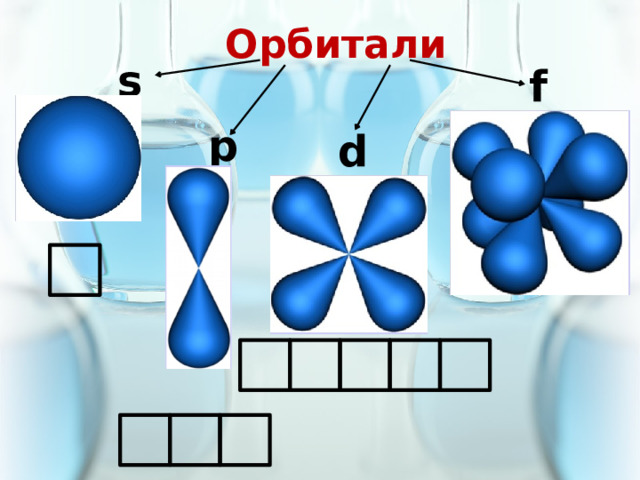
Орбитали
s
f
p
d
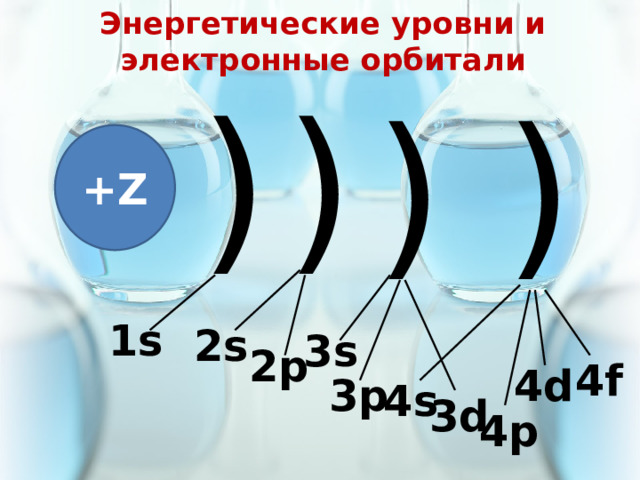
Энергетические уровни и электронные орбитали
)
)
)
)
+Z
1s
2s
3s
2p
4f
4d
3p
4s
3d
4p

Распределение электронов по орбиталям
1. s -орбитали заполняются в первую очередь . Затем заполняются р- орбитали
2. На каждой орбитали (клеточке) может находиться не более 2 электронов .
3. Электрон обозначается стрелочками
или
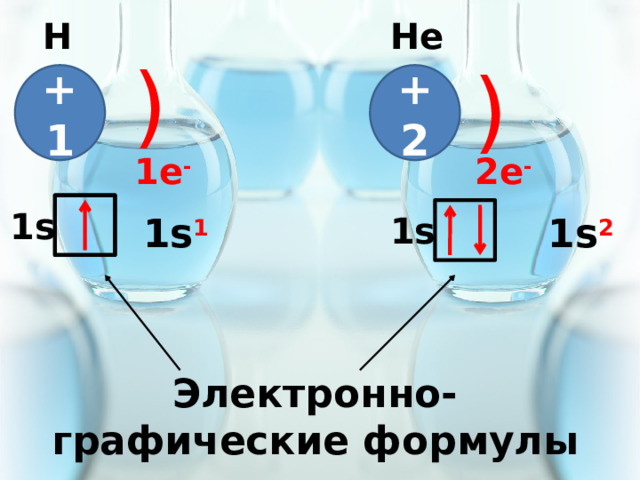
Н
He
)
)
+1
+2
2e -
1e -
1s
1s
1s 1
1s 2
Электронно-графические формулы
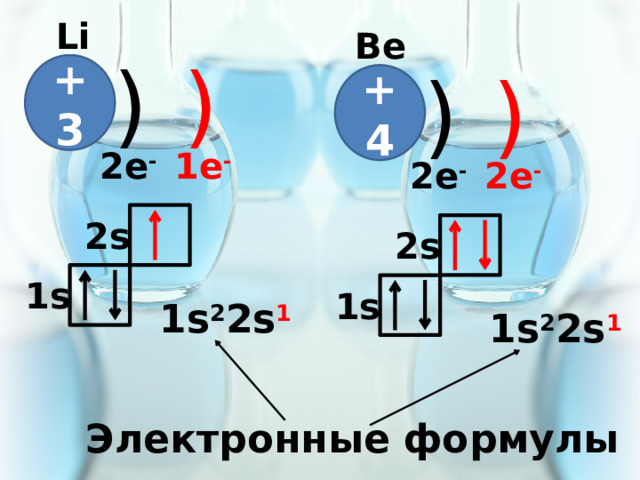
Li
Be
)
)
)
)
+3
+4
1e -
2e -
2e -
2e -
2s
2s
1s
1s
1s 2 2s 1
1s 2 2s 1
Электронные формулы
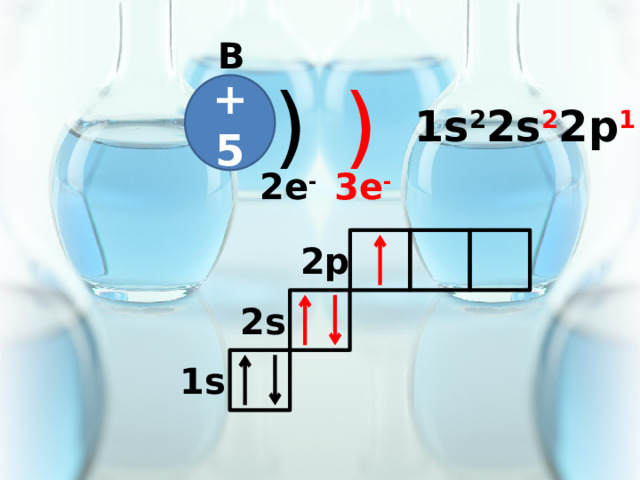
B
)
)
+5
1s 2 2s 2 2p 1
3e -
2e -
2p
2s
1s
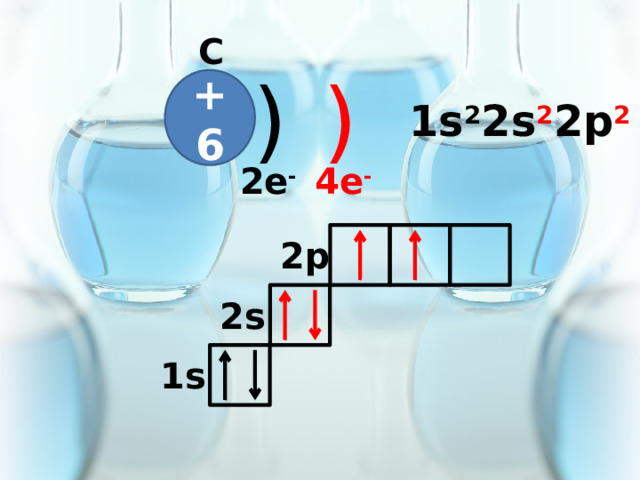
C
)
)
+6
1s 2 2s 2 2p 2
4e -
2e -
2p
2s
1s
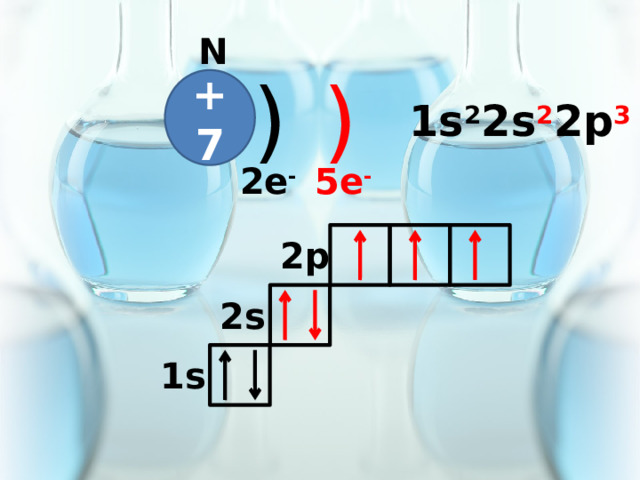
N
)
)
+7
1s 2 2s 2 2p 3
2e -
5e -
2p
2s
1s
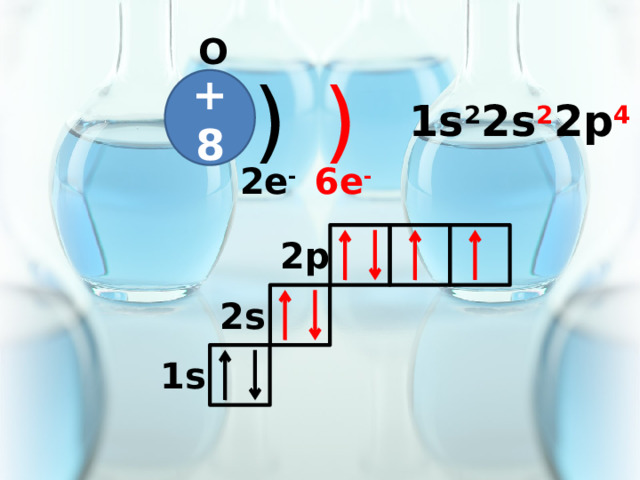
O
)
)
+8
1s 2 2s 2 2p 4
6e -
2e -
2p
2s
1s
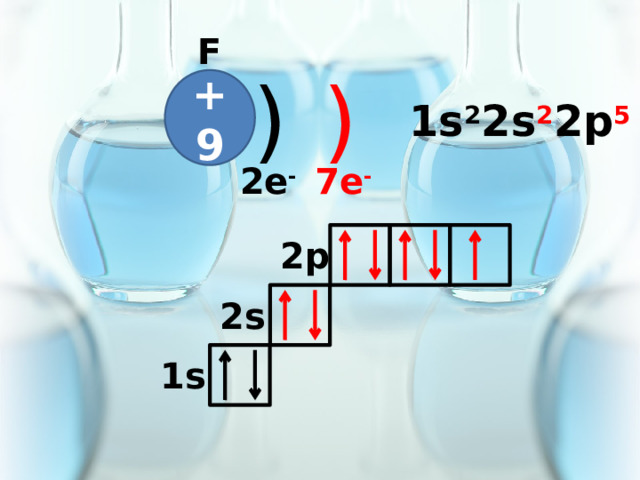
F
)
)
+9
1s 2 2s 2 2p 5
7e -
2e -
2p
2s
1s
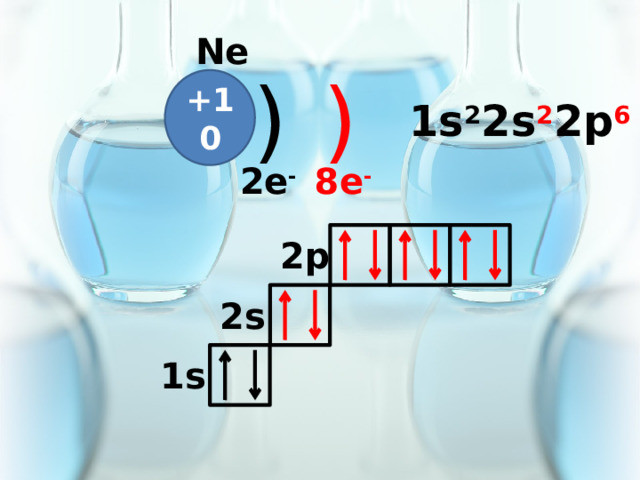
Ne
)
)
+10
1s 2 2s 2 2p 6
8e -
2e -
2p
2s
1s

Домашнее задание
- §42, ответить на вопросы 1-4 стр. 60



































