
Тема урока «Состав, строение и функции белков»
Уколова И. С.
Учитель биологии

Элементарный состав белков
- С (углерод) – 50-55%;
- О (кислород) – 21-24%;
- N (азот) – 15-17% (≈ 16% );
- Н (водород) – 6-8%;
- S (сера)– 0-2%.
Азот - это постоянный компонент белков и по его количеству можно определить содержание белка в тканях.
Содержание белков в органах человека составляет в среднем 18-20% сырой массы ткани.
В пересчете на сухой остаток - мышцы – до 80%, сердце – 60%, печень – 72%, легкие , селезенка – 82 – 84%.
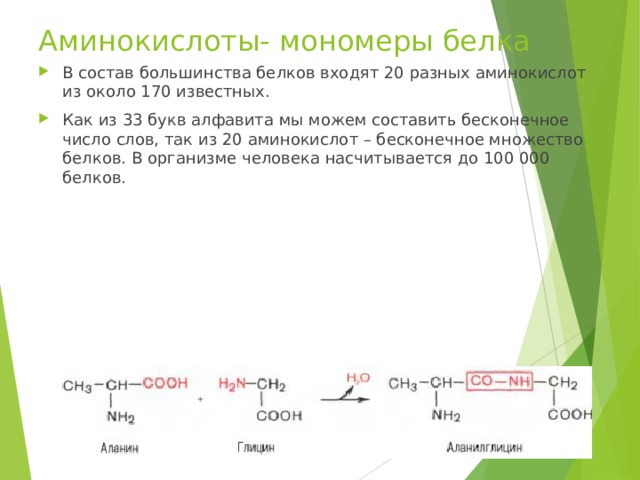
Аминокислоты- мономеры белка
- В состав большинства белков входят 20 разных аминокислот из около 170 известных.
- Как из 33 букв алфавита мы можем составить бесконечное число слов, так из 20 аминокислот – бесконечное множество белков. В организме человека насчитывается до 100 000 белков.
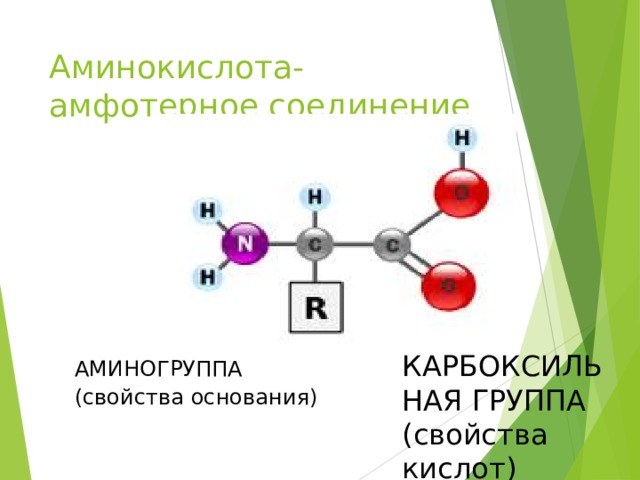
Аминокислота- амфотерное соединение
КАРБОКСИЛЬНАЯ ГРУППА
(свойства кислот)
АМИНОГРУППА
(свойства основания)

Аминокислоты
Заменимые
Незаменимые
Незаменимыми для взрослого здорового человека являются 8 аминокислот: валин, изолейцин, лейцин, лизин, метионин, треони́н, триптофан и фенилалани́н.
Для детей незаменимыми также являются аргинин и гистидин.
Не могут быть синтезированы в организме.
Заменимые аминокислоты могут синтезироваться в организме.
Потребность организма осуществляется за счет поступления белков пищи.
К заменимым аминокислотам относятся аланин, аспарагин, аспарагиновая кислота, глицин, глютамин, глютаминовая кислота, тирозин, цистеин, цистин и др.

Содержание незаменимых аминокислот
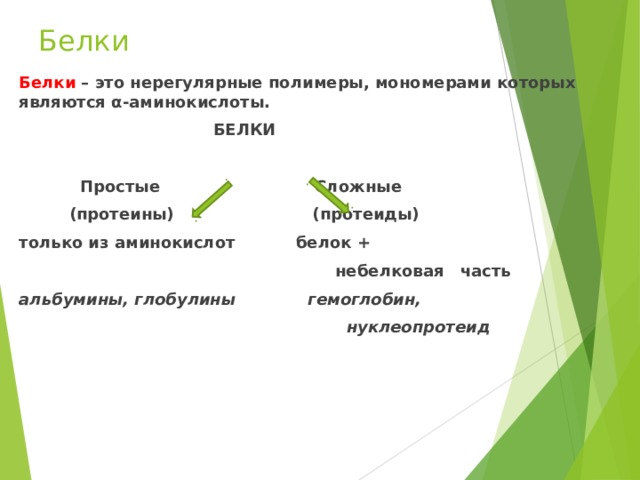
Белки
Белки – это нерегулярные полимеры, мономерами которых являются α -аминокислоты.
БЕЛКИ
Простые Сложные
(протеины) (протеиды)
только из аминокислот белок +
небелковая часть
альбумины, глобулины гемоглобин,
нуклеопротеид
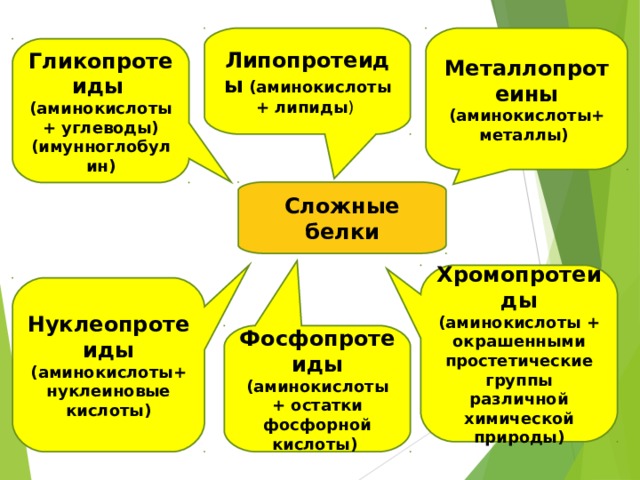
Липопротеиды (аминокислоты + липиды )
Металлопротеины (аминокислоты+ металлы)
Гликопротеиды (аминокислоты+ углеводы)
(имунноглобулин)
Сложные белки
Хромопротеиды (аминокислоты + окрашенными простетические группы различной химической природы)
Нуклеопротеиды (аминокислоты+ нуклеиновые кислоты)
Фосфопротеиды (аминокислоты + остатки фосфорной кислоты)

По общему типу строения белки можно разбить на три группы:
Мембранные белки —
Глобулярные белки .
Фибриллярные белки.
Образуют микрофиламенты, микротрубочки, фибриллы, поддерживают структуру клеток и тканей.
Например кератин и коллаген.
выполняют функцию рецепторов, а также обеспечивают трансмембранный транспорт различных веществ.
Например, глобулярный белок, триозофосфатизомераза.

Денатурация белка
Денатурация белков – это потеря белками их биологических свойств (каталитических, транспортных и т.д.) вследствие изменения структуры белковой молекулы.
Денатурацию вызывают:
- физические факторы (высокая температура, ионизирующее излучение),
- химические факторы (концентрированные кислоты, щелочи, реакционно-активные соединения, тяжелые металлы ).

Денатурация белка
Обратимая (ренатурация)
Необратимая
после устранения воздействия денатурирующего агента белок восстанавливает свою активность.
происходит необратимое нарушение первичной структуры белка
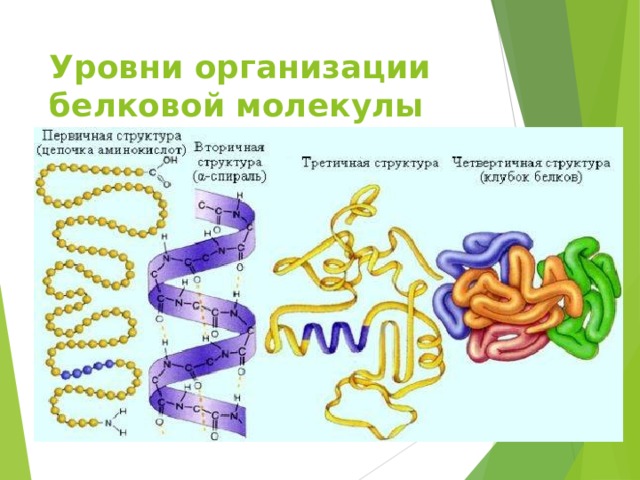
Уровни организации белковой молекулы
Заполни таблицу «Строение белка»
Название структуры белка
Особенности
Химические связи
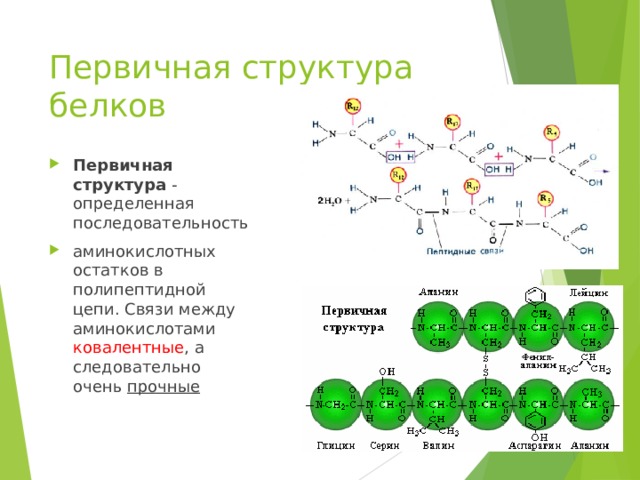
Первичная структура белков
- Первичная структура - определенная последовательность
- аминокислотных остатков в полипептидной цепи. Связи между аминокислотами ковалентные , а следовательно очень прочные
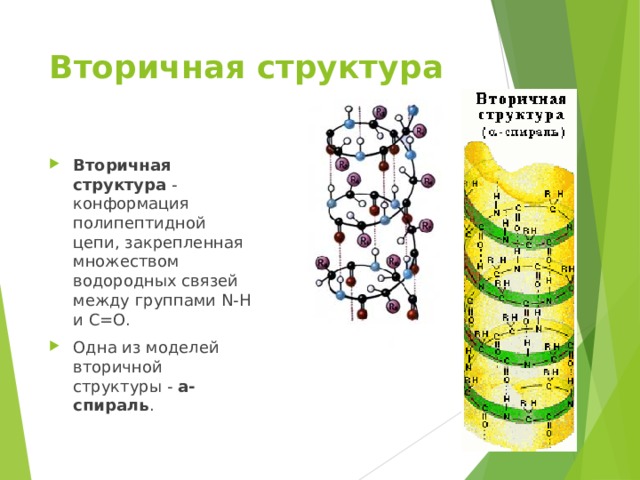
Вторичная структура
- Вторичная структура - конформация полипептидной цепи, закрепленная множеством водородных связей между группами N-H и С=О.
- Одна из моделей вторичной структуры - a-спираль .

Вторичная структура
α–спираль
Β - спираль
α–спираль открыта в 30-ых годах ХХ века Л.Полингом.
α–спираль стабилизируется в пространстве благодаря образованию дисульфидных и большого количества водородных связей между аминокислотами полипептидной цепи оси спирали.
Например – кератин.
β – спираль (складчатая)– две параллельные полипептидные цепи, соединены между собой с помощью водородных связей,перпендикулярно цепям.
Подобную структуру имеют фибриллярные белки (коллаген, фиброин (белок шелка)).

Третичная структура
Третичная структура - форма закрученной спирали в пространстве.
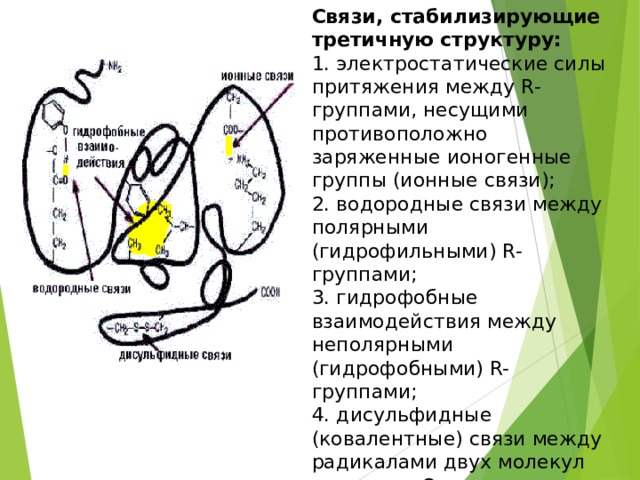
Связи, стабилизирующие третичную структуру:
1. электростатические силы притяжения между R-группами, несущими
противоположно заряженные ионогенные группы (ионные связи);
2. водородные связи между полярными (гидрофильными) R-группами;
3. гидрофобные взаимодействия между неполярными (гидрофобными) R-
группами;
4. дисульфидные (ковалентные) связи между радикалами двух молекул цистеина. Они повышают стабильность третичной структуры, но в ряде белков они могут вообще отсутствовать.

Четверичная структура
В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул.
- Четвертичная структура - агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей.

Проверь себя
название структуры
особенности
первичная
химические связи
цепочка аминокислот
вторичная
пептидные связи (ковалентные, прочные)
цепочка закручена в спираль
третичная
водородные (непрочные)
дальнейшее "сворачивание" молекулы, образование глобулы, специфичной для каждого белка.
четвертичная (есть не у всех белков)
водородные и ковалентные связи между удаленными участками цепи
(дисульфидные),
гидрофобные)
комплекс из нескольких белковых макромолекул

Функции белков в организме
Белки — необходимые компоненты всех живых организмов, они участвуют в большинстве жизненных процессов клетки.
Белки осуществляют обмен веществ и энергетические превращения.
Белки входят в состав клеточных структур — органелл, секретируются во внеклеточное пространство для обмена сигналами между клетками, гидролиза пищи и образования межклеточного вещества.
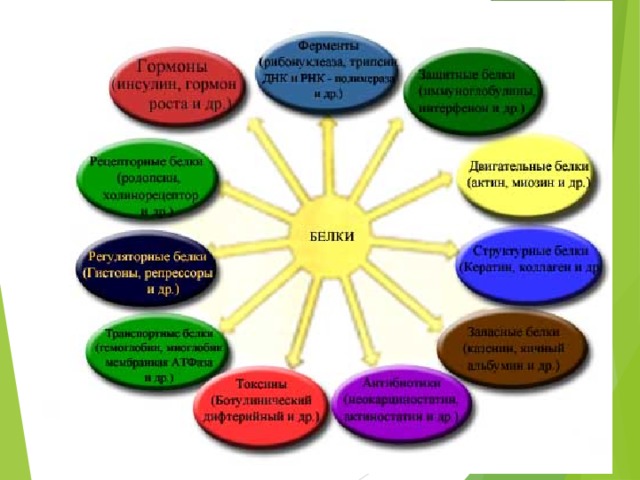
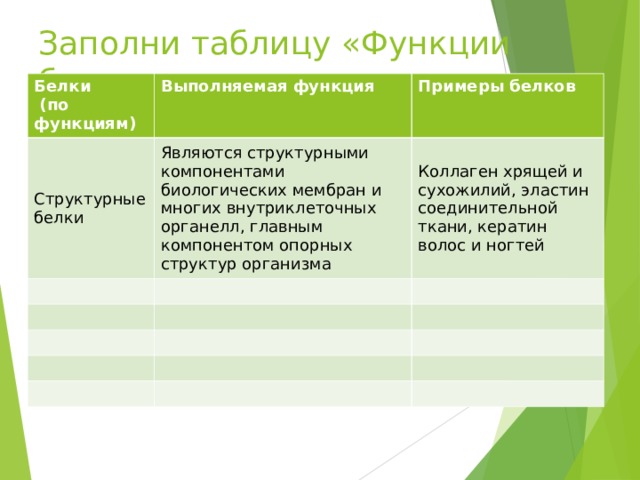
Заполни таблицу «Функции белка»
Белки
(по функциям)
Выполняемая функция
Структурные белки
Примеры белков
Являются структурными компонентами биологических мембран и многих внутриклеточных органелл, главным компонентом опорных структур организма
Коллаген хрящей и сухожилий, эластин соединительной ткани, кератин волос и ногтей

Структурная функция
- Структурные белки цитоскелета, как своего рода арматура, придают форму клеткам и многим органоидам и участвуют в изменении формы клеток.
- Коллаген и эластин — основные компоненты межклеточного вещества соединительной ткани (например, хряща), а из другого структурного белка кератина состоят волосы, ногти, перья птиц и некоторые раковины.
Микротрубочки из эндотелиальных клеток крупного рогатого скота

Транспортная функция
Транспортный белок гемоглобин переносит кислород из лёгких к остальным тканям и углекислый газ от тканей к лёгким, а также гомологичные ему белки, найденные во всех царствах живых организмов.
Мембранные белки участвуют в транспорте малых молекул через мембрану клетки, изменяя её проницаемость (белки-каналы и белки-переносчики).
Белки-каналы содержат внутренние, заполненные водой поры, которые позволяют ионам (через ионные каналы) или молекулам воды (через белки-аквапорины) перемещаться через мембрану.
Белки-переносчики связывают, подобно ферментам, каждую переносимую молекулу или ион и, в отличие от каналов, могут осуществлять активный транспорт с использованием энергии АТФ.

Регуляторная функция
- Многие процессы внутри клеток регулируются белковыми молекулами, которые регулируют транскрипцию, трансляцию, сплайсинг, а также активность других белков.
- Регуляторную функцию белки осуществляют либо за счёт ферментативной активности (например, протеинкиназы), либо за счёт специфического связывания с молекулами ферментов.
- Схема строения биологической мембраны:
- 1 — углеводные фрагменты гликопротеидов;
- 2 — липидный бислой;
- 3 — интегральный белок;
- 4 — «головки» фосфолипидов;
- 5 — периферический белок;
- 6 — холестерин;
- 7 — жирнокислотные «хвосты» фосфолипидов.

Защитная функция
- Физическая защита.
- В ней принимает участие коллаген — белок, образующий основу межклеточного вещества соединительных тканей (в том числе костей, хряща, сухожилий и глубоких слоев кожи (дермы);
- кератин , составляющий основу роговых щитков, волос, перьев, рогов и др. производных эпидермиса.
- Фибриногены и тромбины, участвуют в свёртывании крови.
Защитная функция
- Химическая защита. Связывание токсинов белковыми молекулами может обеспечивать их детоксикацию.
- Особенно важную роль в детоксикации у человека играют ферменты печени, расщепляющие яды или переводящие их в растворимую форму, что способствует их быстрому выведению из организма.
- Печень- «чистит» кровь, то есть перестраивает токсин так, чтобы он мог выйти из организма.

Защитная функция
Иммунная защита.
- Белки, входящие в состав крови и других биологических жидкостей, участвуют в защитном ответе организма как на повреждение, так и на атаку патогенов.
- Иммуноглобулины нейтрализуют бактерии, вирусы или чужеродные белки.
- Антитела, входящие в состав иммунной системы, присоединяются к чужеродным для данного организма веществам, антигенам и тем самым нейтрализуют их, направляя к местам уничтожения.
- Антитела могут секретироваться в межклеточное пространство или закрепляться в мембранах специализированных В-лимфоцитов, которые называются плазмоцитами .
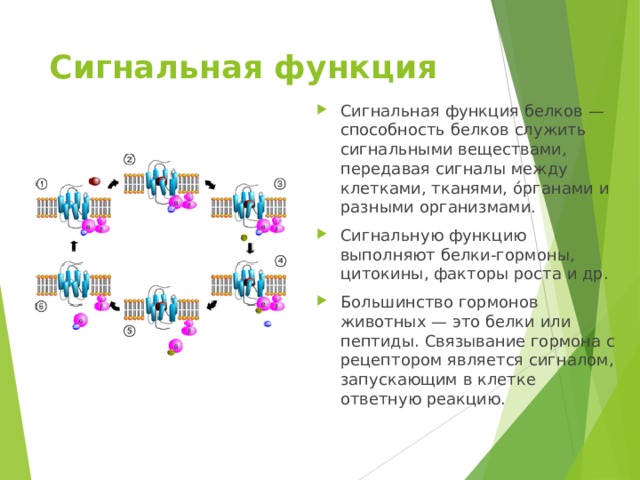
Сигнальная функция
- Сигнальная функция белков — способность белков служить сигнальными веществами, передавая сигналы между клетками, тканями, о́рганами и разными организмами.
- Сигнальную функцию выполняют белки-гормоны, цитокины, факторы роста и др.
- Большинство гормонов животных — это белки или пептиды. Связывание гормона с рецептором является сигналом, запускающим в клетке ответную реакцию.
- Цикл активации G-белка под действием рецептора.

Рецепторная функция
- Белковые рецепторы могут как находиться в цитоплазме, так и встраиваться в клеточную мембрану.
- Одна часть молекулы рецептора воспринимает сигнал, которым чаще всего служит химическое вещество, а в некоторых случаях — свет, механическое воздействие (например, растяжение) и другие стимулы.
- При воздействии сигнала на определённый участок молекулы белок-рецептор происходят её конформационные изменения. В результате меняется конформация другой части молекулы, осуществляющей передачу сигнала на другие клеточные компоненты.

Каталитическая функция
- Наиболее хорошо известная роль белков в организме — катализ различных химических реакций.
- Ферменты — группа белков, обладающая специфическими каталитическими свойствами, то есть каждый фермент катализирует одну или несколько сходных реакций.
- Ферменты катализируют реакции расщепления сложных молекул (катаболизм) и их синтеза (анаболизм), а также репликации и репарации ДНК и матричного синтеза РНК.
- Известно несколько тысяч ферментов; среди них такие, как, например, пепсин, расщепляют белки в процессе пищеварения.

Запасная (резервная) функция белков
Резервные белки запасаются в качестве источника энергии и вещества в семенах растений и яйцеклетках животных; белки третичных оболочек яйца (овальбумины) и основной белок молока (казеин) также выполняют, главным образом, питательную функцию.
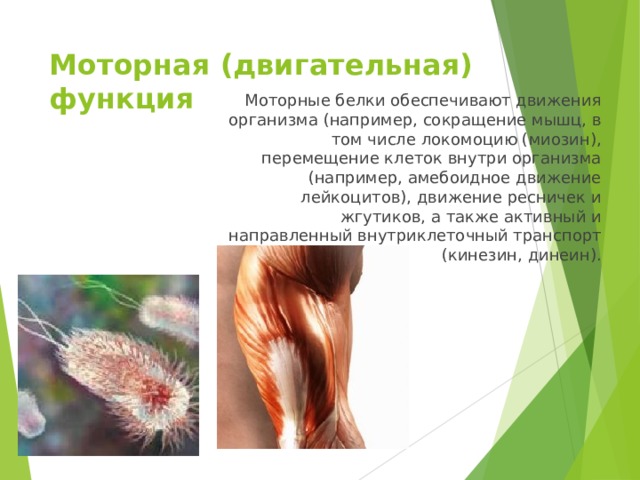
Моторная (двигательная) функция
Моторные белки обеспечивают движения организма (например, сокращение мышц, в том числе локомоцию (миозин), перемещение клеток внутри организма (например, амебоидное движение лейкоцитов), движение ресничек и жгутиков, а также активный и направленный внутриклеточный транспорт (кинезин, динеин).

Микрофиламенты
- Микрофиламенты состоят из белка актина. Они образуют сплошную сеть под наружной мембраной клетки, придавая ей упругость и прочность.
- Пучки микрофиламентов образуются на переднем конце движущейся амебы, именно они выпячивают ложноножку (псевдоподию).

Микротрубочки
- Микротрубочки представляют собой трубчатые образования, состоящие из белка тубулина.
- По ним движутся органеллы от одного участка клетки к другому (другие белки прикрепляют органеллы к наружной стороне «трубы» и обеспечивают движение).
- Во время митоза они обеспечивают расхождение хромосом к полюсам клетки.

Энергетическая функция
- При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж.
- Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы.

Токсины (от греческого toxikоn — яд), вещества бактериального, растительного или животного происхождения, способные угнетать физиологические функции, что приводит к заболеванию или гибели животных и человека. По химической природе все токсины— белки или полипептиды.
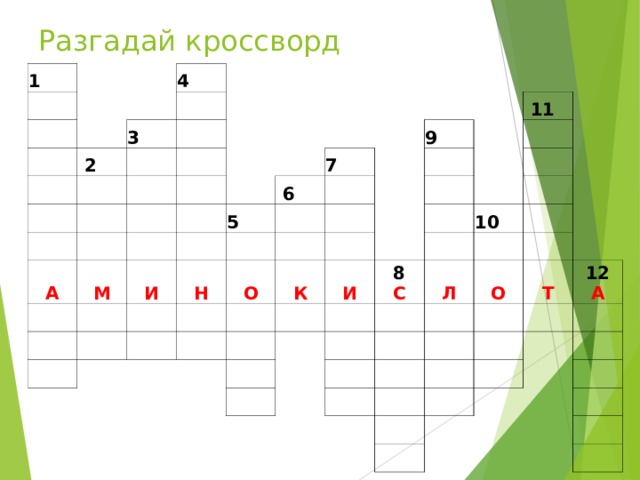
Разгадай кроссворд
1
4
2
3
А
М
7
5
И
6
Н
9
О
11
К
И
8
10
С
Л
О
Т
12
А

РЕШИ КРОССВОРД: 1.Изменение первичной структуры белка 2. Высокомолекулярные соединения. 3.Белки, состоящие только из аминокислот. 4. Соединение, сочетающее в себе признаки кислот и оснований. 5. Пространственная конфигурация представляющая третичную структуру белка. 6. Высокомолекулярные органические непериодические полимеры, состоящие из аминокислот. 7. Химические связи, соединяющие аминокислоты в первичной структуре белка. 8. Форма, образующая вторичную структуру белковой молекулы. 9.Транспортный белок, для которого характерна четвертичная структура. 10.Двигательный белок. 11. Белки, являющиеся биокатализаторами. 12. Белки на поверхности клетки или в растворе, по которым Т-лимфоциты различают свои клетки от чужих.
Поверь себя
Д
Е
Н
А
А
М
П
Т
П
Р
Ф
У
О
Р
О
Л
О
А
Т
И
Т
М
Е
Е
Ц
Р
Е
И
И
Г
Б
П
Н
Н
Е
Р
Л
Г
Я
Е
Л
Ы
Е
О
О
П
Ф
М
Е
Б
К
Т
Е
У
И
О
И
Р
Л
С
Д
М
Г
М
Л
Н
П
А
И
Е
Ы
И
О
О
Н
З
Р
Б
Е
Т
И
И
А
А
Ы
Н
Н
Л
Н
Ь
Т
И
Г
Е
Н

Составим опорный конспект по теме «Белки. Строение и функции белков»
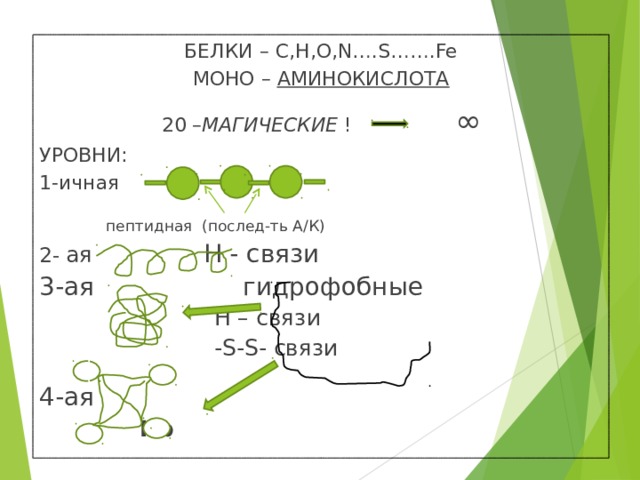
БЕЛКИ – C,H,O,N….S…….Fe
МОНО – АМИНОКИСЛОТА
20 – МАГИЧЕСКИЕ ! ∞
УРОВНИ:
1-ичная
пептидная (послед-ть А/К)
2- ая Н - связи
3-ая гидрофобные
Н – связи
-S-S- связи
4-ая
Hb
11

ДЕНАТУРАЦИЯ
1! 1
Функции:
1.Каталитическая (ферменты)
2. Защитная (иммуноглобулин)
3. Сигнальная(родопсин)
4. Транспортная (гемоглобин)
5.Структурная( коллаген, кератин)
6. Двигательная (актин, миозин)
7. Энергетическая (1гр.- 17,6 кДж)
8. Регуляторная (инсулин,гистоны)
9.Запасающая ( казеин)
необратимая
ренатурация



























































