Тема 1. Строение атома. Химическая связь
Понятие "Атом"
Атом — мельчайшая химически неделимая частица, из которой состоят вещества.
Термин «атом» предложил Дж. Дальтон в начале 19 века. Он назвал атомами мельчайшие частицы, не изменяющиеся в химических реакциях
На сегодняшний день известно 118 видов атомов. Более 90 из них существуют в природе, а остальные получены искусственно.
Радиусы атомов составляют 0,046–0,25 нм (1 нм = 10−9 м). Самый маленький — атом гелия, а самый большой — франция.
До конца 19-го столетия атомы считали неделимыми частицами. Но учёные доказали, что атом имеет сложное строение.

Модели строения атома
1904 г.- работа Дж.Томсона «О структуре атома».Его модель получила название «сливового пудинга». Но она так и осталась гипотезой.
1911 г.- модель атома Э.Резерфорда под названием планетарная модель атома. Самая верная модель, которой мы пользуемся и сейчас. Так же существовали другие модели строения атома.
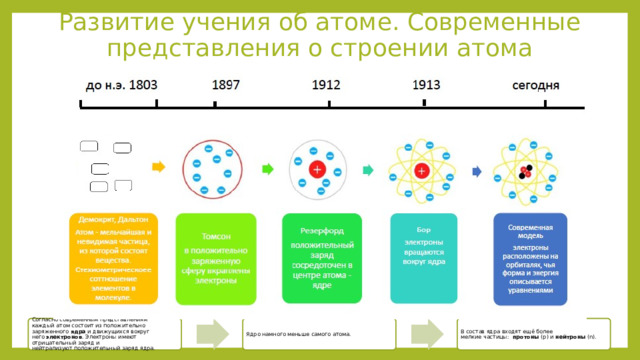
Развитие учения об атоме. Современные представления о строении атома
Согласно современным представлениям каждый атом состоит из положительно заряженного ядра и движущихся вокруг него электронов . Электроны имеют отрицательный заряд и нейтрализуют положительный заряд ядра.
Ядро намного меньше самого атома.
В состав ядра входят ещё более мелкие частицы: протоны (p) и нейтроны (n).
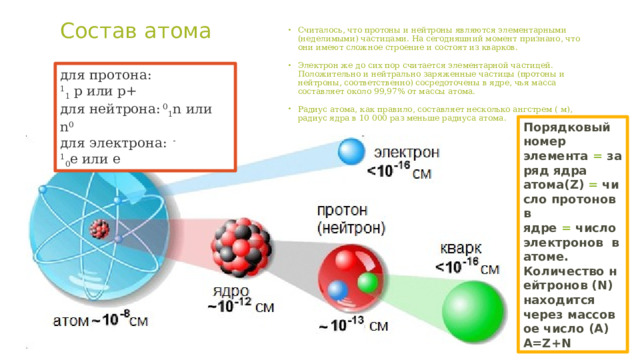
Состав атома
- Считалось, что протоны и нейтроны являются элементарными (неделимыми) частицами. На сегодняшний момент признано, что они имеют сложное строение и состоят из кварков.
- Электрон же до сих пор считается элементарной частицей. Положительно и нейтрально заряженные частицы (протоны и нейтроны, соответственно) сосредоточены в ядре, чья масса составляет около 99,97% от массы атома.
- Радиус атома, как правило, составляет несколько ангстрем ( м), радиус ядра в 10 000 раз меньше радиуса атома.
для протона: 1 1 p или p+
для нейтрона: 0 1 n или n 0
для электрона: -1 0 e или e
Порядковый номер элемента = заряд ядра атома(Z) = число протонов в ядре = число электронов в атоме.
Количество нейтронов (N) находится через массовое число (A)
А=Z+N

Изотопы
- Количество нейтронов в ядре атома называется его изотопическим числом и обозначается N.
- Если атом содержит одинаковое число протонов , т.е. обладает одинаковым зарядом, но разное количество нейтронов , то он будет иметь разную массу . Такие атомы называются изотопами .
- Некоторые изотопы имеют собственное название. Изотоп водорода 1 Н – протий, 2 Н – дейтерий, 3 Н – тритий.
- Также можно встретить изотопы кислорода 16 О, 17 О, 18 О, которые встречаются в природе.

Изобары
- Нуклиды с одинаковым массовым числом называются изобары. Изобар; др.-греч. ἴσος (isos) — «одинаковый» + βάρος (baros) — «вес»). . Количество и протонов и нейтронов в изобарах разное.

Свойства атома
Атом — мельчайшая химически неделимая электронейтральная частица вещества, состоящая из положительного ядра и отрицательных электронов.
В химических реакциях атомы не изменяются, а только перегруппировываются — объединяются в новых комбинациях.
Атомы не изменяются в химических реакциях, но существуют ядерные реакции, при протекании которых их строение изменяется.
Молекула кислорода O 2
Атомы редко встречаются в изолированном виде. Обычно они соединяются друг с другом в молекулы или более крупные структуры. Число вариантов соединения атомов практически бесконечно, и их относительно небольшое число приводит к образованию огромного количества разнообразных веществ.
В молекулах атомы соединены друг с другом химическими связями.
Молекула озона O 3

Строение электронных оболочек
Электрон — главная элементарная частица для химии, т.к. благодаря обмену электронами могут образовываться новые химические соединения.
Электрон —одновременно является и частицей, и волной, т.е. имеет двойственную природу.
Все химические свойства веществ, способность вступать в химические реакции, определяются строением электронных оболочек атомов.
Электрон проявляет свойства частицы (из-за малой массы), с другой стороны, электрон движется с высокой скоростью и проявляет волновые свойства, он находится не в одной конкретной точке, а образует « электронное облако ».
Дуализм электрона подтверждается экспериментально.
Для потока электронов, как и для световых волн, характерны явления интерференции (наложения) и дифракции (огибание препятствия).

Атомная орбиталь
На каждой орбитали могут максимально размещаться два электрона, обладающие равной энергией, но отличающиеся особым свойством, спином .
Электронные орбитали имеют определенную форму и энергию.
Ряд орбиталей, обладающих равной или близкой энергией, образует энергетический уровень (слой).
Номер уровня обозначают числом ( n = 1, 2, 3… ) или заглавной латинской буквой ( K, L, M и дальше по алфавиту). Различают первый (n = 1 или K), второй (n = 2 или L), третий (n = 3 или M) и т. д. Уровень с номером n включает ровно n 2 орбиталей, на которых может разместиться максимально 2n 2 электронов. Номер энергетического уровня называют главным квантовым числом .
На первом энергетическом уровне могут максимально находиться 2 электрона, на втором — 8, на третьем — 18 и т. д.
Атомная орбиталь — это область пространства, в которой вероятность нахождения электрона максимальна.
Графическое изображение орбитали
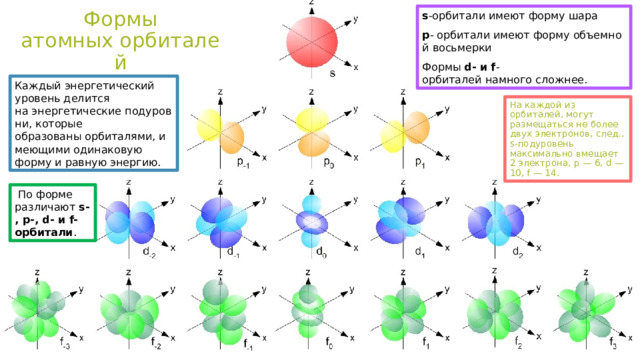
Формы атомных орбиталей
s -орбитали имеют форму шара
p - орбитали имеют форму объемной восьмерки
Формы d- и f -орбиталей намного сложнее.
Каждый энергетический уровень делится на энергетические подуровни, которые образованы орбиталями, имеющими одинаковую форму и равную энергию.
На каждой из орбиталей, могут размещаться не более двух электронов, след., s-подуровень максимально вмещает 2 электрона, p — 6, d — 10, f — 14.
По форме различают s-, p-, d- и f-орбитали .
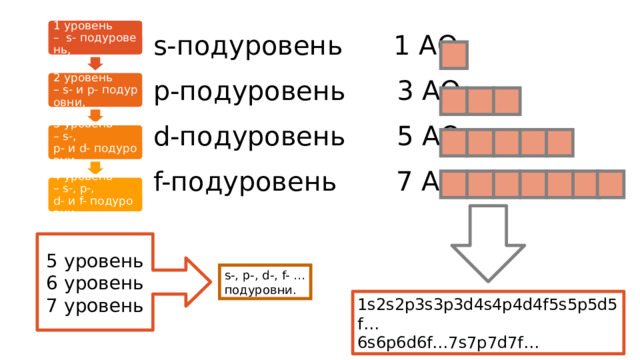
1 уровень – s- подуровень,
s-подуровень 1 АО
р-подуровень 3 АО
d-подуровень 5 АО
f-подуровень 7 АО
2 уровень – s- и p- подуровни,
3 уровень – s-, p- и d- подуровни,
4 уровень – s-, p-, d- и f- подуровни
5 уровень
6 уровень
7 уровень
s-, p-, d-, f- … подуровни.
1s2s2p3s3p3d4s4p4d4f5s5p5d5f…
6s6p6d6f…7s7p7d7f…

Примеры моделей строения атомов
Строение атома кислорода
Строение атома водорода

Валентные возможности атомов химических элементов
- Валентность атома химического элемента определяется в первую очередь числом неспаренных электронов , принимающих участие в образовании химической связи.
- Валентные электроны атомов элементов главных подгрупп расположены на s- и p- орбиталях внешнего электронного уровня.
- У элементов побочных подгрупп, кроме лантаноидов и актиноидов, валентные электроны расположены на s-орбитали внешнего и d-орбиталях предвнешнего слоёв. Что бы верно оценить валентные возможности атомов химических элементов, нужно рассмотреть распределение электронов в соответствии с принципом Паули и правилом Хунда для невозбужденного состояния атома и для возбужденного.
- Общий вывод : валентные возможности атомов химических элементов определяются:1)числом неспаренных электронов;2)наличием свободных орбиталей;3)наличием неподеленных пар электронов.
Принципы заполнения электронных оболочек
- Принцип минимальной энергии:
- принцип Паули правило Хунда правило Клечковского
- принцип Паули
- правило Хунда
- правило Клечковского

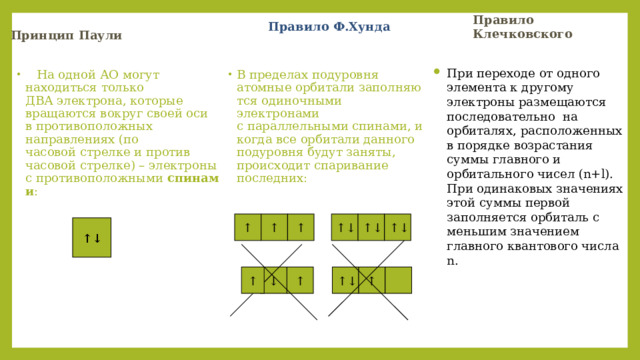
Правило Клечковского
Принцип Паули
Правило Ф.Хунда
- При переходе от одного элемента к другому электроны размещаются последовательно на орбиталях, расположенных в порядке возрастания суммы главного и орбитального чисел (n+l). При одинаковых значениях этой суммы первой заполняется орбиталь с меньшим значением главного квантового числа n.
- В пределах подуровня атомные орбитали заполняются одиночными электронами с параллельными спинами, и когда все орбитали данного подуровня будут заняты, происходит спаривание последних:
- На одной АО могут находиться только ДВА электрона, которые вращаются вокруг своей оси в противоположных направлениях (по часовой стрелке и против часовой стрелке) – электроны с противоположными спинами :
↑
↑↓
↑↓
↑↓
↑
↑
↑↓
↑
↓
↑
↑
↑↓

Принцип наименьшей энергии
Электроны в первую очередь стремятся занять энергетически выгодное положение в электронной оболочке с наименьшей энергии .
Провал электрона - в атомах некоторых элементов электрон с s -подуровня внешнего энергетического уровня переходит на d -подуровень предвнешнего энергетического уровня. Идёт выигрыш в энергии. Атом считается симметричным, т.е. либо большинство электронов становятся неспаренными либо спаренными

Квантовые числа
- Главное квантовое число - n.
- Главное квантовое число - n - определяет энергетический уровень электрона, удалённость энергетического уровня от ядра и размер электронного облака. Главное квантовое число принимает любые целочисленные значения, начиная с n=1 (n=1,2,3,…) и соответствует номеру периода.

Орбитальное квантовое число - l
Определяет геометрическую форму атомной орбитали. Орбитальное квантовое число принимает любые целочисленные значения, начиная с l=0 (l=0,1,2,3,…n-1). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь особой формы. “Набор” таких орбиталей с одинаковыми значениями главного квантового числа называется энергетическим уровнем. Каждому значению орбитального квантового числа соответствует орбиталь особой формы.
Значение орбитального квантового числа - l.
l=0
Типы орбитали.
s-орбиталь
l=1
Количество типов орбитали.
p-орбитали
l=2
1
3
d-орбитали
l=3
f-орбитали
5
7

Магнитное квантовое число - ml
- Магнитное квантовое число - ml - определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Магнитное квантовое число принимает любые целочисленные значения от -l до +l, включая 0. Это означает, что для каждой формы орбитали существует 2l+1 энергетически равноценных ориентаций в пространстве - орбиталей.
- Для s-орбитали:
- l=0, m=0 - одна равноценная ориентация в пространстве (одна орбиталь).
- Для p-орбитали:
- l=1, m=-1,0,+1 - три равноценные ориентации в пространстве (три орбитали).
- Для d-орбитали:
- l=2, m=-2,-1,0,1,2 - пять равноценных ориентаций в пространстве (пять орбиталей).
- Для f-орбитали:
- l=3, m=-3,-2,-1,0,1,2,3 - семь равноценных ориентаций в пространстве (семь орбиталей).

Спиновое квантовое число - ms
Спиновое квантовое число - ms - определяет магнитный момент, возникающий при вращении электрона вокруг своей оси. Спиновое квантовое число может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона - спинам.
1. Сколько и какие значения может принимать магнитное квантовое число при орбитальном числе l = 0, 1, 2 и 3? Какие элементы в периодической системе называют s-, р-, d- и f-элементами? Приведите примеры.
2. Представьте электронные структуры Zn2+; S6+

Практика
1. Для элемента с электронной конфигурацией атома
1S2 2S2 2p6 3S2 3p3 1S2 2S2 2p6 3S2 3p5
Укажите:
- атомный номер элемента;
- номер периода и номер группы в периодической системе;
2. Составьте электронные формулы атомов элементов с порядковыми номерами 32 и 42, учитывая, что у последнего происходит «провал» одного 5s-электрона на 4d-подуровень.

Ядерные реакции
Ядерные реакции – это превращение атомных ядер в результате их взаимодействия с элементарными частицами и друг с другом.
В природе ядерные реакции происходили и происходят постоянно. (на Солнце, на Земле)
Первая ядерная реакция была осуществлена Э. Резерфордом в 1919 году в опытах по обнаружению протонов в продуктах распада ядер. Резерфорд бомбардировал атомы азота α-частицами. При соударении частиц происходила ядерная реакция, протекавшая по следующей схеме: 147N + 42He → 178O + 11H
Явление радиоактивности открыл физик А.Беккерель в 1896 году: было обнаружено, что соли урана испускают неизвестное излучение, имеющее способность проходить сквозь препятствия и вызывать почернение фотоэмульсии. А спустя пару лет физики М. и П. Кюри зафиксировали радиоактивность тория и открыли два новых радиоактивных элемента – полоний и радий.

Типы ядерных реакций
Реакции с нейтронами
Реакции с лёгкими ядрами
Реакции под действием гамма-квантов
Реакции под действием электронов и мюонов
Реакции с участием нейтрино
Реакции с участием адронов
Реакции с тяжёлыми ионами

Реакции с нейтронами
Источником нейтронов является, например, ядерный реактор. Рассмотрим получение радиоактивного изотопа на примере реакции активации золота
Полученный изотоп золота с А = 198 – радиоактивный. Он распадается с периодом полураспада Т 1/2 = 2.7 суток

Ядерные реакции под действием гамма квантов
При поглощении гамма-кванта ядро получает избыток энергии без изменения своего нуклонного состава, а ядро с избытком энергии является составным ядром. Как и другие ядерные реакции, поглощение ядром гамма-кванта возможно только при выполнении необходимых энергетических и спиновых соотношений. Если переданная ядру энергия превосходит энергию связи нуклона в ядре, то распад образовавшегося составного ядра происходит чаще всего с испусканием нуклонов, в основном нейтронов. Такой распад ведёт к ядерным реакциям и , которые и называются фотоядерными , а явление испускания нуклонов в этих реакциях — ядерным фотоэффектом .

Реакции под действием электронов и мюонов
Взаимодействие электронов и мюонов с ядрами носит электромагн. характер. Это позволяет использовать мюоны для выявления распределения заряда в ядрах, получения информации об утл. моментах, вероятностях разл. переходов, спиновых возбуждениях. Электроны могут испытывать упругое и неупругое рассеяния на ядрах. Если энергия электронов достаточна, то идут процессы выбивания протонов из ядра (е, р). Взаимодействие мюонов с ядрами происходит через захват мюона с орбиты мюонного атома. Захвату предшествуют торможение мюона в веществе и захват на далёкую мюонную орбиту. При этом образуется мюонный атом .
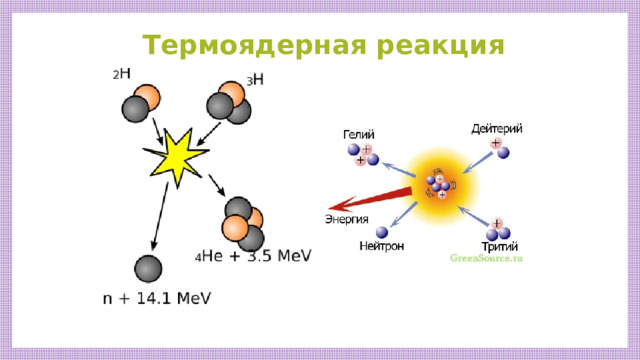
Термоядерная реакция
Термоядерная реакция - это реакция слияния легких ядер при очень высокой температуре (10 7 К).
Термоядерные реакции-основной источник солнечной энергии, лежат в основе водородной бомбы.
Прежде всего, среди них следует отметить реакцию между двумя изотопами (дейтерий и тритий) весьма распространенного на Земле водорода, в результате которой образуется гелий и выделяется нейтрон. Реакция может быть записана в виде:
+ энергия (17,6 MэВ) .

Термоядерная реакция
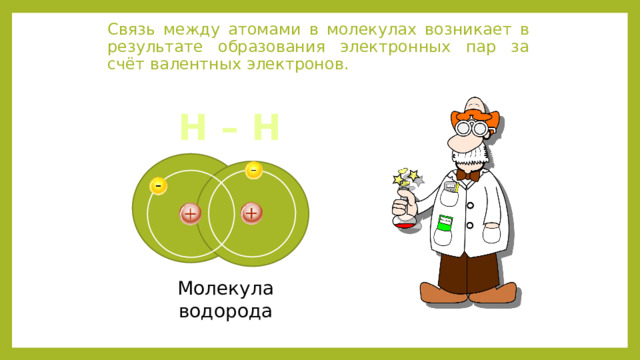
Электроотрицательность химических элементов. Виды химической связи

Связь между атомами в молекулах возникает в результате образования электронных пар за счёт валентных электронов.
Н – Н
Молекула водорода
Проблемный вопрос:
- Как определить, отдаёт или принимает электроны элемент при образовании химической связи?

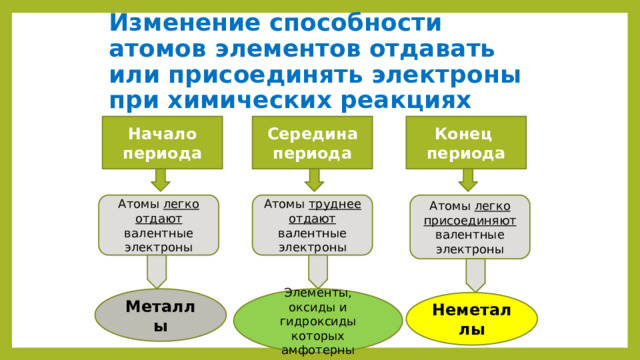
Изменение способности атомов элементов отдавать или присоединять электроны при химических реакциях
Середина периода
Конец
Начало периода
периода
Атомы легко присоединяют валентные электроны
Атомы легко отдают валентные электроны
Атомы труднее отдают валентные электроны
Металлы
Элементы, оксиды и гидроксиды которых амфотерны
Неметаллы

Электроотрицательность — это способность атомов химического элемента смещать к себе общие электронные пары, участвующие в образовании химической связи.
F
Н

Ряд химических элементов, расположенных в соответствии с уменьшением их электроотрицательности (ЭО)
F → O → N → CI → Br → I → S → C → Si →P → H
С уменьшением электроотрицательности (ЭО) уменьшается и способность атома смещать общую электронную пару ближе к своему ядру.

Изменение свойств в ПСХЭ
Металлические свойства уменьшаются,
неметаллические свойства увеличиваются
Неметаллические свойства уменьшаются,
металлические свойства увеличиваются
Изменение электроотрицательности в ПСХЭ
Электроотрицательность увеличивается
Электроотрицательность уменьшаются
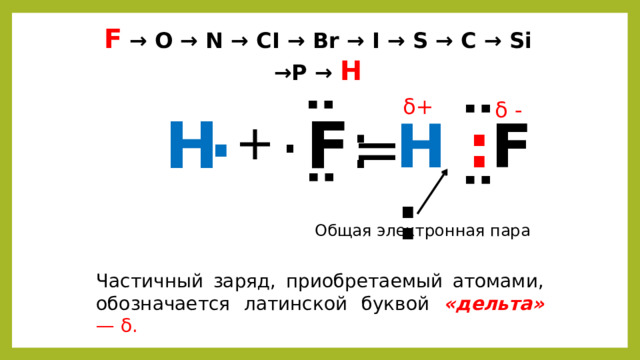
Молекула фтороводорода
H 1
F 9
1S 2 / 2S 2 2p 5
1S 1
Неспаренный электрон
Неспаренный электрон
F
H

:
:
:
:
F → O → N → CI → Br → I → S → C → Si →P → H
.
δ+
.
δ -
H
F :
H : F:
=
+
Общая электронная пара
Частичный заряд, приобретаемый атомами, обозначается латинской буквой «дельта» — δ.

Выводы:
- Электроотрицательность (ЭО) – это важное свойство атомов химических элементов.
- Зная электроотрицательность (ЭО) элемента, можно определить его принадлежность к металлам или неметаллам.
- Зная положение элемента в периодической таблице можно определить, какой из элементов имеет большую или меньшую электроотрицательность (ЭО).
Строение электронных оболочек
Электроны внешнего слоя движутся попарно (спаренные электроны), или отдельно (свободные, неспаренные электроны).
Количество неспаренных электронов (для неметалла) = 8 - номер группы.
∙ ∙∙ ∙∙ ∙
Например, : P ∙ : S ∙ : Cl ∙ ∙ C ∙
∙ ∙ ∙∙ ∙

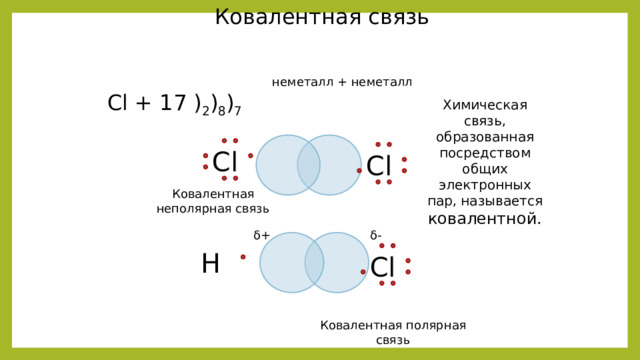
Ковалентная связь
неметалл + неметалл
Cl + 17 ) 2 ) 8 ) 7
Химическая связь, образованная посредством общих электронных пар, называется ковалентной.
Сl
Сl
Ковалентная неполярная связь
δ-
δ+
Н
Сl
Ковалентная полярная связь
КОВАЛЕНТНАЯ СВЯЗЬ - это связь, возникающая между атомами за счет образования общих электронных пар. (Например, H 2 , HCl, H 2 O, O 2 ).
неполярная:
между атомами неметаллов с одинаковой ЭО
полярная: между атомами неметаллов с разной ЭО

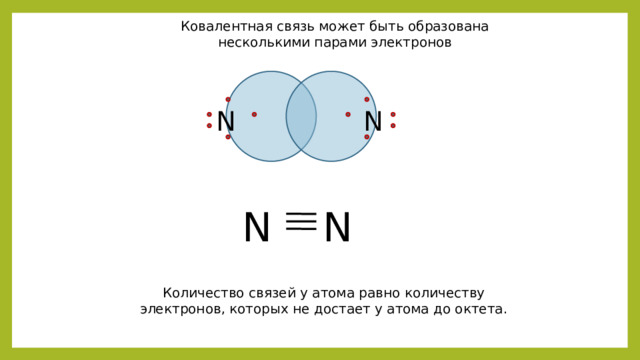
Ковалентная связь может быть образована несколькими парами электронов
N
N
N N
Количество связей у атома равно количеству электронов, которых не достает у атома до октета.

Ионы и ионная химическая связь.
Ионной называется химическая связь, образующаяся между ионами.
Ион – это частица, образующаяся в результате отдачи или принятия электрона.
45
Ионы и ионная химическая связь.
Пример:
NaCl – хлорид натрия (поваренная, пищевая соль)
+
23
0
35
23
35
0
+
-
Na
Cl
Na
Cl
+ 11
+ 11
+ 17
+ 17
1
8
2
8
8
2
8
2
2
8
7
ион хлора
ион натрия
1ē
0
0
-
+
+
Na
Cl
Cl
Na
46

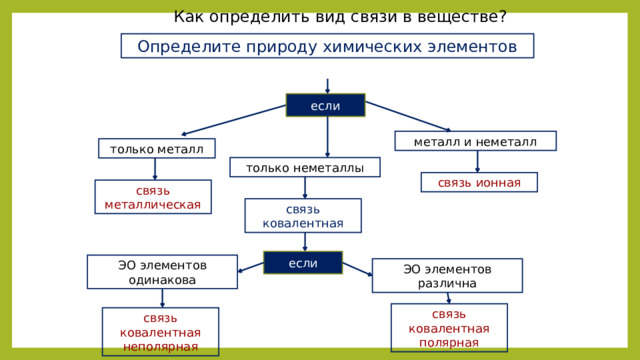
Как определить вид связи в веществе?
Определите природу химических элементов
если
металл и неметалл
только металл
только неметаллы
связь ионная
связь металлическая
связь ковалентная
если
ЭО элементов одинакова
ЭО элементов различна
связь ковалентная полярная
связь ковалентная неполярная

Закрепление
- Выпишите отдельно формулы веществ с ковалентной полярной и неполярной связями, ионной связью: H 2 S, KCl, O 2 , Na 2 S, Na 2 O, N 2 , NH 3 , CH 4 , BaF 2 , LiCl, O 3 , CO 2 , SO 3 , CCl 4 , F 2 .
- Напишите механизм образования молекул с ковалентным типом связи: H 2 S, KCl, O 2 , Na 2 S, Na 2 O, N 2 , NH 3 , CH 4 , BaF 2 , LiCl, CCl 4 , F 2.












































































