
Алкены . Строение молекулы этилена. Химические свойства алкенов .
Выполнила: Панина И.П .

Алк ен ы
- Номенклатура
- Изомерия
- Физические свойства
- Химические свойства
- Получение
- Применение

Алкены - ациклические углеводороды, в молекуле которых кроме одинарных связей содержится 1 двойная связь между атомами углерода.
Общая формула
C n H 2n.

sp² гибридизация ( s - электрон и 2 p - электрона) угол связи- 120 градусов
Форма молекулы – плоский треугольник.
Длина связи С-С - 0,134нм

Гомологический ряд
C 2 H 4 - Этилен (Этен)
C 3 H 6 - Пропилен (Пропен)
C 4 H 8 - Бутен
C 5 H 10 - Пентен
C 6 H 12 - Гексен
C 7 H 14 - Гептен
C 8 H 16 - Октен
C 9 H 18 - Нонен
C 10 H 20 - Децен

Номенклатура
CH 3 -CH 2 -CH 2 -CH=CH-CH 3
гексен-2 (гексен-4)
2-этилпентен-1
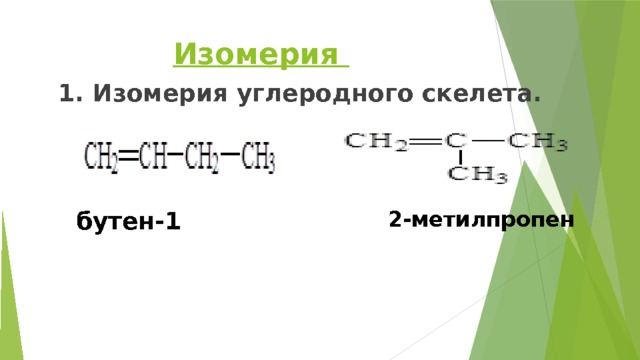
Изомерия
1. Изомерия углеродного скелета.
бутен-1
2-метилпропен

2. Изомерия положения двойной связи.
бутен-1
бутен-2
3. Межклассовая изомерия (с циклоалканами)
циклобутан метилциклопропан

4. Геометрическая изомерия.
цис-бутен-2 транс-
бутен-2

Физические свойства
- Этен, пропен и бутен – газы.
- Алкены, содержащие от 5 до 18 атомов С в молекуле, – жидкости.
- Если атомов в молекуле алкена больше 19 – это твердые вещества.
- Алкены бесцветны, нерастворимы в воде и легче ее, обладают характерным резким запахом.
- С увеличением молекулярной массы температура кипения и плавления увеличиваются.

Химические свойства:
C 2 H 4 + 3 O 2 → 2 CO 2 + 2 H 2 O + Q (пламя ярко светящееся)
- Обесцвечивание перманганата калия

2. Галогенирование (взаимодействие с галогенами ):
CH 2 =CH 2 + Br 2 → CH 2 -CH 2 (1,2-дибромэтан)
│ │
Br Br
3. Гидрогалогенирование (взаимодействие с галогенводородами) правило Марковникова :
СH 3 -CH=CH 2 + H-Br → CH 3 - CH 2 – CH 3
│
Br (2-бромэтан)
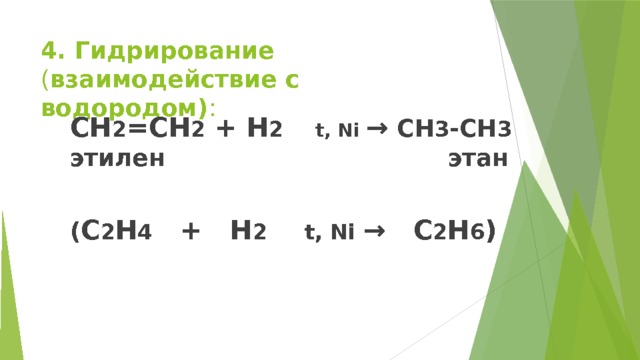
4. Гидрирование ( взаимодействие с водородом) :
CH 2 =CH 2 + H 2 t, Ni → CH 3 -CH 3 этилен этан
( C 2 H 4 + H 2 t, Ni → C 2 H 6 )
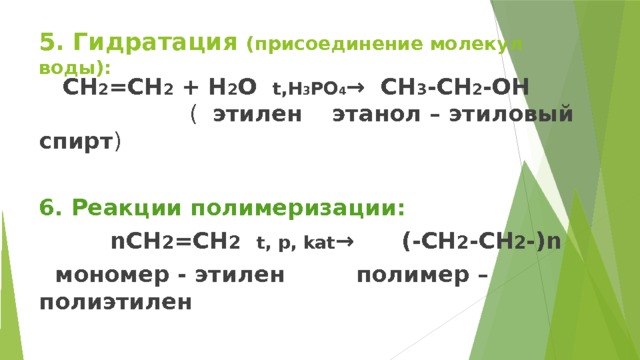
5. Гидратация (присоединение молекул воды):
CH 2 =CH 2 + H 2 O t,H 3 PO 4 → CH 3 -CH 2 -OH ( этилен этанол – этиловый спирт )
6. Реакции полимеризации:
nCH 2 =CH 2 t, p, kat → (-CH 2 -CH 2 -)n
мономер - этилен полимер – полиэтилен
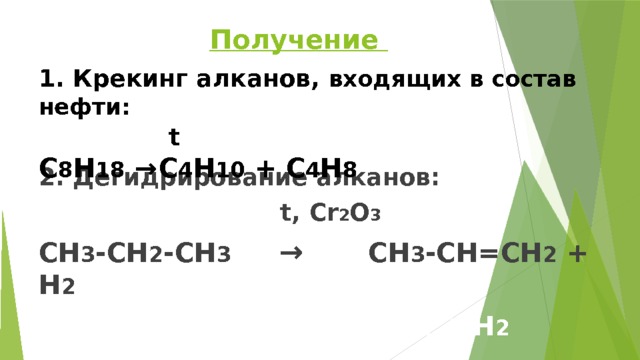
Получение
1. Крекинг алканов, входящих в состав нефти:
t
С 8 Н 18 → С 4 Н 10 + С 4 Н 8
2. Дегидрирование алканов:
t, Cr 2 O 3
СН 3 -СН 2 -СН 3 → СН 3 -СН=СН 2 + Н 2
СН 3 -СН 3 → СН 2 =СН 2 + Н 2
3 . Дегидратация спиртов ( при температуре выше 150 °С):
H 2 SO 4
СН 3 -СН 2 -ОН → СН 2 =СН 2 + Н 2 О

Применение этилена и его соединений:
- Получение полиэтилена.
- Основа для получения синтетических смазочных масел.
- Для производства ацетальдегида,
антифриза и синтетического этилового
спирта.
- Для ускорения созревания плодов.

Знаете ли вы?
Алкены, попадая в атмосферу, реагируют
с кислородом воздуха, оксидами азота и серы, являются одной из
причин токсичного
смога в промышленных зонах.

Вывод:
- Алкены – непредельные углеводороды, в молекулах которых имеется одна двойная связь. Общая формула – СnH2n. В названии алкенов используется суффикс – ен .
- Для алкенов характерны: изомерия углеродной цепи, изомерия положения двойной связи, пространственная (геометрическая) и изомерия между классами
- Алкены обладают большой химической активностью . За счёт наличия кратной связи алкены вступают в реакции присоединения, окисления, полимеризации.

Вопросы:
- Какие углеводороды называются алкенами?
- Напишите структурные формулы углеводородов : Бутен -2 ;
2 - метил –пентен -2;
2,3 диметилбутен -1;
4 –метилпентен -2.

Задача: При гидрировании 45,5 г алкена 14,56 л водорода образуется алкан. Определите формулу этого алкена.

Параграф 34, задание №2
Приготовить доклад на тему :
«Применение полимеров»

Спасибо за сотрудничество!








































