
Массовая доля растворенного вещества

Цели урока:
- Закрепить знания о растворах и растворимости
- Повторить материал о растворимости веществ в воде
- Сформировать понятие о массовой доле
- Рассмотреть решение задач по теме: «Массовая доля растворенного вещества в растворе»


Задача. В 800г раствора содержится 40г поваренной соли. Какова массовая доля соли в растворе?

Решение:
ω = . 100%
ω ( NaCl) = = 0,05 или (5%)
Ответ: ω ( NaCl) = 5 %
Дано:
m р-ра = 800 г
m ( NaCl)= 40 г
Найти: ω ( NaCl)

Задача. Считая, что кусочек сахара-рафинада имеет массу 5,6г ,вычислите массовую долю сахара в вашем чае.

Решение:
w р.в. = ( m в -ва / m р-ра ) .100%
m р-ра = m в -ва + m р-ля
m = V × S
S н2о =1г/мл
В одном стакане 200мл воды.
S н2о =1г/мл, значит
1) m Н2О= V × S = 200г
2) m р-ра. =200г+5,6г =205,6г
3) w р.в. = (5,6г / 205,6г) .100% ≈ 2,72%
Ответ: w р.в. = 2,72%
Дано:
m сах. =5,6г
Найти: w р.в. -?


Задача. Какова массовая доля соли в супе, который вы обычно едите? (Чайная ложка вмещает около 10г поваренной соли.)

Решение:
w р.в. = ( m в -ва / m р-ра ) .100%
m р-ра = m в -ва + m н2о
m н 2 о = V × S
S н 2 о =1г/мл
Пусть в кастрюле имеется 3л воды и 1ч.л. соли, тогда
1л =1000 мл, 3л=3000мл
1) m Н 2 О = 3000мл . 1г/мл =3000г
2) m р-ра. =3000г+10г =3010г
3) w р.в. = (10г / 3010г) .100% ≈ 0,33%
Ответ: w р.в. = 0,33%
Дано:
m соли. =10г
Найти: w р.в. -?
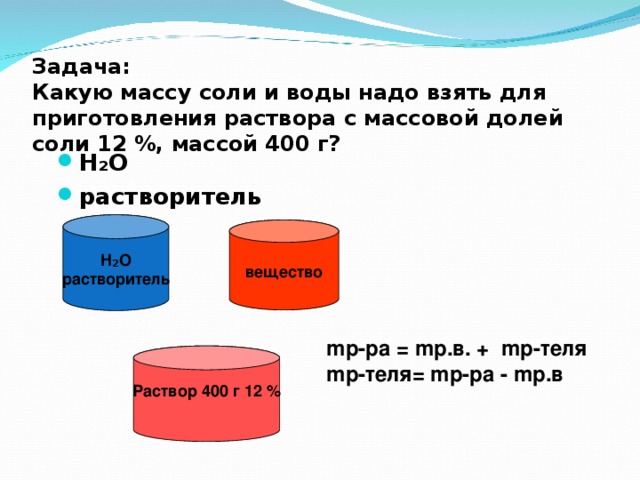
Задача: Какую массу соли и воды надо взять для приготовления раствора с массовой долей соли 12 %, массой 400 г?
H₂O
растворитель
вещество
m р-ра = m р.в. + m р-теля
m р-теля = m р-ра - m р.в
Раствор 400 г 12 %







































