Презентация разработана для учащихся 11 класса, изучающих химию на углубленном уровне. В презентации содержится не только теоретический материал по данной теме, но и задачи для закрепления, а также проблемные вопросы для домашнего задания.
Просмотр содержимого документа
«Презентация к уроку по теме: "Скорость химических реакций"»


- Скорость реакции определяется изменением концентрации реагирующих веществ или продуктов реакции в единицу времени в единице объема для гомогенных реакций или на единице поверхности для гетерогенных реакций:

Изменение концентрации реагентов и продуктов в ходе реакции

- V A = - ∆ c A ∕ 3 ∆ t
- V C =∆ c C ∕ 2 ∆ t
- Скорость реакции - это число элементарных актов взаимодействия в единицу времени.

Факторы, влияющие на скорость реакции.
- Природа реагирующих веществ.
- Концентрация реагирующих веществ.
- Площадь соприкосновения реагирующих веществ.
- Температура.
- Катализаторы.
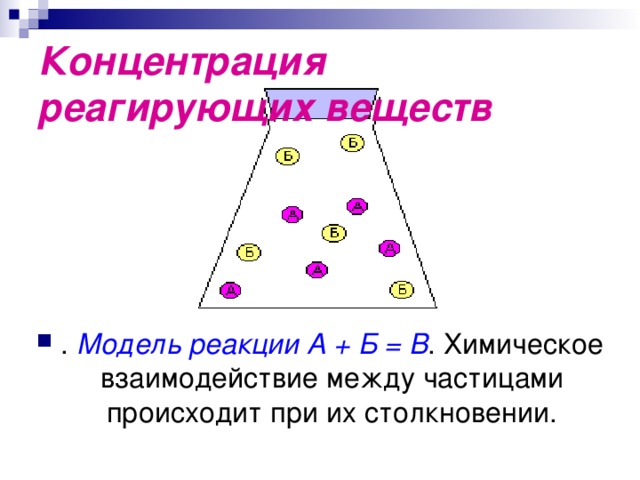
Концентрация реагирующих веществ
- . Модель реакции А + Б = В . Химическое взаимодействие между частицами происходит при их столкновении.

Закон действующих масс: (Гульдберг, Вааге 1867г.)
Скорость реакции прямопропорциональна произведению
концентрации реагирующих веществ.
Для реакции А+В=С
V р-ции = k∙C A C B

Задача
- Запишите выражение для скорости реакции 2 SO 2 + O 2 →2 SO 3 через закон действующих масс и определите, во сколько раз увеличится скорость реакции при увеличении концентрации реагентов в 2 раза.

Площадь соприкосновения реагирующих веществ
- Zn(тв) + H 2 SO 4 (р-р) → H 2 ↑ + ZnSO 4

Правило Вант - Гоффа:
- при повышении температуры на каждые 10 0 С скорость химической реакции возрастает в два - четыре раза
V = V 0 ∙ɣ ∆ t ∕10
V 0 – скорость реакции при начальной температуре системы t 1
V – скорость реакции при конечной температуре системы t 2
ɣ – температурный коэффициент реакции, равный примерно 2÷4.
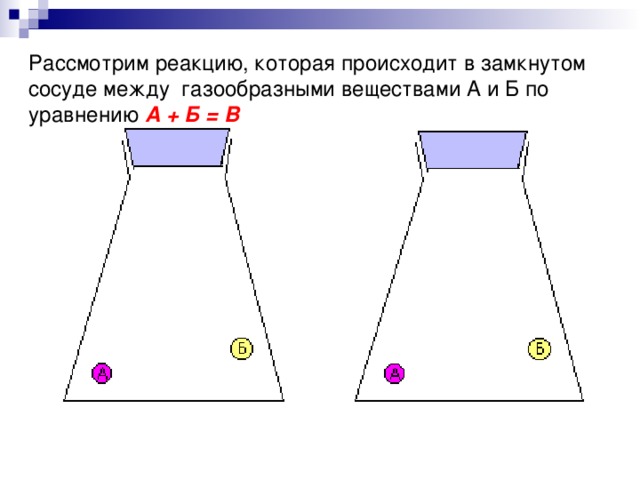
Рассмотрим реакцию, которая происходит в замкнутом сосуде между газообразными веществами А и Б по уравнению А + Б = В
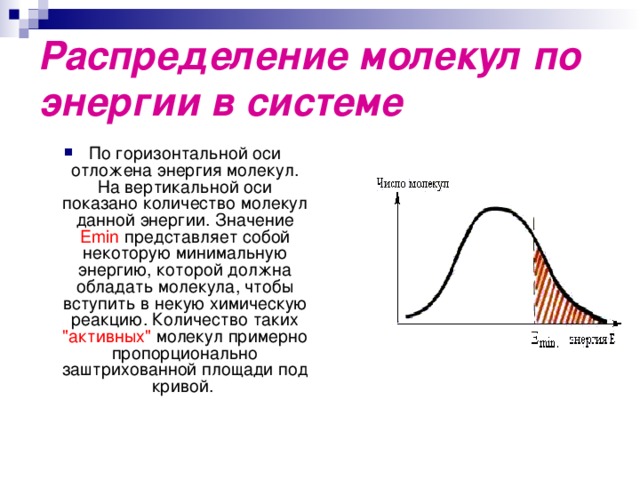
Распределение молекул по энергии в системе
- По горизонтальной оси отложена энергия молекул. На вертикальной оси показано количество молекул данной энергии. Значение Emin представляет собой некоторую минимальную энергию, которой должна обладать молекула, чтобы вступить в некую химическую реакцию. Количество таких "активных" молекул примерно пропорционально заштрихованной площади под кривой.


Задание
Увеличение температуры проведения реакции:
а) не влияет на ее скорость, т.к. теплота не может быть участником превращения веществ
б) увеличивает скорость реакции, т.к. увеличивается число столкновений активных молекул
в) увеличивает скорость реакции, т.к. увеличивается число упругих соударений молекул
г) не влияет на скорость реакции, т.к. в равной мере увеличивается число активных и упругих соударений молекул.

Формулы для расчета скорости реакции
- V =±∆ c ∕∆ t
- V р-ции = k∙C A C B
- V = V 0 ∙ɣ ∆ t ∕10

Домашнее задание
- П.24-25
- стр.156 №6-9
- Может ли давление оказать влияние на скорость реакции?

Задачи
- Рассчитать скорость реакции между азотом и кислородом с образованием оксида азота( II) , если на моменты времени 74с и 124с концентрация азота составляла 0,07 и 0,02 моль/л соответственно.
- Через некоторый промежуток времени после начала реакции 3А+В=2 D молярные концентрации веществ оказались равными 3(А), 1(В) и 0,8моль/л( D ). Найти начальные концентрации реагентов.

Задача
- Во сколько раз изменится скорость реакции при увеличении температуры от 30 до 70 градусов Цельсия, если температурный коэффициент равен 2.



































