
Химическая
лаборатория

скорость
Химической
реакции

Скорость
химической реакции
- Что это такое?
- От чего она зависит?

Химическая реакция – это …
явление, в ходе которого из одних веществ получаются другие.
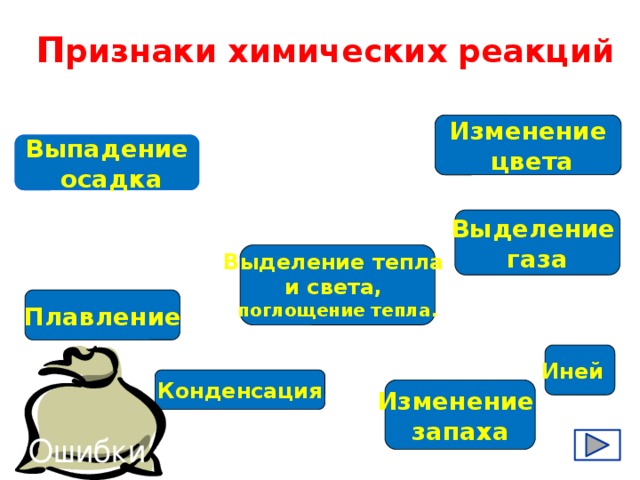
П ризнаки химических реакций
Изменение
цвета
Выпадение
осадка
Выделение
газа
Выделение тепла
и света,
поглощение тепла.
Плавление
Иней
Конденсация
Изменение
запаха
Ошибки

Техника безопасности

Опыт №1
1. Налейте в пробирку Н 2 О2 .
2. Понаблюдайте. Есть признаки реакции?
3. Добавьте MnO 2 . Есть изменения?
Фактор , влияющий на скорость реакции:
присутствие особых веществ:
катализаторов (ускорителей)
или
ингибиторов (замедлителей)

Для правки формата примечаний щелкните мышью
Опыт № 2
В одну трубку опускаю кусочек кальция.
В другую – помещаю немного натрия.
Что вы можете сказать о скорости реакции в обоих случаях?
Фактор , влияющий на скорость реакции :
природа реагирующих веществ

Опыт №3
1. В первую и вторую пробирки поместите по 1 грануле Zn.
2. В обе прилейте H 2 SO 4.
3. Вторую пробирку подогрейте (осторожно!)
Фактор , влияющий на скорость реакции :
температура

Якоб Хендрик Вант-Гофф
1852-1911 гг.
Голландский химик,
один из основателей
физической химии и стереохимии.
Установил, что при повышении температуры на 10оС скорость
реакции увеличивается
в 2-4 раза.
Правило Вант-Гоффа

Опыт № 4
1.В пробирки под №№ 1,2,3 налейте H 2 SO 4
2. В пробирки под №№1а,2а,3а: соответственно 3; 2; 1,5мл Na 2 S 2 O 3
3. Долейте в пробирки 2а и 3а воды до отметки 3мл
Фактор , влияющий на скорость реакции :
Концентрация реагирующих веществ

Опыт №5
1. В одной пробирке у вас находится кусок мрамора.
2.В другой – мраморная крошка .
3. Прилейте в каждую пробирку раствор HCl.
В какой пробирке изменения произошли быстрее?
Фактор , влияющий на скорость реакции :
площадь поверхности
реагирующих веществ

Скорость химической реакции –
это ИЗМЕНЕНИЕ концентрации реагирующих веществ
за единицу ________________ .
изменение
времени

1. Химическая реакция – это:
А. Изменение агрегатного состояния вещества.
Б. Явление, в ходе которого из одних веществ получаются другие.
В. Манипуляции с химической посудой.

2. Признаком химической реакции не является:
О. Выпадение осадка
П. Выделение газа
Р. Плавление вещества

3. Если вы точно соблюдаете правила техники безопасности, то:
А. Ваш эксперимент пройдет успешно
Б. Произойдет взрыв
С. Вы прожжёте свою тетрадь по химии

4. Фактор, не оказывающий влияние на скорость реакции:
А. Температура
Б.Концентрация реагирующих веществ
В. Объём сосуда
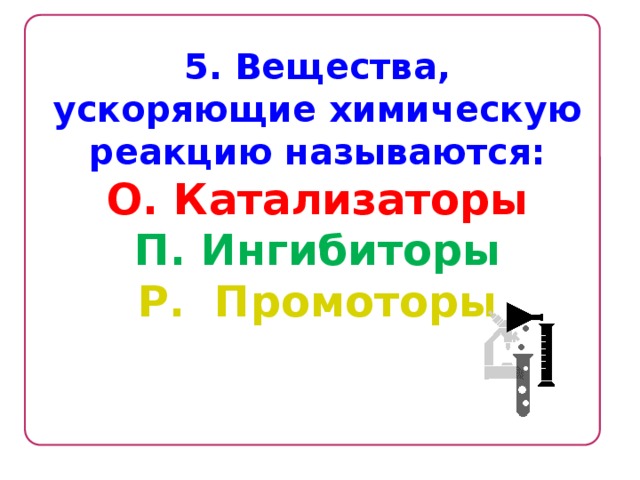
5. Вещества, ускоряющие химическую реакцию называются:
О. Катализаторы
П. Ингибиторы
Р. Промоторы

Проверь себя
о
Р
А
!
В
Б




































