
Железо
Абрамова Татьяна Анатольевна
Учитель химии
МБОУ «Ужурская СОШ № 1
имени ГСС А. К. Харченко»

Основа всего мира .

«Железо не только основа всего мира, самый главный металл окружающей нас природы, оно – основа культуры и промышленности, оно – орудие войны и мирного труда. И трудно во всей таблице Менделеева найти другой элемент, который был бы так связан с прошлыми, настоящими и будущими судьбами человечества».
А. Е. Ферсман.


Fe
2е 8е 14е 2е
1s 2 2s 2 2р 6 3s 2 3р 6 4s 2 3d 6
возможные степени окисления:
+2 и +3
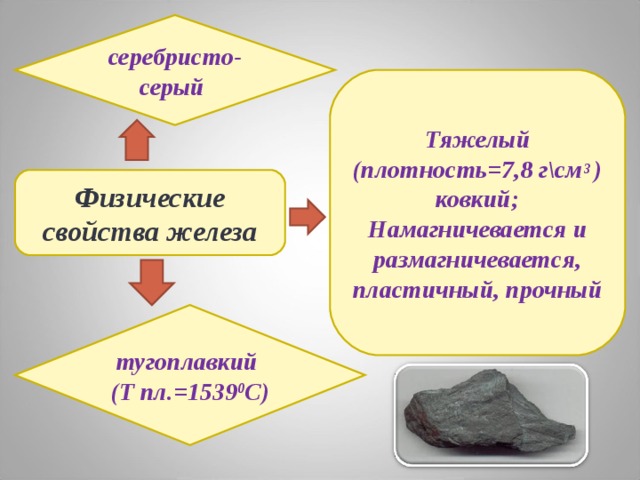
серебристо-серый
Тяжелый (плотность=7,8 г\см 3 )
ковкий;
Намагничевается и размагничевается, пластичный, прочный
Физические свойства железа
тугоплавкий
(Т пл.=1539 0 C )

Трубопроводы
для воды,
нефти и газа
Гидроэлектро-
станции и опоры
линий электропередач
Железо сегодня
Автомобили ,
Тракторы,
Подводные лодки,
Бытовые приборы,
Другие предметы




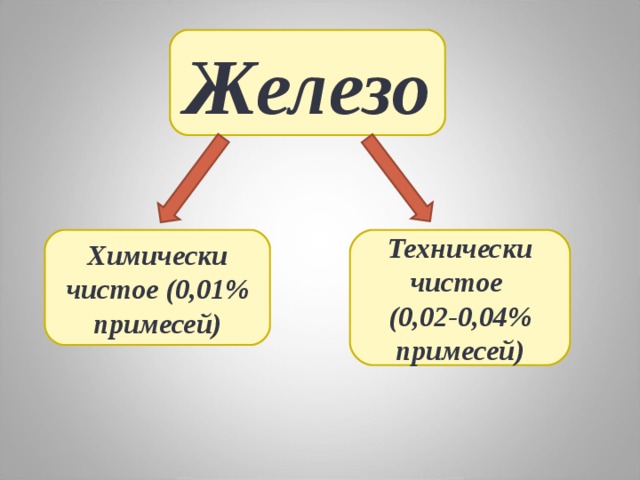
Железо
Химически чистое (0,01% примесей)
Технически чистое
(0,02-0,04% примесей)
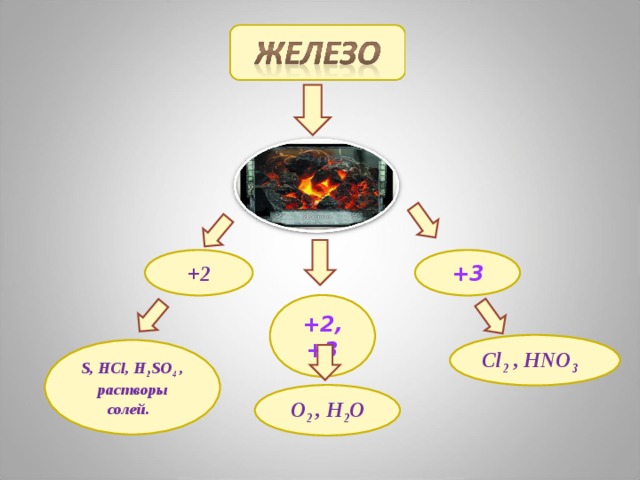
+2
+3
+2, +3
Cl 2 , HNO 3
S, HCl, H 2 SO 4 , растворы солей.
O 2 , H 2 O

Химические свойства
Реакции с простыми веществами
Железо сгорает в чистом кислороде при нагревании:3 Fe + 2 O 2 =Fe 3 O 4
Реагирует с порошком серы при нагревании: Fe +S = FeS
Реагирует с галогенами при нагревании:2 Fe + 3Cl 2 =2FeCl 3

Химические свойства
Реакции со сложными веществами
С кислотами:
А) с соляной кислотой
2 HCl + Fe = FeCl 2 + H 2
Б) с серной кислотой
H 2 SO 4 + Fe = FeSO 4 + H 2
С солями:
Fe + CuSO 4 = Cu + FeSO 4
С водой ( при высокой температуре):
3 Fe + 4H 2 O=Fe 3 O 4 +4H 2
(железная окалина)

Железо разрушается под действием окружающей среды, т.е. подвергается коррозии – «ржавлению».
При этом на поверхности образуется «ржавчина».
4Fe + 2Н 2 О + ЗО 2 = 2(Fe 2 O 3 •Н 2 О)

Железо в виде ионов присутствует в организмах всех животных и, конечно же, человека.
Основная биологическая функция железа – участие в транспорте кислорода ко всем органам и окислительных процессах.
В организме человека с массой тела приблизительно70 кг содержится 4,2 г железа, а в 1 л крови – 450 мг.
При недостатке железа в организме развивается железистая анемия.
Перенос железа в организме осуществляет важнейший белок –гемоглобин, в котором находится больше половины всего железа организма.
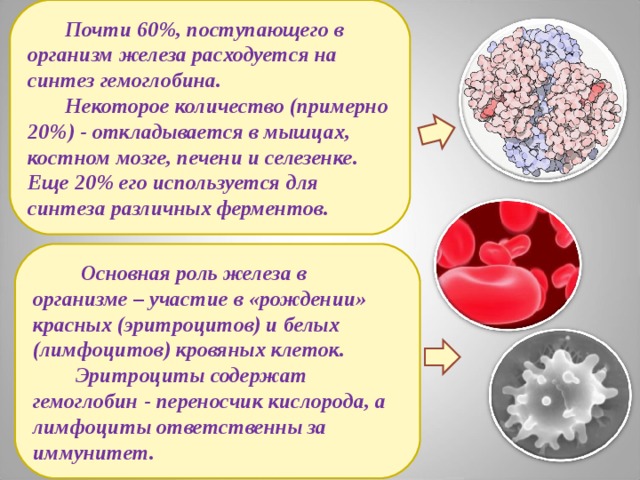
Почти 60%, поступающего в организм железа расходуется на синтез гемоглобина.
Некоторое количество (примерно 20%) - откладывается в мышцах, костном мозге, печени и селезенке.
Еще 20% его используется для синтеза различных ферментов.
Основная роль железа в организме – участие в «рождении» красных (эритроцитов) и белых (лимфоцитов) кровяных клеток.
Эритроциты содержат гемоглобин - переносчик кислорода, а лимфоциты ответственны за иммунитет.
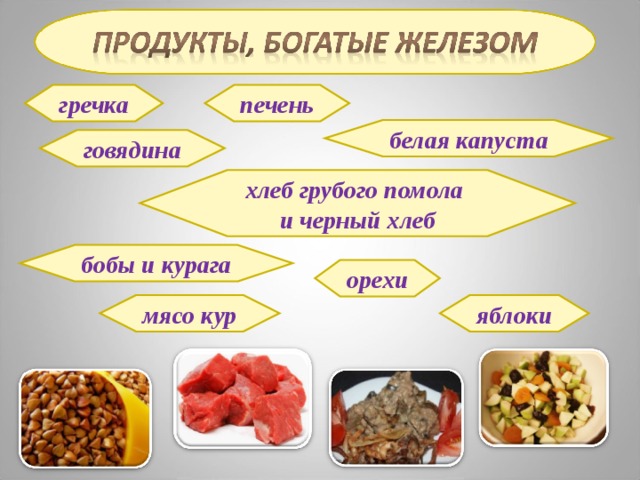
гречка
печень
белая капуста
говядина
хлеб грубого помола
и черный хлеб
бобы и курага
орехи
мясо кур
яблоки

Будьте внимательны к своему здоровью: наличие достаточного количества гемоглобина – это наша жизнь!!!
При анемии (недостатке гемоглобина) увеличьте в своем рационе количество нежирного говяжьего мяса и печени, красной икры, а также яичных желтков.
При анемии, для приготовления пищи, рекомендуется использовать чугунную посуду.
Как показали эксперименты, приготовление и кипячение соуса на протяжении 20 минут в такой посуде, способствует увеличению количества железа в 9 раз.
Людям с пониженным гемоглобином необходимо чаще бывать на свежем воздухе.
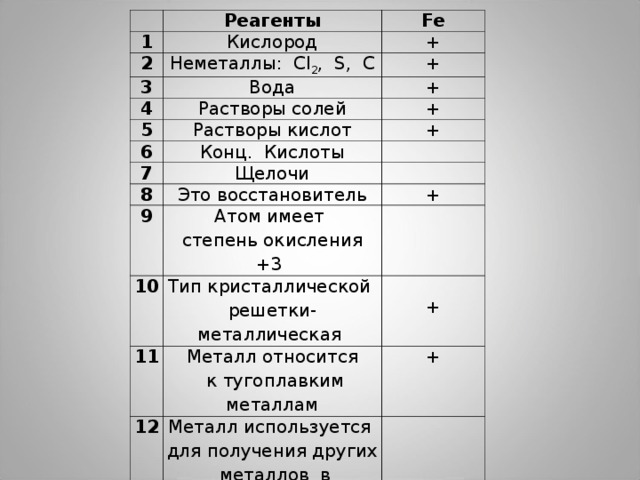
1
Реагенты
2
Кислород
Fe
+
Неметаллы: Cl 2 , S, C
3
+
4
Вода
5
+
Растворы солей
6
+
Растворы кислот
7
+
Конц. Кислоты
Щелочи
8
9
Это восстановитель
+
Атом имеет
степень окисления +3
10
11
Тип кристаллической
решетки- металлическая
12
+
Металл относится
к тугоплавким металлам
+
Металл используется
для получения других
металлов в металлургии













































