Просмотр содержимого документа
«Презентация к уроку в 7 классе "Оксиды. Классификация. Получение и применение"»

Оксиды. Классификация. Получение и свойства Урок химии в 7 классе

Составление формулы оксида
- 1.Запишите знак химического элемента с меньшей электроотрицательностью.
- 2.На втором месте укажите элемент с большей электроотрицательностью.
- 3.Укажите их степени окисления .
- 4. Определите наименьшее общее кратное (НОК).
- 5. Разделите наименьшее общее кратное на степень окисления первого элемента и получите индекс.
- 6. Разделите наименьшее общее кратное на степень окисления второго элемента и получите индекс.
- 7. Запишите готовую формулу.
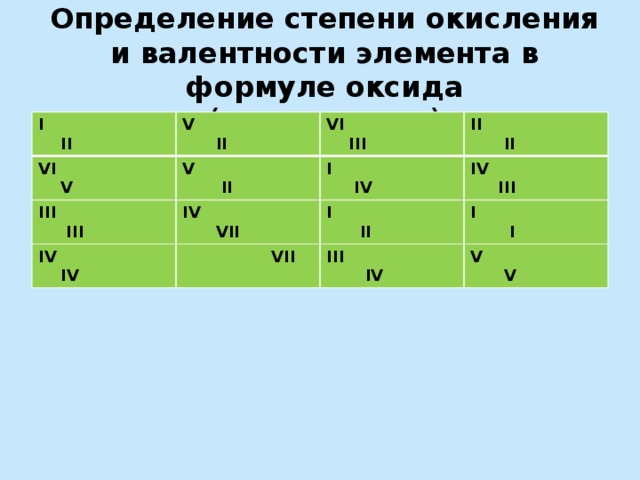
Определение степени окисления и валентности элемента в формуле оксида (химическое лото)
I II
V II
VI V
V II
VI III
III III
IV IV
II II
I IV
IV VII
VII
IV III
I II
I I
III IV
V V
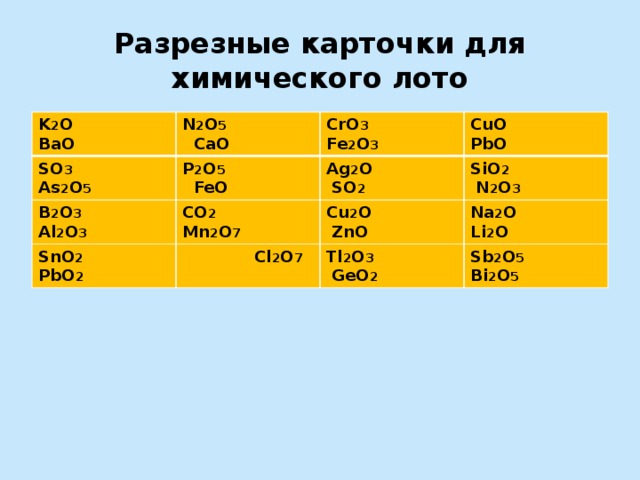
Разрезные карточки для химического лото
K 2 O BaO
N 2 O 5 CaO
SO 3 As 2 O 5
P 2 O 5 FeO
CrO 3 Fe 2 O 3
B 2 O 3 Al 2 O 3
SnO 2 PbO 2
CuO PbO
Ag 2 O SO 2
CO 2 Mn 2 O 7
Cl 2 O 7
SiO 2 N 2 O 3
Cu 2 O ZnO
Na 2 O Li 2 O
Tl 2 O 3 GeO 2
Sb 2 O 5 Bi 2 O 5
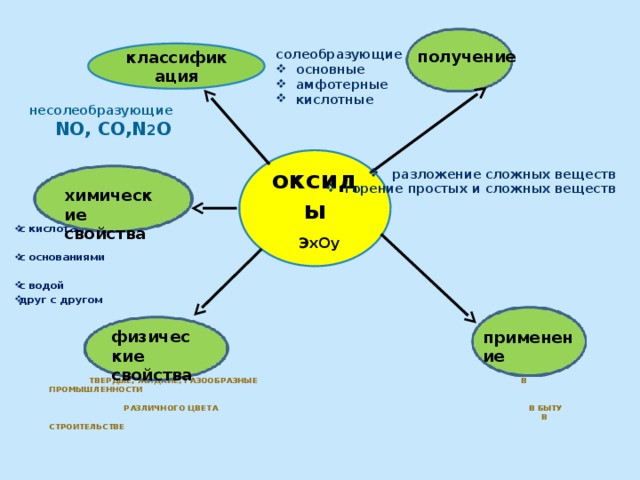
получение
классификация
солеобразующие
- основные
- амфотерные
- кислотные
- разложение сложных веществ
- горение простых и сложных веществ
несолеобразующие
NO, CO,N 2 O
оксиды
ЭхОy
химические свойства
Твердые, жидкие, газообразные в промышленности различного цвета в быту в строительстве
физические
свойства
применение

Химические свойства
основных оксидов
кислотных оксидов
- CO 2 + CaO=
- ZnO+ H 2 SO 4 =
- Na 2 O+ H 2 O=
- CO 2 + CaO=
- SO 3 + H 2 O=
- Ca(OH) 2 + CO 2 =
Закончите уравнения расставьте коэффициенты
Закончите уравнения расставьте коэффициенты

Получение оксидов
- Zn +O 2 = ZnO
- CH 4 + O 2 = CO 2 + H 2 O
- CuS + O 2 = CuO + SO 2
- S + O 2 =SO 2
- Fe(OH) 3 =Fe 2 O 3 + H 2 O
- CaCO 3 = CaO + CO 2
Расставьте коэффициенты в уравнениях

Применение оксида железа III
Fe 2 O 3 – оксид железа (III) – темно-красного цвета – гематит или красный железняк – для изготовления красок

Применение оксида железа (II, III)
Fe 3 O 4 – оксид железа (II, III) – минерал магнетит или магнитный железняк, хороший проводник электричества – для получения и изготовления электродов.

- CaO – оксид кальция (II)– «негашеная» известь, используют в строительстве.

Применение касситерита (оловянной руды)
SnO 2 – оксид олова IV – используется для получения оловянного концентрата. Олово металл, из которого изготавливают консервные банки

Применение оксида алюминия
Al 2 O 3 – оксид алюминия (III) – минерал твердый корунд – как полирующее средство .

Применение оксида кобальта(III), оксида хрома (III) и марганца (VII)
Для создания цветных стекол используют следующие оксиды:
- C O2 O 3 – синий цвет , Cr 2 O 3 – зеленый цвет, MnO 2 – розовый цвет
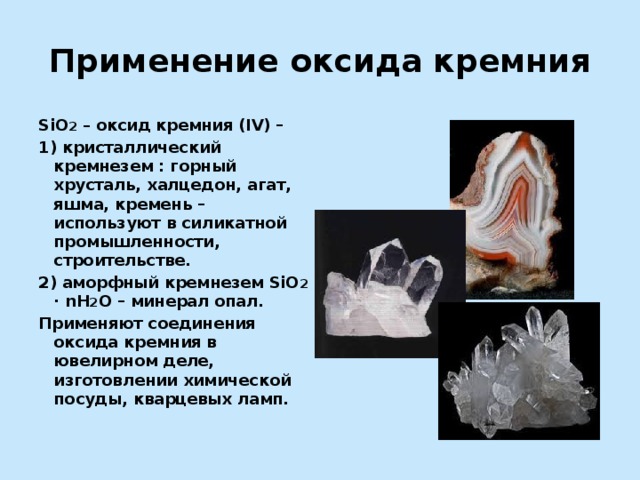
Применение оксида кремния
SiO 2 – оксид кремния (IV) –
1) кристаллический кремнезем : горный хрусталь, халцедон, агат, яшма, кремень – используют в силикатной промышленности, строительстве.
2) аморфный кремнезем SiO 2 ∙ nH 2 O – минерал опал.
Применяют соединения оксида кремния в ювелирном деле, изготовлении химической посуды, кварцевых ламп.

Применение оксида серы (IV)
SO 2 – оксид серы (IV) или сернистый газ –используют для отбеливания тканей и бумаги, производства спичек и резины, консервирования, для борьбы с кожными заболеваниями, для производства серной кислоты

Применение оксида углерода (IV)
CO 2 – оксид углерода (IV), углекислый газ. Твердый оксид углерода – сухой лед. Для изготовления соды, сахара, газированных напитков, в жидком виде в огнетушителях .

Домашнее задание
§ 40 р.т. стр. 132-133
Составьте рассказ о нахождении 2-3 оксидов по выбору в природе, их значении


































