

В периодической системе d-элементы или переходные металлы расположены в побочных подгруппах (или В подгруппах) всех восьми групп.
Это элементы, которые при образовании соединений имеют незаполненную d- орбиталь.
Под определение не подпадают скандий ( 3d 0 в соединениях) и цинк (3 d 10 в соединениях ) ; медь же входит в группу указанных соединений, если имеет в них конфигурацию 3 d 9 .
Принято, однако, относить эти металлы к d- металлам на основании химического сходства их соединений.
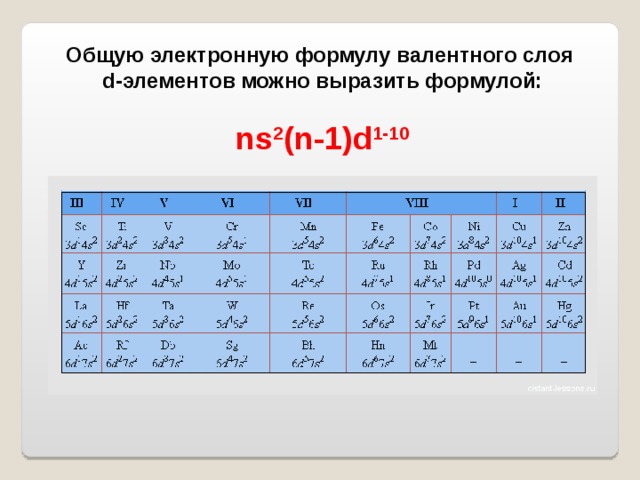
Общую электронную формулу валентного слоя
d-элементов можно выразить формулой:
ns 2 (n-1)d 1-10
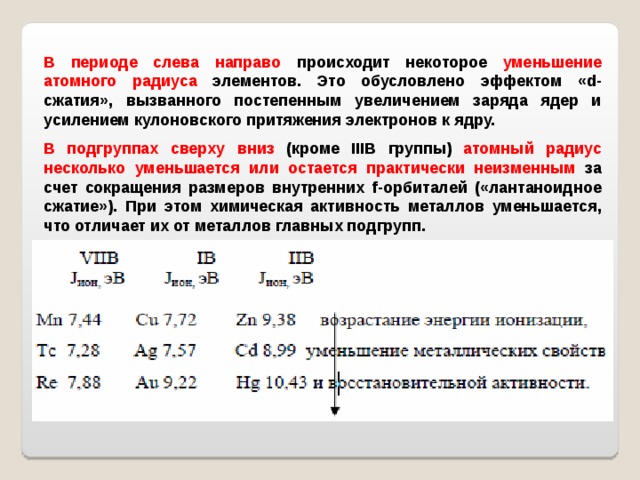
В периоде слева направо происходит некоторое уменьшение атомного радиуса элементов. Это обусловлено эффектом « d -сжатия», вызванного постепенным увеличением заряда ядер и усилением кулоновского притяжения электронов к ядру.
В подгруппах сверху вниз (кроме IIIB группы ) атомный радиус несколько уменьшается или остается практически неизменным за счет сокращения размеров внутренних f -орбиталей («лантаноидное сжатие»). При этом химическая активность металлов уменьшается, что отличает их от металлов главных подгрупп.

У элементов III В группы атомные радиусы возрастают , химическая активность увеличивается, благодаря чему они проявляют большее сходство с элементами главных подгрупп, чем побочных. По реакционной способности элементы подгруппы скандия уступают лишь щелочным и щелочноземельным металлам.
В периодах слева направо металлические свойства уменьшаются.
Минимальные восстановительные свойства проявляют тяжелые металлы VIIIB и IB – групп. За свою инертность они названы благородными.

В химических реакциях электроны d-орбиталей участвуют после того, как оказываются использованными s-электроны внешнего энергетического уровня.
В образовании связей могут участвовать все или только часть d-электронов предпоследнего энергетического уровня, поэтому образуются соединения с различной валентностью или степенью окисления (кроме d-элементов II и III групп).
Например, характерными для элементов VIII В группы являются следующие степени окисления (в скобках – наиболее устойчивые):
Fe Co Ni семейство железа
+2,(+3),+6 +2,(+3) +2,(+3)
Ru Rh Pd легкие платиновые металлы
+3,(+4),+6,+8 (+3),+4 (+2),(+4)
О s Ir Pt тяжелые платиновые металлы
+4,(+6),+8 +3,(+4) +2,(+4),+6

Таким образом,
особенностями электронного строения d-элементов обусловлены и их свойства:
а) большое разнообразие проявляемых валентностей и степеней окисления;
б) способность образовывать различные комплексные соединения;
в) каталитическая активность.

Физические свойства d- металлов
Физические свойства переходных металлов зависят от электронного строения, от числа неспаренных d-электронов, которые могут участвовать в образовании связей.
- Металлы, у которых по 3–4 неспаренных d-электрона (VВ и VIВ группы), имеют максимальную температуру плавления и кипения.
- Переходные металлы, имеющие на внешнем s-подуровне один электрон , как правило, имеют более высокую электрическую проводимость (Cr, Мo и особенно Cu, Ag, Au).
- Элементы III-В группы, имеющие всего один d-электрон , по своим свойствам близки к соседним щелочноземельным металлом,
- а металлы II-В группы с полностью заполненным d-подуровнем близки по свойствам к соседним р-элементам.

Химические свойства d -металлов
Все d-элементы являются восстановителями. Восстановительная способность в растворах в пределах периода уменьшается.
Наиболее сильными восстановителями являются металлы IIIВ группы.
У большинства d-элементов образуются защитные оксидные пленки , вызывающие их пассивацию и предохраняющие их от коррозии. Наиболее склонны к пассивации металлы IVВ–VIВ групп.
Элементы IIIВ и IIВ групп (кроме ртути) легко взаимодействуют с разбавленными кислотами, а лантан взаимодействует и с водой.
Не взаимодействуют с разбавленными кислотами металлы IВ группы, ртуть и платиновые металлы (Ru, Rh, Pd, Os, Ir, Pt).
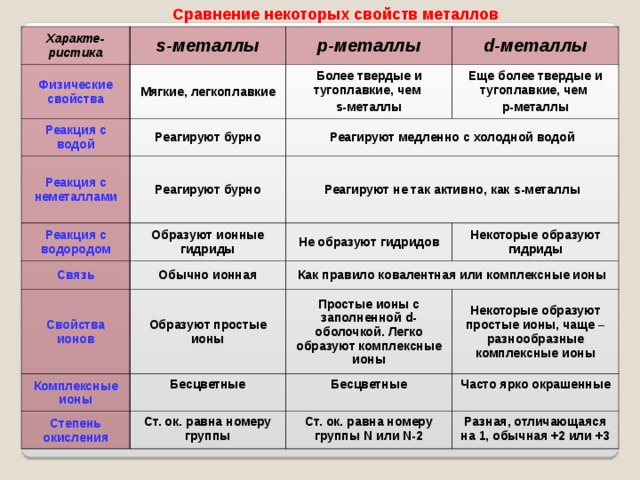
Сравнение некоторых свойств металлов
Характе-ристика
s -металлы
Физические свойства
р-металлы
Реакция с водой
Мягкие, легкоплавкие
d- металлы
Более твердые и тугоплавкие, чем
s -металлы
Реагируют бурно
Реакция с неметаллами
Еще более твердые и тугоплавкие, чем
р-металлы
Реагируют медленно с холодной водой
Реагируют бурно
Реакция с водородом
Связь
Реагируют не так активно, как s -металлы
Образуют ионные гидриды
Свойства ионов
Не образуют гидридов
Обычно ионная
Как правило ковалентная или комплексные ионы
Некоторые образуют гидриды
Образуют простые ионы
Комплексные ионы
Простые ионы с заполненной d- оболочкой. Легко образуют комплексные ионы
Бесцветные
Степень окисления
Некоторые образуют простые ионы, чаще – разнообразные комплексные ионы
Бесцветные
Ст. ок. равна номеру группы
Часто ярко окрашенные
Ст. ок. равна номеру группы N или N -2
Разная, отличающаяся на 1, обычная +2 или +3

Строение и свойства соединений d -элементов зависят от степени окисления металла
Степень окисления элемента
Низшая
+1,+2
Свойства соединений
Основные,
восстановительные
Промежуточная
+3,+4
Тип связи
Примеры
Высшая
+4,+5,+6,+7,+8
Амфотерные, окислительно-восстановительные
Ионный
Mo 2+ , V 2+ , Mn 2+ , Cu + , Fe 2+
Кислотные,
окислительные
Ковалентно-полярный
Преимущественно ковалентный
Mo 3+ , Mn 4+ , Cr 3+ , Fe 3+
Mo 6+ , V 5+ , Mn 7+ , Cr 6+

Оксиды и гидроксиды d -элементов
Переходные металлы реагируют с кислородом, образуя оксиды ( искл . Ag, Au) . Почти все они нерастворимы в воде, черного или иного цвета. Обладают заметной ковалентностью связей.
Оксид железа ( II ) FeO,
магнитный железняк (магнетит) Fe 3 O 4
и красный железняк (гематит) Fe 2 O 3 (в чашке).
Оксид хрома С r 2 O 3
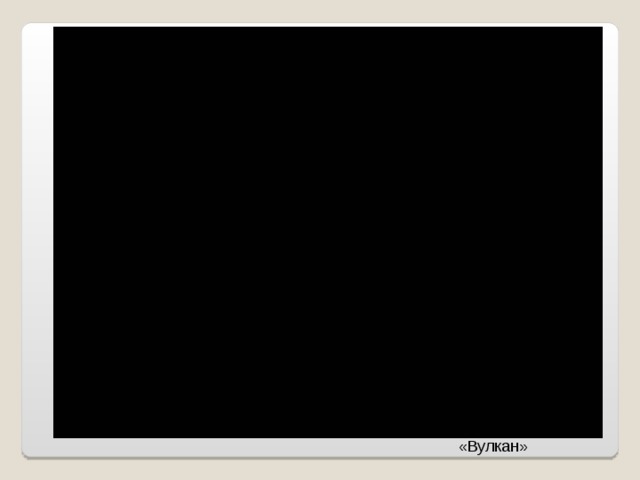

![Гидроксиды переходных металлов получают добавлением щелочей к растворам, содержащим соответствующие ионы металла. Цвет образующегося осадка часто используют для идентификации присутствующего металла. Все осадки гелеобразны вследствие гидратации и обладают основными свойствами. Некоторые амфотерны, а некоторые образуют растворимые комплексы с аммиаком: Осадок Цвет Реакция Cr(OH) 3 с NaOH (водн.) зеленый Mn(OH) 2 с NH 3 (водн.) бежевый CrO 3 3- Fe(OH) 2 Fe(OH) 3 - - зеленый ржавый - - Co(OH) 2 - Ni(OH) 2 - розовый зеленый - [Co(OH) 4 ] 2- Cu(OH) 2 [Co(NH 3 ) 6 ] 2+ - голубой Zn(OH) 2 [Ni(NH 3 ) 4 ] 2+ бесцветный - [Cu(NH 3 ) 4 ] 2+ [Zn(OH) 4 ] 2- [Zn(NH 3 ) 4 ] 2+](https://fsd.multiurok.ru/html/2017/11/02/s_59fa3a12dc15c/img14.jpg)
Гидроксиды переходных металлов получают добавлением щелочей к растворам, содержащим соответствующие ионы металла. Цвет образующегося осадка часто используют для идентификации присутствующего металла. Все осадки гелеобразны вследствие гидратации и обладают основными свойствами. Некоторые амфотерны, а некоторые образуют растворимые комплексы с аммиаком:
Осадок
Цвет
Реакция
Cr(OH) 3
с NaOH (водн.)
зеленый
Mn(OH) 2
с NH 3 (водн.)
бежевый
CrO 3 3-
Fe(OH) 2
Fe(OH) 3
-
-
зеленый
ржавый
-
-
Co(OH) 2
-
Ni(OH) 2
-
розовый
зеленый
-
[Co(OH) 4 ] 2-
Cu(OH) 2
[Co(NH 3 ) 6 ] 2+
-
голубой
Zn(OH) 2
[Ni(NH 3 ) 4 ] 2+
бесцветный
-
[Cu(NH 3 ) 4 ] 2+
[Zn(OH) 4 ] 2-
[Zn(NH 3 ) 4 ] 2+
Свойства соединений d -элементов
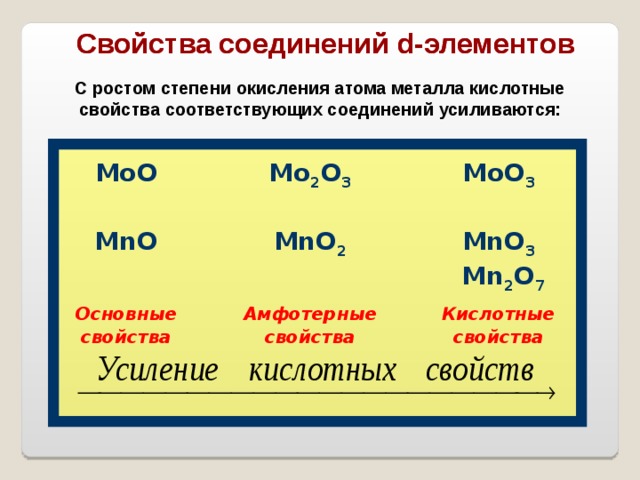
Свойства соединений d -элементов
С ростом степени окисления атома металла кислотные свойства соответствующих соединений усиливаются:
MoO
M о 2 O 3
MnO
MoO 3
MnO 2
Основные
свойства
Амфотерные
свойства
MnO 3
Mn 2 O 7
Кислотные
свойства
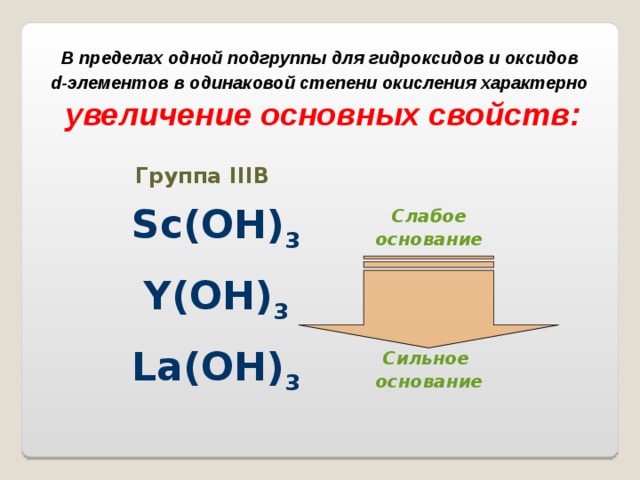
В пределах одной подгруппы для гидроксидов и оксидов
d -элементов в одинаковой степени окисления характерно
увеличение основных свойств:
Группа III В
Sc(OH) 3
Слабое
основание
Y(OH) 3
La(OH) 3
Сильное
основание

В периоде кислотные свойства гидроксидов в высшей степени окисления металла усиливаются:
Ti(OH) 4 – HVO 3 – H 2 CrO 4 – HMnO 4 – H 2 FeO 4



















![Гидроксиды переходных металлов получают добавлением щелочей к растворам, содержащим соответствующие ионы металла. Цвет образующегося осадка часто используют для идентификации присутствующего металла. Все осадки гелеобразны вследствие гидратации и обладают основными свойствами. Некоторые амфотерны, а некоторые образуют растворимые комплексы с аммиаком: Осадок Цвет Реакция Cr(OH) 3 с NaOH (водн.) зеленый Mn(OH) 2 с NH 3 (водн.) бежевый CrO 3 3- Fe(OH) 2 Fe(OH) 3 - - зеленый ржавый - - Co(OH) 2 - Ni(OH) 2 - розовый зеленый - [Co(OH) 4 ] 2- Cu(OH) 2 [Co(NH 3 ) 6 ] 2+ - голубой Zn(OH) 2 [Ni(NH 3 ) 4 ] 2+ бесцветный - [Cu(NH 3 ) 4 ] 2+ [Zn(OH) 4 ] 2- [Zn(NH 3 ) 4 ] 2+](https://fsd.multiurok.ru/html/2017/11/02/s_59fa3a12dc15c/img14.jpg)






















