
Производство серной кислоты

Цель:
- узнать способы получения и области применения серной кислоты.

Проверка Д.З
1.У доски решить задачу №4
2.Написать уравнения реакций взаимодействия серной кислоты с цинком, оксидом железа(ІІІ), оксидом кальция, гидроксидом кальция, гидроксидом натрия, хлоридом бария
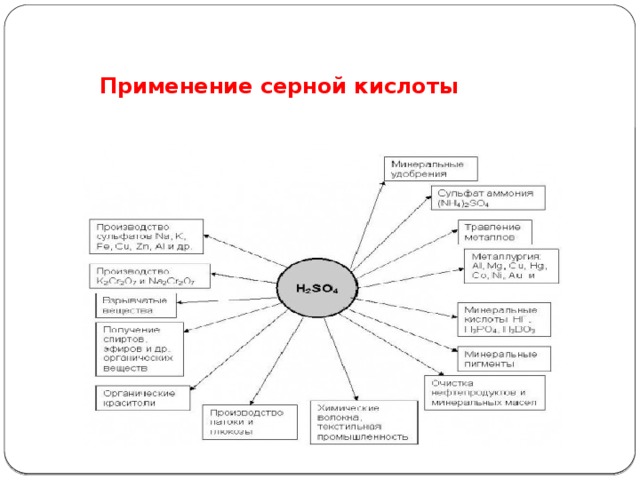
Применение серной кислоты

История открытия и получения серной кислоты.
Примерно 800 году н.э .арабские алхимики научились получать серную кислоту.
Серная кислота стала первой сильной минеральной кислотой, которую алхимики научились получать и использовать Получение серной кислоты приписывается арабскому алхимику Джафар аль-Суфи (8 в.), Абу Джабиру (8 в.), Ар-Рази (10 в.) или даже Альберту Магнусу (13 в.); вполне вероятно, что каждый из них шел к открытию собственным путем. Но одно известно точно - первоначальный способ получения серной кислоты был основан на ее выделении из квасцов или «зеленого камня» (железного купороса) путем прокаливания.

Еще в XIII веке серную кислоту получали в незначительных количествах термическим разложением железного купороса FeSO 4 , поэтому и сейчас один из сортов серной кислоты называется купоросным маслом , хотя уже давно серная кислота не производится из купороса.

Термины «купоросная кислота», «купоросное масло», «серное масло», «купоросный спирт» встречаются в России уже в XVII в. Так называли концентрированную серную кислоту H 2 S0 4 , которую получали нагреванием железного купороса в глиняных ретортах.
При Петре I серную кислоту в Россию привозили из-за границы. Но уже в 1798 г. купец Муромцев «выварил» 125 пудов (около двух тонн) «купоросной кислоты» нагреванием железного купороса. Позже в России серную кислоту стали получать другим способом, сжигая смесь селитры и серы во влажных камерах. Так производили серную кислоту до начала XX в. Первое современное промышленное производство серной кислоты контактным методом — окислением диоксида серы в триоксид в присутствии катализатора (губчатой платины Pt) — было создано в России на Тентелевском химическом заводе в Санкт Петербурге в 1903 г.

Первому промышленному способу получения серной кислоты, положенному в основу камерного процесса, предшествовали работы французских химиков Н. Лемери и Н. Лефевра, предложивших в 1666 г. (по другим данным - в 1690 г.) окислять серу, нагревая ее в смеси с селитрой Указанный путь получения серной кислоты был впервые реализован в заводском масштабе в Англии в 1740 г
В 1805 г. камерный способ производства серной кислоты был введен в России.

Наряду с камерным способом производства серной кислоты в конце XIX в. начал развиваться контактный процесс. Принцип контактного способа получения серной кислоты был открыт в 1831 г. П. Филипсом (Англия), внесшим предложение окислять сернистый ангидрид непосредственно кислородом воздуха при пропускании газовой смеси через накаленный платиновый катализатор.
Первый завод контактного производства серной кислоты был пущен в 1847 г. (Бельгия), но вскоре был закрыт связи с тем, что не удавалось точно установить причины отравления платинового катализатора, и не были установлены физико-химические факторы, влияющие на процесс.

Производство серной кислоты
Нитрозный метод
При реакции SO 3 с водой выделяется огромное количество теплоты и серная кислота начинает закипать с образованием «туманов»
SO 3 + H 2 O = H 2 SO 4 + Q
Поэтому SO 3 смешивается с H 2 SO 4 , образуя раствор в 91% H 2 SO 4 –олеум.

Нитрозный метод (башенный)
Недостаток башенного метода состоит в том, что полученная серная кислота имеет концентрацию лишь 75% (при большей концентрации плохо идёт гидролиз нитрозиллерной кислоты). Концентрирование же серной кислоты упариванием представляет дополнительную трудность.
Преимущество этого метода в том, что примеси содержащиеся в SO 2 , не влияют на ход процесса, так что исходный SO 2 достаточно очистить от пыли, т.е. механических загрязнений. Естественно, башенная серная кислота бывает недостаточно чистой, что ограничивает её применение.

Контактный способ вытесняет нитрозный.
Ниже приведены реакции по производству серной кислоты из минерала пирита на катализаторе — оксиде ванадия (V).
1. 4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2
2. 2SO 2 +O 2 = 2SO 3
3. SO 3 + H 2 O=H 2 SO 4
Известно сотни веществ, ускоряющих окисление SO 2 до SO 3 , три лучших из них в порядке уменьшения активности: платина, пятиокись ванадия и оксид железа. При этом платина отличается дороговизной и легко отравляется примесями, содержащимися в газе SO 2 , особенно мышьяком. Оксид железа требует высоких температур для проявления каталитической активности (выше 625 гр. C). Таким образом, ванадиевый катализатор является наиболее рациональным, и только он применяется при производстве серной кислоты.

Производство серной кислоты из минерала пирита на катализаторе-оксиде ванадия (V).
Контактный способ производства серной кислоты.
1) Измельчение пирита.
2) Очистка пирита.
ПЕРВАЯ СТАДИЯ - обжиг пирита в печи для обжига в "кипящем слое".
t = 800°C
4FeS 2 + 11O 2 =2Fe 2 O 3 + 8SO 2 + Q
ВТОРАЯ СТАДИЯ - окисление SO 2 в SO 3 кислородом .
Протекает в контактном аппарате.
2SO 2 + O 2 2SO 3 + Q
ТРЕТЬЯ СТАДИЯ - поглощение SO 3 серной кислотой.
Протекает в поглотительной башне

Первичная проверка знаний
Перечислите
1.Основные стадии получения серной кислоты контактным способом из пирита.
2 . Охарактеризуйте процессы происходящие в каждой стадии .

Напишите
1.Уравнение реакции первой стадии получения серной кислоты.
2.Уравнение реакции второй стадии получения серной кислоты.
3.Уравнение реакции третьей стадии получения серной кислоты


Экологические проблемы
Какие экологические проблемы возникают при получении использовании серной кислоты?

Можно выделить целый ряд экологических проблем , связанных с производством серной кислоты.
1.Связана с обжигом серного колчедана FeS 2 и других сульфидных руд. При обжиге, протекающем в «кипящем слое», получающийся оксид металла, например Fe 2 O 3 , выделяется в атмосферу.

2. При производстве серной кислоты в атмосферу попадает много оксида серы (IV): 2SO 2 + O 2 = 2SO 3

3. Для производства серной кислоты нередко используется сера, получаемая из сероводорода (это вещество является отходом ряда производств). Эта технологическая схема несовершенна - около 20% серы идет на образование оксида серы (IV), который выделяется в атмосферу.

4.Взаимодействуя с другими компонентами воздуха и атмосферной влагой, оксид серы (VI) образует мельчайшие частицы сульфатных солей. При выпадение осадков образуют «кислотные дожди», которые губят лесные массивы, нарушают жизнедеятельность водных экосистем, вызывают серьезные нарушения здоровья животных и человека, особенно их дыхательной системы.

Способы решения экологических проблем, связанных с производством серной кислоты:
1. Один из способов разрешения экологических проблем — использование технологических схем , сводящих к минимуму загрязнение атмосферы: 1) непрерывность процесса; 2) циркуляционные процессы (непрореагировавшие вещества возвращаются в сферу реакции); 3) принцип противотока (увеличивается площадь поверхности реагирующих веществ и скорость реакции); 4) комплексное использование сырья, безотходная технология; 5) выбор оптимального сырья и режима его переработки.
2. Еще один важный путь — это совершенствование технологического
оборудования , в частности различных фильтров и поглотителей

Будьте осторожны при работе с серной кислотой
Серная кислота и близкие к ней продукты - чрезвычайно токсичные вещества, которым присвоен класс опасности II. Их пары поражают дыхательные пути, кожу, слизистые оболочки, вызывают затруднение дыхания, кашель, нередко – ларингит, трахеит, бронхит

Подведение итогов урока
1. Считаете ли вы, что цели урока вами достигнуты? 2. Как бы вы оценили результаты своей работы на уроке

Домашнее задание
1.§22 стр.104-106
2.Упр.4 стр.107
3.Упр.6 стр.107
4.Решить задачу №7

Спасибо за внимание

Список литературы: 1. Габриелян О.С. Учебник химии 9 класс. Москва «ВАКО» 2009г
2. Горковенко М.Ю. Поурочные разработки по химии. Москва «ВАКО» 2005г
3.Справочник школьника химия. Филологическое общество «СЛОВО».
4.Экзаменационные вопросы и ответы по химии 9 – 11. Издательство АСТпресс












































