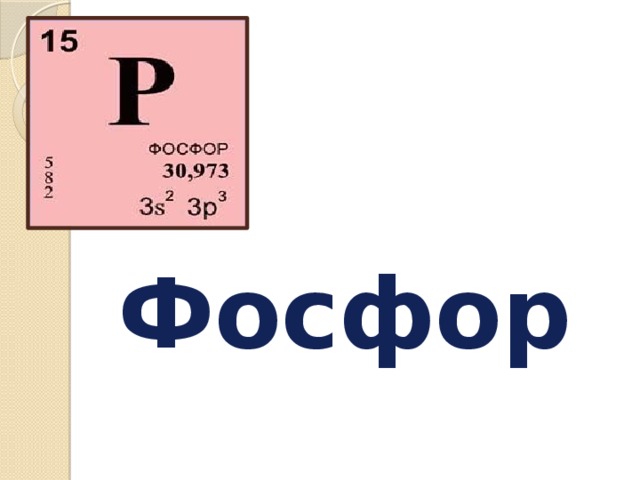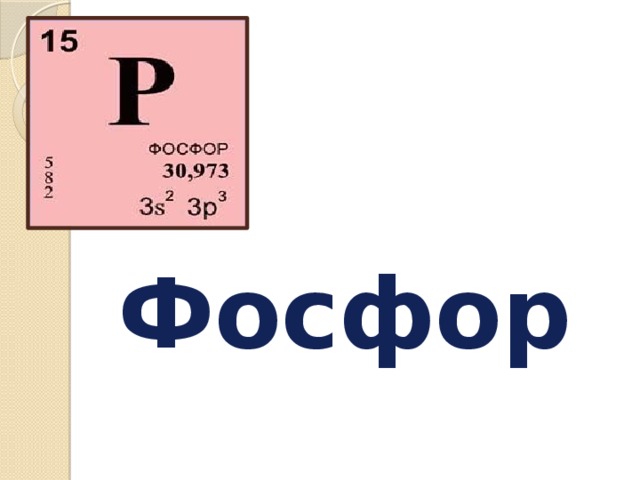
Фосфор

Цели урока
- Повторить
- Изучить
- Сравнить
- Обобщить
- Установить
- Объективно оценить

Строение и свойства атома
1. Перечислите элементы V группы.
2. Охарактеризуйте фосфор по положению в периодической системе химических элементов Д.И. Менделеева.
3. Опишите электронное строение атома фосфора.
4. В чем сходство и различие в строении атомов азота и фосфора?
5. Назовите возможные степени окисления фосфора.
6. Напишите формулу его высшего оксида, укажите его характер.
7. Напишите формулу гидроксида фосфора, укажите его характер.
8. Напишите формулу летучего водородного соединения фосфора.
9. У какого элемента сильнее выражены неметаллические свойства: а) азот, фосфор, мышьяк; б) кремний, фосфор, сера?

Аллотропные модификации
Фосфор
Белый
4
Фосфор
Белый
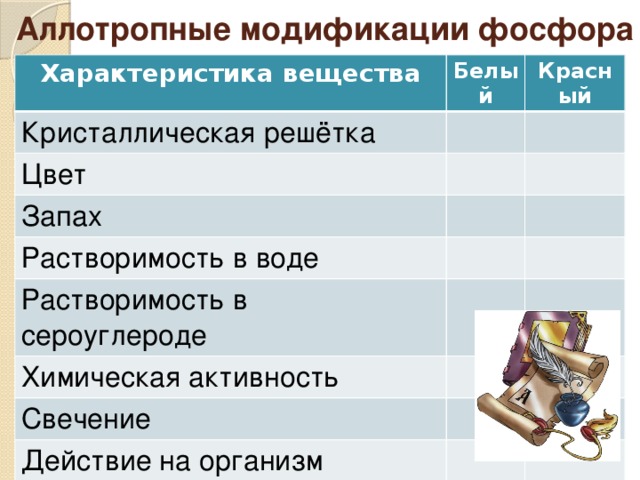
Аллотропные модификации фосфора
Характеристика вещества
Белый
Кристаллическая решётка
Красный
Цвет
Запах
Растворимость в воде
Растворимость в сероуглероде
Химическая активность
Свечение
Действие на организм
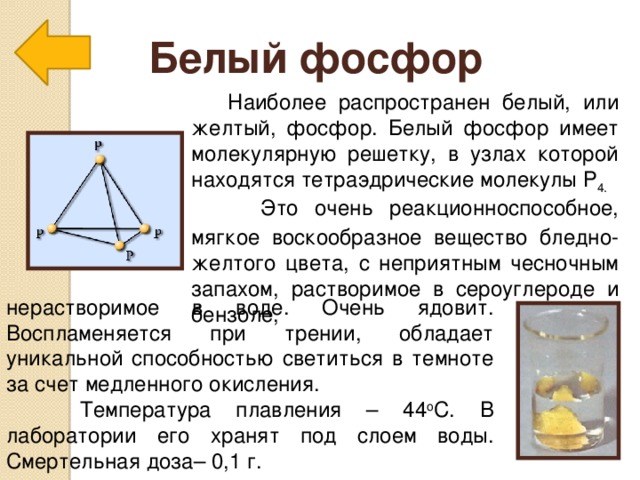
Белый фосфор
Наиболее распространен белый, или желтый, фосфор. Белый фосфор имеет молекулярную решетку, в узлах которой находятся тетраэдрические молекулы Р 4.
Это очень реакционноспособное, мягкое воскообразное вещество бледно-желтого цвета, с неприятным чесночным запахом, растворимое в сероуглероде и бензоле,
Наиболее распространен белый, или желтый, фосфор. Белый фосфор имеет молекулярную решетку, в узлах которой находятся тетраэдрические молекулы Р 4.
Это очень реакционноспособное, мягкое воскообразное вещество бледно-желтого цвета, с неприятным чесночным запахом, растворимое в сероуглероде и бензоле,
нерастворимое в воде. Очень ядовит. Воспламеняется при трении, обладает уникальной способностью светиться в темноте за счет медленного окисления.
Температура плавления – 44 о С. В лаборатории его хранят под слоем воды. Смертельная доза– 0,1 г.
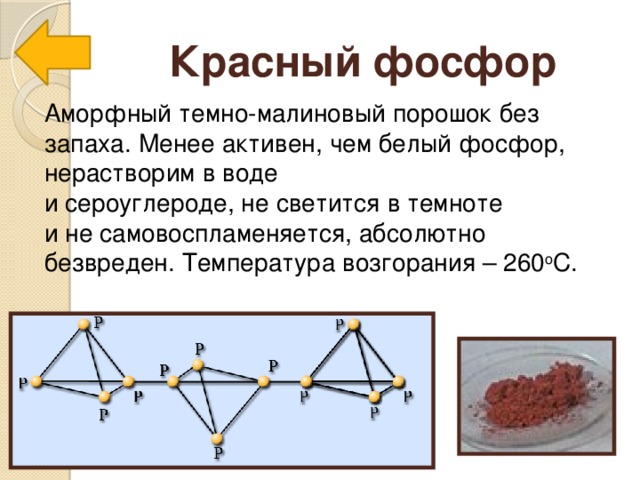
Красный фосфор
Аморфный темно-малиновый порошок без запаха. Менее активен, чем белый фосфор, нерастворим в воде и сероуглероде, не светится в темноте и не самовоспламеняется, абсолютно безвреден. Температура возгорания – 260 о С.

Черный фосфор
Имеет атомную кристаллическую решетку. По внешним признакам черный фосфор напоминает графит, имеет металлический блеск, обладает электропроводностью и теплопроводностью, довольно твердый.
Наименее активный из всех модификаций.
Кубическая модификация
Ромбическая модификация

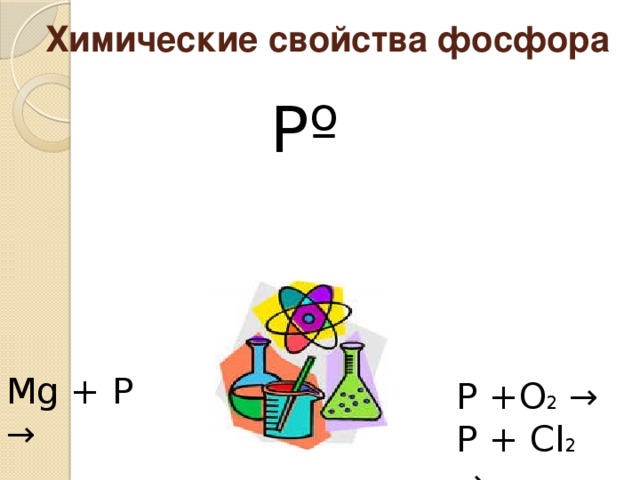
Химические свойства фосфора
Я светоносный элемент.
Я спичку вам зажгу в момент.
Сожгут меня – и под водой
Я сразу стану кислотой.
Взаимодействие фосфора с хлором
Химические свойства фосфора
Рº
Мg + Р →
Р +О 2 →
Р + Сl 2 →
+
-

Найдите ошибку в тексте
«Да! Это была собака, огромная, черная как смоль… Из ее отверстой пасти вырывалось пламя, глаза метали искры, по морде и загривку переливался мерцающий огонь. Ни в чьем воспаленном мозгу не могло бы возникнуть видение более страшное, более омерзительное, чем это адское существо, выскочившее на нас из тумана… Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами. Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте. «Фосфор», – сказал я».
11

Самостоятельная работа
1. Сколько электронов в атоме фосфора находится на внешнем энергетическом уровне?
1) 2 ; 2) 3; 3) 5; 4) 15.
2. Число нейтронов в ядре атома 31 Р:
1) 5; 2) 15; 3) 16; 4) 31.
3. Максимальная степень окисления фосфора в соединениях равна:
1) +6; 2) +5; 3) +3; 4) +4.
4. При взаимодействии фосфора с активными металлами образуются соединения, в которых его степень окисления равна:
1) -3; 2) 0; 3) +3; 4) +5.
5. Среди перечисленных элементов V группы типичным неметаллом является:
1) фосфор; 2) мышьяк; 3) сурьма; 4) висмут.
6. В соединениях РН 3 , Р 2 0 5 , Н 3 Р0 3 фосфор имеет степени окисления, соответственно равные:
1) +3; +5; -3; 2) -3; +5; +3; 3) -3; +3; +5; 4) +3; -5; -3.

Рефлексия
- сегодня я узнал…
- было интересно…
- было трудно…
- я выполнял задания…
- я понял, что…
- теперь я могу…
- я почувствовал, что…
- я приобрел…
- я научился…
- у меня получилось …
- я смог…
- я попробую…
- меня удивило…
- урок дал мне для жизни…
- мне захотелось…

Домашнее задание
§ 28, упр. 1-7