
Щелочные металлы

Положение в периодической системе химических элементов Д.И.Менделеева
- I группа главная подгруппа.
Увеличивается радиус атомов ,
растет восстановительная способность
![Общая характеристика элементов I группы главной подгруппы Восстано-вительные свойства соединения Метал-лические свойства Атомный радиус Валентные Аr элемент электроны увеличиваются увеличиваются Li 2 O, LiOH основные свойства Li 7 2s 1 )) Na 2 O, NaOH основные свойства ))) 3s 1 Na 23 K 2 O, KOH основные свойства )))) K 39 4s 1 Rb 2 O, RbOH основные свойства Изучение нового материала. Все сведения не появляются сразу, а имеется возможность входе беседы с учащимися проверить их мнение и вместе дать общую характеристику щелочных металлов по их положению в таблице. Rb 85 ))))) 5s 1 Cs 2 O, CsOH основные свойства Cs )))))) 6s 1 133 Радиоактивный элемент ))))))) [223] 7s 1 Fr](https://fsd.multiurok.ru/html/2018/02/03/s_5a75983143821/img2.jpg)
Общая характеристика
элементов I группы главной подгруппы
Восстано-вительные свойства
соединения
Метал-лические свойства
Атомный радиус
Валентные
Аr
элемент
электроны
увеличиваются
увеличиваются
Li 2 O, LiOH
основные свойства
Li
7
2s 1
))
Na 2 O, NaOH
основные свойства
)))
3s 1
Na
23
K 2 O, KOH
основные свойства
))))
K
39
4s 1
Rb 2 O, RbOH
основные свойства
Изучение нового материала. Все сведения не появляются сразу, а имеется возможность входе беседы с учащимися проверить их мнение и вместе дать общую характеристику щелочных металлов по их положению в таблице.
Rb
85
)))))
5s 1
Cs 2 O, CsOH
основные свойства
Cs
))))))
6s 1
133
Радиоактивный
элемент
)))))))
[223]
7s 1
Fr

Физические свойства щелочных металлов
Металлическая кристаллическая решетка
Li
Rb
Na
Cs
K
Твердые вещества серебристо-белого цвета
Электропроводны и теплопроводны
Легкоплавкие. пластичные

Щелочные металлы – простые вещества
Литий и натрий - мягкие щелочные металлы серебристо-белого цвета
Натрий – мягкий металл, его можно резать ножом .
Натрий
Литий

Щелочные металлы
Калий и рубидий
мягкие щелочные металлы серебристо-белого цвета
Рубидий
Калий

цезий
Цезий 99,99999% в ампуле
Мягкий щелочной металл золотисто-белого цвета
Щелочные металлы

Франций
Уран(235),
из которого получают франций
- Франций - щелочной металл, обладающий как радиоактивностью, так и высокой химической активностью . Не имеет стабильных изотопов
Франций-223 (самый долгоживущий из изотопов франция, период полураспада 22,3 минуты) содержится в одной из побочных ветвей радиоактивного ряда урана-235 и может быть выделен из природных урановых минералов

Химические свойства щелочных металлов
- Типичные металлы, очень сильные восстановители. В соединениях проявляют единственную степень окисления +1. Восстановительная способность увеличивается с ростом атомной массы. Взаимодействуют с водой с образованием гидроксидов ( R–OH ) щёлочей.
- Воспламеняются на воздухе при умеренном нагревании. С водородом образуют солеобразные гидриды. Продукты сгорания чаще всего пероксиды (кроме лития).
- Восстановительная способность увеличивается в ряду Li–Na–K–Rb–Cs

Химические свойства
2/3/18
- 2Na + Cl 2 = 2NaCl (в атмосфере F 2 и Cl 2 щелочные Me самовоспламеняются)
- 4Li + O 2 = 2Li 2 O 2Na + O 2 = Na 2 O 2 K + O 2 = KO 2
оксид Li пероксид Na надпероксид K
3) 2Na + Н 2 = 2NaН (при нагревании 200-400 o C)
4) 6Li + N 2 = 2Li 3 N (Li - при комнатной T, остальные щелочные Me -при нагревании)
5) 2Na + 2Н 2 О = 2NaОН + Н 2
( Li - спокойно, Na - энергично,
остальные – со взрывом –
воспламеняется выделяющийся Н 2
Rb и Cs реагируют не только
с жидкой Н 2 О , но и со льдом. .
6) 2Na+ Н 2 SО 4 = Na 2 SО 4 + Н 2
(протекают очень бурно)
4

Гидроксиды
- KOH – едкое кали
- NaOH – едкий натр, каустическая сода, каустик
Образование гидроксидов
K 2 O + H 2 O= 2KOH
- Гидроксиды щелочных металлов, кроме Li, термостойки и не разрушаются от температуры.
- Гидроксиды реагируют с
Кислотами
2KOH + H 2 SO 4 = K 2 SO 4 + 2H 2 O
Кислотными оксидами
2KOH + SO 3 = K 2 SO 4 + 2H 2 O
Солями (если образуется нерастворимое основание).
2NaOH + CuSO 4 = Cu(OH) 2 + Na 2 SO 4

Качественное определение щелочных металлов
2/3/18
Для распознавания соединений щелочных металлов по окраске пламени исследуемое вещество вносится в пламя горелки на кончике железной проволоки.
Li+ - карминово-красный K+ - фиолетовый Cs+ фиолетово-синий
Na+ - желтый Rb + - красный
Li+ Na+ K+
4
2/3/18
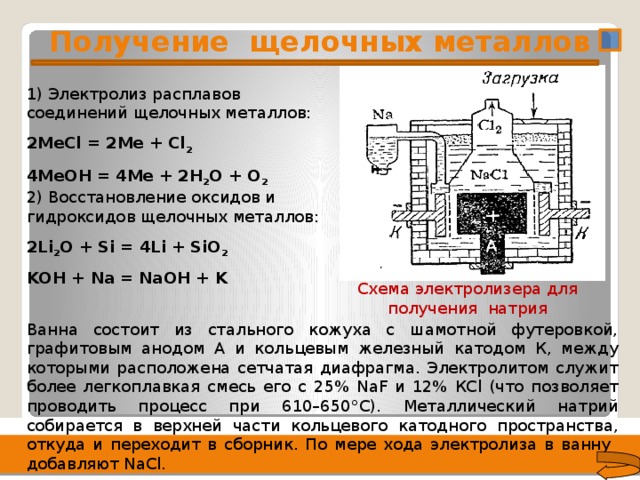
Получение щелочных металлов
1) Электролиз расплавов соединений щелочных металлов:
2МеCl = 2Ме + Cl 2
4МеOH = 4Ме + 2Н 2 О + О 2
2) Восстановление оксидов и гидроксидов щелочных металлов:
2Li 2 O + Si = 4Li + SiO 2
KOH + Na = NаOH + K
Схема электролизера для получения натрия
Ванна состоит из стального кожуха с шамотной футеровкой, графитовым анодом А и кольцевым железный катодом К, между которыми расположена сетчатая диафрагма. Электролитом служит более легкоплавкая смесь его с 25% NaF и 12% КСl (что позволяет проводить процесс при 610–650°С). Металлический натрий собирается в верхней части кольцевого катодного пространства, откуда и переходит в сборник. По мере хода электролиза в ванну добавляют NaCl.
4

Применение щелочных металлов
4

Биологическая роль и применение
Соединений калия и натрия
Раствор хлорида натрия (0,9%) применяется в медицине. Такой раствор называется физиологическим
Питьевая сода применяется в кулинарии, для выпечки кондитерских изделий.
Хлорид натрия - как добавка к пище
Сколько воды и хлорида натрия нужно взять для приготовления физиологического раствора
массой 0,5 кг?
Хлорид калия - очень ценное минеральное удобрение. Рассчитайте массовую долю калия (%) в этом веществе.
Смесь хлорида и гидрокарбоната натрия массой 15 г обработали уксусной кислотой, при этом выделилось 2,8 л (н.у.) газа. Определите массовые доли в процентах компонентов смеси.
Тривиальные названия солей:
70% NaHCO 3
4,5г соли
495,5 г воды
52%
Поваренная соль
30% NaCl
ответ
ответ
Калийные удобрения играю важную роль в жизни растений.
Для работы слайда необходимо кликнуть мышью на любой синий прямоугольник. Для 1-3 ячейки таблицы это задача. Для 4 ячейки - проверка знаний тривиальных названий веществ.
NaCl
K 2 CO 3
поташ
KNO 3
Калийная селитра
Na 2 CO 3 *10H 2 O
Кристалли-ческая сода
ответ
Na 2 SO 4 *10H 2 O
NaHCO 3
Глауберова соль
Питьевая сода
15
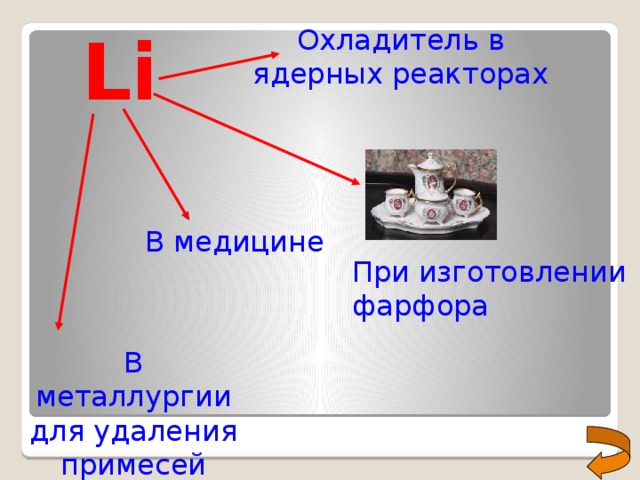
Li
Охладитель в ядерных реакторах
В медицине
При изготовлении фарфора
В металлургии для удаления примесей
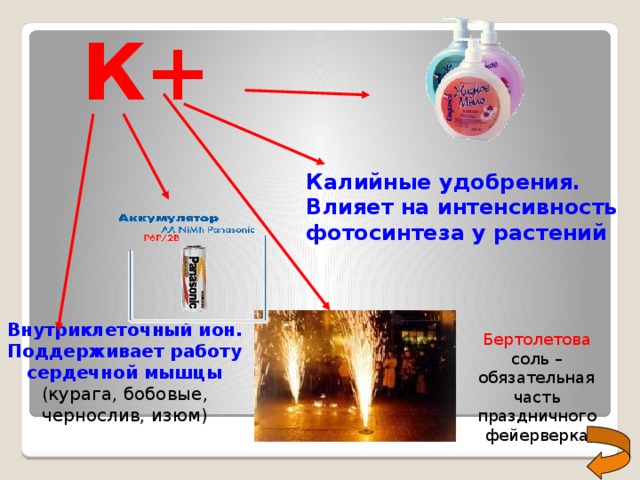
К+
Калийные удобрения. Влияет на интенсивность фотосинтеза у растений
Внутриклеточный ион. Поддерживает работу сердечной мышцы (курага, бобовые, чернослив, изюм)
Бертолетова соль – обязательная часть праздничного фейерверка

Na+ внеклеточный ион (содержится в крови и лимфе)
15
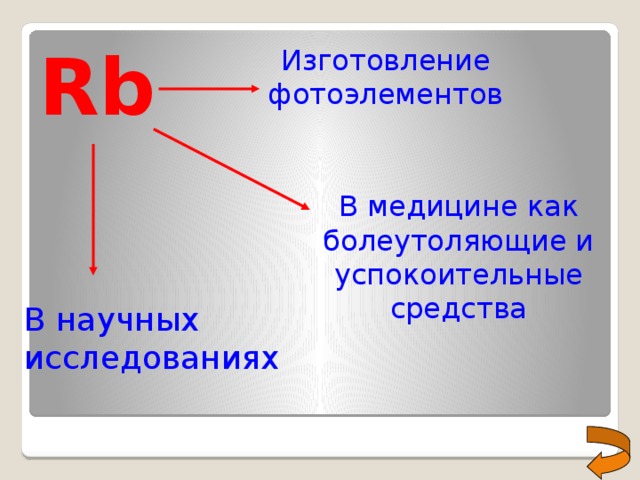
Rb
Изготовление фотоэлементов
В медицине как болеутоляющие и успокоительные средства
В научных исследованиях
15
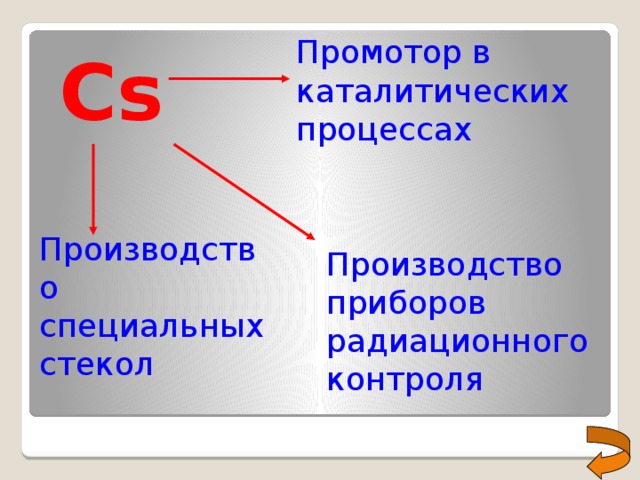
Промотор в каталитических процессах
Cs
Производство специальных стекол
Производство приборов радиационного контроля
15
![2/3/18 Фотография Описание минерала Химический состав LiAl[Si 2 O 6 ] Цвет Бесцветный, красный, желтый, зеленый Плотность 3,1—3,2 г/см 3 Твердость 6,5 Сподуменн](https://fsd.multiurok.ru/html/2018/02/03/s_5a75983143821/img20.jpg)
2/3/18
Фотография
Описание минерала
Химический состав
LiAl[Si 2 O 6 ]
Цвет
Бесцветный, красный, желтый, зеленый
Плотность
3,1—3,2 г/см 3
Твердость
6,5
Сподуменн
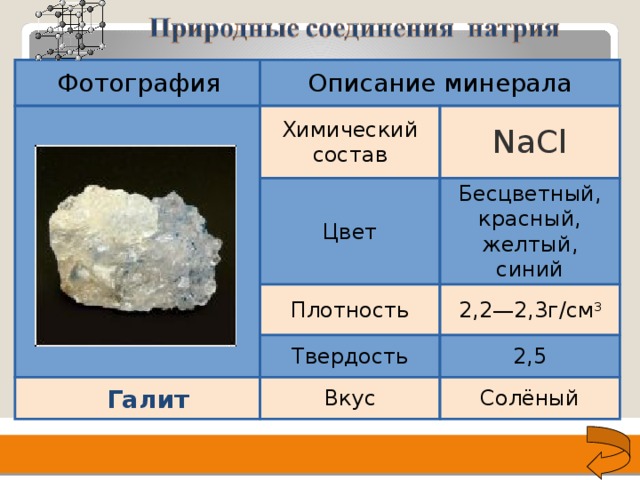
2/3/18
Фотография
Описание минерала
Химический состав
NaСl
Цвет
Бесцветный, красный, желтый, синий
Плотность
2,2—2,3г/см 3
Твердость
2,5
Вкус
Солёный
Галит
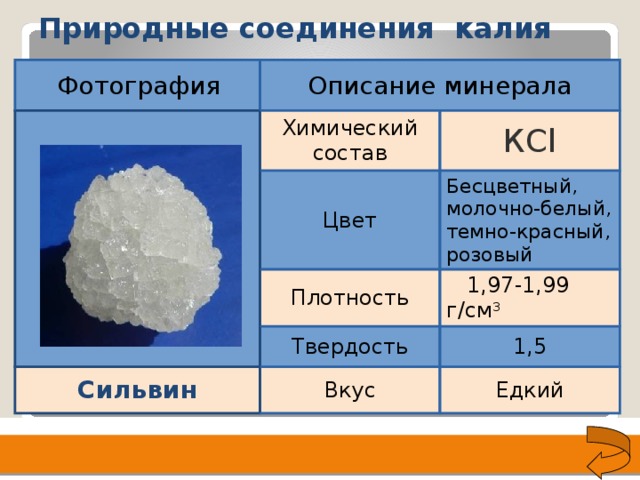
2/3/18
Природные соединения калия
Фотография
Описание минерала
Химический состав
КСl
Цвет
Бесцветный, молочно-белый, темно-красный, розовый
Плотность
Твердость
1,97-1,99 г/см 3
Вкус
1,5
Едкий
Сильвин
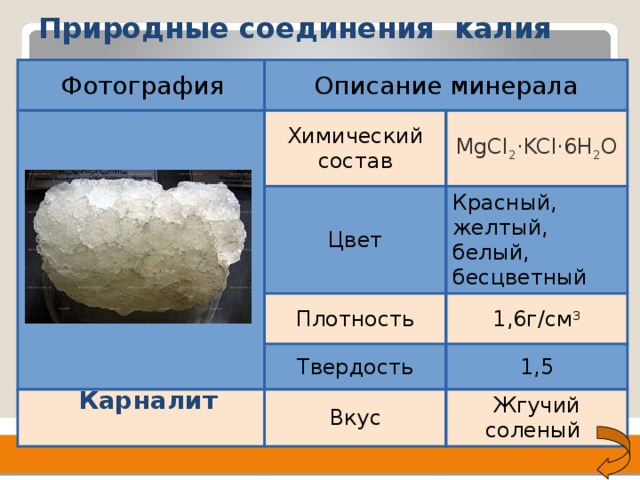
2/3/18
Природные соединения калия
Фотография
Описание минерала
Химический состав
MgCl 2 ·KCl·6H 2 O
Цвет
Красный, желтый, белый, бесцветный
Плотность
Твердость
1,6г/см 3
Вкус
1,5
Жгучий соленый
Карналит

2/3/18
Спасибо за урок!









![Общая характеристика элементов I группы главной подгруппы Восстано-вительные свойства соединения Метал-лические свойства Атомный радиус Валентные Аr элемент электроны увеличиваются увеличиваются Li 2 O, LiOH основные свойства Li 7 2s 1 )) Na 2 O, NaOH основные свойства ))) 3s 1 Na 23 K 2 O, KOH основные свойства )))) K 39 4s 1 Rb 2 O, RbOH основные свойства Изучение нового материала. Все сведения не появляются сразу, а имеется возможность входе беседы с учащимися проверить их мнение и вместе дать общую характеристику щелочных металлов по их положению в таблице. Rb 85 ))))) 5s 1 Cs 2 O, CsOH основные свойства Cs )))))) 6s 1 133 Радиоактивный элемент ))))))) [223] 7s 1 Fr](https://fsd.multiurok.ru/html/2018/02/03/s_5a75983143821/img2.jpg)

















![2/3/18 Фотография Описание минерала Химический состав LiAl[Si 2 O 6 ] Цвет Бесцветный, красный, желтый, зеленый Плотность 3,1—3,2 г/см 3 Твердость 6,5 Сподуменн](https://fsd.multiurok.ru/html/2018/02/03/s_5a75983143821/img20.jpg)














