Управление образования муниципального района «Печора»
МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 9» г. Печора
Программа элективного курса
«Химия в задачах и упражнениях»
для 8 класса основного общего образования
Автор: Колдакова Ирина Владимировна, учитель химии и биологии
2018 г.
г. Печора
Аннотация
Элективный курс «Химия в задачах и упражнениях» предназначен для учащихся 8 классов и носит предметно-ориентированный характер.
Решение расчетных задач и выполнение различных упражнений является важным элементом изучения курса химии, поскольку позволяет лучше усвоить и систематизировать теоретический материал. Без практики решения задач знания учащихся бывают сильно формализованы, поэтому данному элементу обучения следует уделять особое внимание.
Прохождение курса даст возможность лучше и глубже изучить и понять многие химические процессы и закономерности, а так же даст возможность выработать элементарный навык в решении задач, чего очень часто не хватает на уроках при прохождении программы. При этом важно решать задачи и выполнять упражнения регулярно, по всем изучаемым темам.
Подобранные задачи и упражнения в данной методической разработке помогут учителям химии сформировать у учащихся базовые умения и навыки по химии, а также развить интерес к предмету, чтобы в дальнейшем учащиеся могли выбрать профильную программу. Содержание программы соответствует учебнику Г.Е. Рудзитиса, Ф.Г. Фельдмана «Химия. 8 класс».
Пояснительная записка
Современный стандарт содержания образования по химии предусматривает создание условий для достижения учащимися следующих целей:
-
освоение основных понятий и законов химии;
-
овладение умениями производить расчёты на основе химических формул веществ и уравнений химических реакций;
-
развитие познавательных интересов и интеллектуальных способностей в процессе проведения химического эксперимента;
-
самостоятельного приобретения знаний в соответствии с возникающими жизненными потребностями;
-
применение полученных знаний и умений для решения практических задач в повседневной жизни;
-
воспитание отношения к химии как к одному из фундаментальных компонентов естествознания и элементу общечеловеческой культуры.
Решение задач – признанное средство развития логического мышления учащихся, которое легко сочетается с другими средствами и приёмами образования. Включение разных задач предусматривает перенос теоретического материала на практику и осуществляет контроль за его усвоением, а учащимся – самоконтроль, что воспитывает их самостоятельность в учебной работе. Решение задач должно способствовать целостному усвоению стандарта содержания образования и
реализации поставленных целей.
Цель курса: добиться сознательного усвоения учащимися теоретического материала по химии, умения использовать при решении задач совокупности приобретенных теоретических знаний.
Основные задачи:
-
систематизировать теоретический материал;
-
отработать навыки решения задач (по формулам и по уравнениям реакций);
-
отработать навыки написания уравнений химических реакций, характеризующие свойства веществ;
-
развивать умения применять теоретические знания при решении расчетных и качественных задач;
-
подготовить учащихся к успешному изучению учебного предмета на следующей ступени.
Содержание элективного курса соответствует минимальным требованиям стандарта образования, а также содержит некоторый материал по углублению курса химии в 8 классе, на который следует обратить внимание для успешного изучения далее (кристаллогидраты, различные способы выражения состава раствора, качественные реакции, решение комбинированных задач). Каждая тема содержит небольшой теоретический материал, а главное – большое количество различных задач. Это необходимо для формирования и развития навыков анализа, сравнения, обобщения, самоанализа и самоконтроля, умений устанавливать причинно-следственные связи между различными фактами, умений делать выводы, отстаивать свою точку зрения.
Вниманию учащимся предлагаются различные задания по содержанию и по сложности, которые требуют от учащихся активной познавательной деятельности.
В процессе работы используются следующие приемы и методы: рассказ, беседа, химический эксперимент; решение задач по формулам и по уравнениям реакций, составление: формул веществ по валентности, уравнений химических реакций.
Формами отчётности по изучению данного элективного курса могут быть:
-
конкурс (количественный) числа решённых задач;
-
зачёт по решению задач;
-
самостоятельное составление творческих расчётных задач по различным темам (например «медицина», «экология»).
Продолжительность курса 34 часа и предполагает изучение его в течение всего года по 1 часу в неделю.
Результаты освоения данного курса:
-
формирование целостного мировоззрения, соответствующего современному уровню развития науки и общественной практики;
-
формирование ответственного отношения к учению, готовности и способности учащихся к саморазвитию и самообразованию на основе мотивации к обучению и познанию, осознанному выбору и построению дальнейшей индивидуальной траектории образования на базе ориентировки в мире профессий и профессиональных предпочтений, с учетом устойчивых познавательных интересов;
-
формирование коммуникативной компетентности в процессе образовательной и учебно-исследовательской деятельности;
-
формирование познавательной и информационной культуры, в том числе развитие навыков самостоятельной работы с учебными пособиями, книгами, доступными инструментами и техническими средствами информационных технологий;
-
развитие готовности к решению творческих задач, умения находить адекватные способы поведения и взаимодействия с партнерами во время учебной деятельности.
-
умение самостоятельно определять цели своего обучения, ставить и формулировать для себя новые задачи в учебе и познавательной деятельности, развивать мотивы и интересы своей познавательной деятельности;
-
умение самостоятельно планировать пути достижения целей, в том числе альтернативные, осознанно выбирать наиболее эффективные способы решения учебных и познавательных задач;
-
умение соотносить свои действия с планируемыми результатами, осуществлять контроль своей деятельности в процессе достижения результата, определять способы действий в рамках предложенных условий;
-
умение оценивать правильность выполнения учебной задачи, собственные возможности ее решения;
-
владение основами самоконтроля, самооценки;
-
умение определять понятия, создавать обобщения, устанавливать аналогии, классифицировать, устанавливать причинно-следственные связи, строить логическое рассуждение и делать выводы;
-
умение создавать, применять и преобразовывать знаки и символы, модели и схемы для решения учебных и познавательных задач;
-
смысловое чтение;
-
умение организовывать учебное сотрудничество и совместную деятельность с учителем и сверстниками; работать индивидуально и в группе: находить общее решение; формулировать, аргументировать и отстаивать свое мнение;
-
формирование первоначальных систематизированных представлений о веществах, их превращениях и практическом применении; овладение понятийным аппаратом и символическим языком химии;
-
осознание объективной значимости основ химической науки как области современного естествознания, химических превращений неорганических и органических веществ как основы многих явлений живой и неживой природы; углубление представлений о материальном единстве мира;
-
формирование умений устанавливать связи между реально наблюдаемыми химическими явлениями и процессами, происходящими в микромире, объяснять причины многообразия веществ, зависимость их свойств от состава и строения, а также зависимость применения веществ от их свойств;
-
приобретение опыта использования различных методов изучения веществ: наблюдения за их превращениями при проведении несложных химических экспериментов с использованием лабораторного оборудования и приборов;
-
овладение приемами работы с информацией химического содержания, представленной в разной форме (в виде текста, формул, графиков, табличных данных, схем и др.);
-
создание основы для формирования интереса к расширению и углублению химических знаний и выбора химии как профильного предмета при переходе на ступень среднего общего образования, а в дальнейшем и в качестве сферы своей профессиональной деятельности.
Содержание курса
Введение в курс
Предмет химии. Химия как часть естествознания. Химия – наука о веществах, их строении, свойствах и превращениях.
РАЗДЕЛ 1. Химическая формула вещества
Атом, молекула и ион. Химический элемент. Вещества молекулярного и немолекулярного строения. Простые и сложные вещества. Относительная атомная масса. Атомная единица массы. Язык химии. Знаки химических элементов. Закон постоянства состава вещества. Химические формулы. Относительная молекулярная масса. Качественный и количественный состав вещества. Индексы. Массовая доля химического элемента в сложном веществе. Валентность и степень окисления химических элементов.
Вычисление относительной молекулярной массы вещества по формуле.
Вычисление массовой доли элемента в химическом соединении.
Установление простейшей формулы вещества по массовым долям химических элементов.
Составление формул веществ по валентности.
РАЗДЕЛ 2. Уравнения химических реакций
Закон сохранения массы веществ. Реакции соединения, разложения, замещения, обмена. Коэффициент.
Кислород. Получение кислорода в лаборатории и промышленности. Физические и химические свойства кислорода. Горение. Оксиды.
Водород. Получение водорода в лаборатории и промышленности. Физические и химические свойства водорода. Водород – восстановитель.
Составление уравнений различных типов.
Составление уравнений химических реакций, характеризующих свойства кислорода и водорода.
РАЗДЕЛ 3. Растворы
Вода – растворитель. Растворимость веществ в воде. Растворы насыщенные, ненасыщенные, пересыщенные. Кривая растворимости. Массовая доля растворенного вещества. Кристаллогидраты.
Вычисление массовой доли растворенного вещества в растворе.
Вычисление массы растворенного вещества и воды для приготовления раствора определенной концентрации.
Решение задач на кристаллогидраты.
РАЗДЕЛ 4. Количество вещества
Количественные отношения в химии. Количество вещества. Моль. Молярная масса. Закон Авогадро. Молярный объем газов. Расчетные формулы. Относительная плотность газов. Объемные отношения газов при химических реакциях.
Вычисления по формулам количества, объема, массы вещества.
Вычисления по химическим уравнениям количества, объема, массы вещества по количеству, объему, массе реагентов или продуктов реакции.
Расчет относительной плотности газов.
Объемные отношения газов при химических реакциях.
Вычисления по химическим уравнениям количества, объема, массы одного из продуктов реакции по количеству, объему, массе исходного вещества, содержащего определенную долю примесей.
Решение задач, когда одно из реагирующих веществ дано в избытке.
РАЗДЕЛ 5. Основные классы неорганических соединений
Основные классы неорганических соединений. Химические свойства оксидов, оснований, кислот, солей. Качественные реакции. Генетическая связь между основными классами неорганических соединений.
Решение генетических цепочек превращений.
Решение комбинированных задач на нахождение массы, объема продукта реакции с использованием массовой доли вещества в растворе, плотности раствора.
Тематический план
| Разделы | Всего часов | Теоретические занятия | Практические занятия |
| Введение | 1 | 1 |
|
| 1. Химическая формула вещества | 6 | 6 |
|
| 2. Уравнения химических реакций | 4 | 4 |
|
| 3. Растворы | 4 | 3 | 1 |
| 4. Количество вещества | 9 | 9 |
|
| 5. Основные классы неорганических соединений | 8 | 5 | 3 |
| Итоговая проверка знаний | 2 | 2 |
|
| Итого | 34 | 30 | 4 |
Содержание учебного материала
| Раздел и количество часов | Название тем | Характеристика основных видов деятельности учащихся |
| Введение
1 час | 1.Знакомство с целями и задачами курса, его структурой. Основные этапы в истории развития химии. | - ставят учебные задачи на основе того, что уже известно и, того, что ещё не известно; - формируют ответственное отношение к учению. |
| 1. Химическая формула вещества
6 часов | 2. Формы существования элементов. Химические формулы. | - различают понятия «атом», «молекула», «химический элемент», «ион», «элементарные частицы». |
| 3. Относительная атомная масса. Относительная молекулярная масса. Расчет относительной молекулярной массы вещества по формуле. | - определяют относительную атомную массу; - рассчитывают относительную молекулярную массу вещества по формулам веществ. |
| 4. Вычисление массовой доли элемента по формуле вещества. | - рассчитывают массовую долю химического элемента в соединении. |
| 5. Вывод формулы вещества. | - устанавливают формулы веществ по массовым долям элементов. |
| 6. Валентность и степень окисления химических элементов. Определение валентности элемента по формуле вещества. | - различают понятия «валентность» и «степень окисления»; - определяют валентность элементов в бинарных соединениях. |
| 7. Составление формул веществ по валентности. | - составляют формулы бинарных соединений по известной валентности элементов. |
| 2. Уравнения химических реакций
4 часа | 8. Составление простейших уравнений химических реакций – расстановка коэффициентов. | - различают понятия «индекс» и «коэффициент», «схема химической реакции» и «уравнение химической реакции»;
|
| 9. Основные типы химических реакций. Составление уравнений химических реакций разных типов. | - изображают простейшие химические реакции с помощью химических уравнений. |
| 10. Составление уравнений химических реакций, характеризующих свойства кислорода. | - изображают химические реакции с помощью химических уравнений. |
| 11. Составление уравнений химических реакций, характеризующих свойства водорода. | - изображают химические реакции с помощью химических уравнений. |
| 3. Растворы
4 часа | 12. Растворимость. Растворы. Разные способы выражения состава раствора. Решение простых задач. | - вычисляют массовую долю растворённого вещества в растворе, массу растворённого вещества и воды для приготовления раствора определённой концентрации. |
| 13. Практическая работа «Различные действия с растворами (разбавление, упаривание, смешивание)». | - соблюдают правила техники безопасности; - формируют навыки работы с лабораторным оборудованием; - описывают явления, наблюдаемые в ходе лабораторного эксперимента; - делают выводы из результатов проведенных химических опытов; - участвуют в совместном обсуждении результатов опытов. |
| 14. Решение комбинированных задач на смешивание растворов. | - используют внутри- и межпредметные связи для решения комбинированных задач. |
| 15. Кристаллогидраты. Решение задач на кристаллогидраты. | - различают понятие «кристаллогидраты». |
| 4. Количество вещества
9 часов | 16. Количество вещества. Расчетные формулы. | - различают понятия «количество вещества», «моль», «молярная масса», «молярный объем»; - знают расчетные формулы и делают простейшие расчеты. |
| 17. Расчет по формулам количества, объема, массы вещества. | - вычисляют по химическим формулам массу, количество, объем вещества. |
| 18. Вычисления по химическим уравнениям количества вещества по количеству, объему, массе реагентов или продуктов реакции. | - используют примеры решения типовых задач, задачники с приведенными в них алгоритмами решения задач; - делают вычисления по химическим уравнениям. |
| 19. Вычисления по химическим уравнениям объема вещества по количеству, объему, массе реагентов или продуктов реакции. | - используют примеры решения типовых задач, задачники с приведенными в них алгоритмами решения задач; - делают вычисления по химическим уравнениям. |
| 20. Вычисления по химическим уравнениям массы вещества по количеству, объему, массе реагентов или продуктов реакции. | - используют примеры решения типовых задач, задачники с приведенными в них алгоритмами решения задач; - делают вычисления по химическим уравнениям. |
| 21. Расчет относительной плотности газов. | - рассчитывают плотность одного газа относительно другого. |
| 22. Объемные отношения газов при химических реакциях. | - вычисляют объемные отношения газов при химических реакциях. |
| 23. Вычисления по химическим уравнениям количества, объема, массы одного из продуктов реакции по количеству, объему, массе исходного вещества, содержащего определенную долю примесей. | - делают вычисления по химическим уравнениям; - участвуют в совместном обсуждении алгоритма решения задач. |
| 24. Решение задач, когда одно из реагирующих веществ дано в избытке. | - участвуют в совместном обсуждении алгоритма решения задач; - делают вычисления по химическим уравнениям. |
| 5. Основные классы неорганических соединений
8 часов | 25. Составление уравнений химических реакций, характеризующих свойства основных классов неорганических соединений. | - характеризуют состав и свойства веществ, относящихся к основным классам неорганических соединений; - записывают уравнения химических реакций. |
| 26. Практическая работа «Качественные реакции на неорганические вещества». | - соблюдают правила техники безопасности; - формируют навыки работы с лабораторным оборудованием; - исследуют свойства изучаемых веществ; - наблюдают физические и химические превращения изучаемых веществ; - описывают химические реакции, наблюдаемые в ходе эксперимента. |
| 27. Практическая работа «Решение экспериментальных задач». | - соблюдают правила техники безопасности; - формируют навыки работы с лабораторным оборудованием; - описывают химические реакции, наблюдаемые в ходе эксперимента; - делают выводы из результатов проведенных химических опытов; - участвуют в совместном обсуждении результатов опытов. |
| 28. Решение цепочек превращений веществ. | - участвуют в совместном обсуждении задания; - записывают уравнения химических реакций, позволяющих осуществить цепочку превращений. |
| 29. Практическая работа «Генетическая связь между основными классами неорганической химии». | - участвуют в совместном обсуждении задания; - соблюдают правила техники безопасности; - формируют навыки работы с лабораторным оборудованием; - описывают химические реакции, наблюдаемые в ходе эксперимента; - участвуют в совместном обсуждении результатов опытов. |
| 30. Решение задач по уравнениям с участием растворов. | - участвуют в совместном обсуждении алгоритма решения задач; - делают вычисления по химическим уравнениям. |
| 31. Решение задач по уравнениям нескольких последовательных реакций. | - участвуют в совместном обсуждении алгоритма решения задач; - делают вычисления по химическим уравнениям. |
| 32. Решения задач по уравнениям реакций, если исходное вещество дано в смеси. | - участвуют в совместном обсуждении алгоритма решения задач; - делают вычисления по химическим уравнениям. |
| Итоговая проверка знаний
2 часа | 33. Итоговая проверка знаний. | - формируют умение интегрировать и использовать полученные навыки и знания; - выбирают наиболее эффективный способ решения задач, контролируют процесс и оценивают результат. |
| 34. Анализ итоговой проверки. | - выражают адекватное понимание причин успеха и неуспеха учебной деятельности. |
В результате изучения данного курса ученик должен:
- знать/понимать:
1) химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций;
2) важнейшие химические понятия: химический элемент, атом, молекула, относительные атомная и молекулярная массы, вещество, классификация веществ, моль, молярная масса, молярный объем, химическая реакция, классификация реакций;
3) основные законы химии: сохранения массы веществ, постоянства состава.
- уметь:
1) называть соединения изученных классов;
2) характеризовать: связь между составом, строением и свойствами веществ; химические свойства основных классов неорганических веществ; 3) определять: состав веществ по их формулам, принадлежность веществ к определенному классу соединений, типы химических реакций, валентность и степень окисления элемента в соединениях;
4) составлять: формулы неорганических соединений изученных классов; уравнения
химических реакций; 5) обращаться с химической посудой и лабораторным оборудованием; 6) распознавать опытным путем изученные вещества;
7) вычислять: массовую долю химического элемента по формуле соединения; массовую долю вещества в растворе; количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции; массу продуктов реакции, если один из реагентов дан в избытке; массу продуктов реакции, если реагент дан в смеси.
Список использованной литературы
-
Боровских, Т.А. Рабочая тетрадь по химии: 8 класс: к учебнику Г.Е. Рудзитиса, Ф.Г. Фельдмана «Химия: 8 класс». ФГОС / Т.А. Боровских – М.: Издательство «Экзамен», 2015. - 95 с.
-
Боровских, Т.А. Тесты по химии: 8 класс: к учебнику Г.Е. Рудзитиса, Ф.Г. Фельдмана «Химия: 8 класс». ФГОС / Т.А. Боровских – М.: Издательство «Экзамен», 2013. - 93 с.
-
Брейгер, Л.М. Химия. 8 класс: контрольные и самостоятельные работы, тесты / Л.М.Брейгер. – Волгоград: Учитель, 2006.- 134 с.
-
Зуева, М.В. Контрольные и проверочные работы по химии. 8 - 9 класс: Метод. пособие / М.В. Зуева, Н.Н. Гара. – М.: Дрофа, 1997.- 160 с.
-
Кузнецова, Н.Е. Задачник по химии: 8 класс / Н.Е. Кузнецова, А.Н. Лёвкин. – М.: Вентана-Граф, 2004.- 128 с.
-
Кузнецова, Н.Е. Задачник по химии для учащихся 9 класса общеобразовательных учреждений / Н.Е. Кузнецова, А.Н. Лёвкин. – М.: Вентана-Граф, 2005.- 128 с.
-
Рябов, М.А. Сборник задач и упражнений по химии: 8 класс: к учебнику Г.Е. Рудзитиса, Ф.Г. Фельдмана «Химия: 8 класс» / М.А. Рябов. – М.: Издательство «Экзамен», 2015. - 254 с.
-
Хомченко, Г.П. Сборник задач по химии для поступающих в вузы / Г.П. Хомченко, И.Г. Хомченко. – М.: Издательство Новая Волна, 2002. - 278 с.
-
Хомченко, И.Г. Сборник задач и упражнений по химии для средней школы / И.Г. Хомченко. – М.: Издательство Новая Волна, 1997. - 221 с.
-
сайт: http://litcey.ru/himiya/2184/index.html
-
сайт: http://www.fipi.ru/about/news/publikaciya-proektov-demoversiy-kim-ege-i-oge-2015-goda
-
сайт: https://chem-oge.sdamgia.ru/
-
ПРИЛОЖЕНИЕ
Подбор заданий к разделу 1: Химическая формула вещества
ЗАДАНИЕ 1: из следующих высказываний выберите те, в которых говорится о химическом элементе, и те, в которых говорится о простом веществе:
-
Кислород необходим для дыхания;
-
Горение магния;
-
Водород входит в состав воды;
-
Ржавление железа;
-
Круговорот азота в природе;
-
В состав зубной пасты входит фтор;
-
Молекула хлора двухатомна;
-
Температура плавления кальция 8420С;
-
В организме человека примерно 65 % кислорода (по массе);
-
Азот применяют для получения аммиака.
ЗАДАНИЕ 2: объясните, что означают записи:
| Cl1- | 4Fe | 5H2O | 2O | O2 | O3 | 10N | Ca2+ | 2N2O5 | H3PO4 |
ЗАДАНИЕ 3: составьте формулу вещества, молекула которого состоит:
1. из трёх атомов калия, одного атома фосфора и четырёх атомов кислорода
2. из одного атома магния, одного атома серы и четырёх атомов кислорода
3. из одного атома кальция, одного атома серы и четырёх атомов кислорода
4. из одного атома цинка, двух групп, состоящих из одного атома кислорода и одного атома водорода
5. из двух атомов водорода, одного атома углерода и трёх атомов кислорода
6. из одного атома кальция, одного атома углерода и трёх атомов кислорода
7. из одного атома калия, одного атома кислорода и одного атома водорода
8. из двух атомов калия, одного атома серы и четырёх атомов кислорода
9. из двух атомов натрия, одного атома серы и трёх атомов кислорода
10. из одного атома серебра, одного атома азота и трёх атомов кислорода
ЗАДАНИЕ 1: вычислите относительные молекулярные массы следующих соединений:
| H2SO4 | SF6 | AlPO4 | C2H5OH | NH4NO2 | (CuOH)2CO3 | CH3(CH2)2COOH | Ba3(PO4)2 |
и т.д.
ЗАДАНИЕ 2: сравнить, какое соединение железа имеет большую относительную молекулярную массу:
| FePO4 | Fe(OH)3 | FeS2 | Fe(NO3)2 | Na3[Fe(OH)6] |
ЗАДАНИЕ 3: сравнить, какое соединение углерода имеет меньшую относительную молекулярную массу:
| СO2 | С2H4 | Li2CO3 | CH3COOH | CaC2 |
|
|
|
|
|
|
ЗАДАНИЕ: выполнить тестовые задания
1. Массовая доля серы в Fe2(SO4)3 равна
|
| 1) 24,0% | 2) 32,0% | 3) 8,0% | 4) 33,3% |
2. Массовая доля кислорода в CuSO4 равна
|
| 1) 10,0% | 2) 32,0% | 3) 16,0% | 4) 40,0% |
3. Массовая доля азота в Al(NO3)3 равна
|
| 1) 14,0% | 2) 19,7% | 3) 6,6% | 4) 21,3% |
4. Массовая доля углерода в (NH4)CO3 равна
|
| 1) 14,6% | 2) 8,3% | 3) 4,2% | 4) 12,5% |
5. В каком соединении массовые доли кислорода и серы отличаются в 2 раза?
|
| 1) SO2 | 2) H2SO4 | 3) SO3 | 4) K2SO3 |
6. В каком соединении массовые доли меди и кислорода отличаются в 4 раза?
|
| 1) Cu2O | 2) CuO | 3) CuSO4 | 4) CuSO4∙5H2O |
7. В каком соединении массовая доля железа равна 70%?
|
| 1) FeCl2 | 2) FeSO4∙7H2O | 3) Fe2O3 | 4) Fe3O4 |
8. На какой диаграмме распределение массовых долей элементов соответствует KNO3?
9. На диаграмме изображено распределение массовых долей калия, хрома и кислорода в некотором веществе.
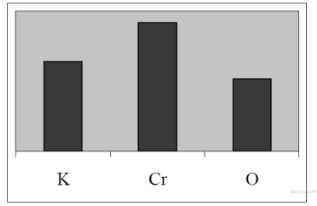 Какому веществу оно соответствует?
Какому веществу оно соответствует?
|
| 1) Cr2O3 | 2) K2CrO4 | 3) K2Cr2O7 | 4) KCrO2 |
10. На какой диаграмме распределение массовых долей элементов соответствует MgCO3?

ЗАДАНИЕ 1: составьте формулы оксидов по следующим данным:
1) марганца, если W(Mn) = 63,2 %
2) хрома, если W(Cr) = 38,8 %
3) фосфора, если W(Р) = 43,66 %
4) меди, если W(Cu) = 88,89 %
5) железа, если W(О) = 30 %
ЗАДАНИЕ 2: определите простейшую формулу соединения:
-
в котором массовая доля калия, углерода и кислорода соответственно равны 56,6%, 8,7% и 34,8%
-
в котором массовая доля натрия, фосфора и кислорода соответственно равны 34,6%, 23,3% и 42,1%
-
в котором массовая доля азота, водорода и кислорода соответственно равны 35%, 5% и 60%
-
в котором массовая доля углерода, водорода, кислорода и хлора соответственно равны 25,4%, 3,17%, 33,86% и 37,57%
-
в котором массовая доля кислорода равна 100%
ЗАДАНИЕ 1: определите валентности элементов по формуле:
| NH3 | CrO3 | FeO | Mn2O7 | PbF2 | NaH | Cu2O | Ca3P2 | Cl2O | FeF3 |
ЗАДАНИЕ 2:
1. Степень окисления −4, а валентность IV атом углерода имеет в соединении
|
| 1) CO2 | 2) CH4 | 3) H2CO3 | 4) CCl4 |
2. Валентность каждого из элементов равна II в веществе
|
| 1) AlN | 2) H2O2 | 3) H2S | 4) MgS |
3. Атом азота проявляет валентность, отличную от III, в молекуле
|
| 1) HNO3 | 2) NaNO2 | 3) N2O3 | 4) NH3 |
4. Такую же степень окисления, как и в N2O5, азот имеет в соединении
|
| 1) NO2 | 2) KNO2 | 3) NaNO3 | 4) HNO2 |
5. В какой молекуле валентность серы равна II?
|
| 1) H2S | 2) SO2 | 3) SO3 | 4) H2SO4 |
6. В какой молекуле валентность азота равна IV?
|
| 1) NH3 | 2) NO2 | 3) NO | 4) KNO3 |
7. В каком соединении степень окисления хлора равна +7?
|
| 1) HCl | 2) Cl2O | 3) KClO3 | 4) HClO4 |
8. В каком соединении степень окисления фосфора равна +3?
|
| 1) PH3 | 2) PCl3 | 3) HPO3 | 4) H3PO4 |
9. В каком соединении степень окисления азота равна +3?
|
| 1) Na3N | 2) NH3 | 3) N2О | 4) HNO2 |
10. Валентность VI сера проявляет в молекуле
|
| 1) H2S | 2) H2SO4 | 3) SO2 | 4) S8 |
ЗАДАНИЕ 1: составьте формулы соединений, состоящие из пар элементов
-
калия и серы (В = II)
-
фосфора (B = III) и натрия
-
кальция и хлора (B = I)
-
азота (B = III) и магния
-
алюминия и кислорода
-
цинка и брома (B = I)
-
серы (B = II) и алюминия
-
водорода и бария (B = II)
-
лития (B = I) и кислорода
-
азота (B = III) и натрия
-
кальция и серы (B = II)
-
кальция и углерода (B = IV)
-
кислорода и серебра (B = I)
-
хлора (B = I) и калия
-
фосфора (B = III) и магния
ЗАДАНИЕ 2: составьте формулы соединений, состоящие из следующих катионов и анионов
-
Na1+ и SO42-
-
Al3+ и PO43-
-
Ca2+ и NO31-
-
Zn2+ и OH1-
-
K1+ и SiO32-
-
NH41+ и SO32-
-
Mg2+ и Cl1-
-
Fe3+ и NO31-
-
Na1+ и CO32-
-
H1+ и SO42-
Подбор заданий к разделу 2: Уравнения химических реакций
ЗАДАНИЕ: преобразуйте схемы реакций в уравнения
-
Ca + P – Ca3P2 -
H2 + Cl2 – HCl -
Al + Cl2 – AlCl3 -
HgO – Hg + O2 -
N2 + O2 – N2O5 -
Al + S – Al2S3 -
N2 + O2 – NO -
P + O2 – P2O3 -
Ag2O – Ag + O2 -
Na + H2 – NaH |
|
ЗАДАНИЕ: расставьте коэффициенты, преобразовав схемы в уравнения реакций. Укажите типы реакций
-
H2O2 – H2 + O2 -
Fe + H2O – Fe3O4 + H2 -
N2O5 + Na2O – NaNO3 -
LiOH + H3PO4 – Li3PO4 + H2O -
KClO3 – KCl + O2 | -
Mg + HCl – MgCl2 + H2 -
Fe + Cl2 – FeCl3 -
MgCl2+ AgNO3 – AgCl + Mg(NO3)2 -
(NH4)2Cr2O7 – N2 + Cr2O3 + H2O -
NaOH + H2SO4 – Na2SO4 + H2O |
ЗАДАНИЕ: тестовое задание
1. Какое уравнение соответствует реакции разложения?
| 1) 2AgI → 2Ag + I2 3) Ca(OH)2 + CO2 → CaCO3 + H2O | 2) 2HCl + Ba(OH)2 → 2H2O + BaCl2 4) Na2S + Br2 → 2NaBr + S |
2. Какое уравнение соответствует реакции обмена?
| 1) CuCl2 + Fe → Cu + FeCl2 3) 2KOH + H2SO4 → K2SO4 + 2H2O | 2) 2Al + Fe2O3 → Al2O3 + 2Fe 4) 2Na + O2 → Na2O2 |
3. Какое уравнение соответствует реакции замещения?
| 1) AlCl3 + 3KOH → Al(OH)3 + 3KCl 3) 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu | 2) 4Al + 3O2 → 2Al2O3 4) 2Al(OH)3 → Al2O3 + 3H2O |
4. Реакция, уравнение которой НCl + NaOH → H2O + NaCl, относится к реакциям
|
| 1) разложения | 2) соединения | 3) замещения | 4) обмена |
5. Реакция замещения с участием оксида меди(II):
| 1) CuO + H2SO4 → H2O + CuSO4 3) CuO + 2HCl → CuCl2 + H2O | 2) CuO + SO3 → CuSO4 4) CuO + H2 → Cu + H2О |
6. Реакция обмена с участием оксида кальция:
| 1) CaO + H2O → Ca(OH)2 3) 3CaO + 2Al → 3Ca + Al2O3 | 2) CaO + 2HCl → CaCl2 + H2O 4) CaO + CO2 → CaCO3 |
7. Пример реакции соединения:
| 1) P2O5 + 5C → 2P+ 5CO 3) H3PO4 +3KOH → K3PO4+ 3H2O | 2) Са3(PO4)2 → P2O5 + 3СаO 4) 4P+ 5O2 → 2P2O5 |
8. В уравнении химической реакции, схема которой Fe2O3 + H2 → Fe + H2O коэффициент перед формулой вещества водорода равен
9. В уравнении химической реакции, схема которой Fe2O3 + HCl → FeCl3 + H2O коэффициент перед формулой соли равен
10. В уравнении реакции между Al(OH)3 и H2SO4 отношение коэффициента при H2O к коэффициенту при другом продукте реакции равно
ЗАДАНИЕ 1: заполните пропуски в схемах реакций
-
Zn + __ → ZnO
-
__ + O2 → Al2O3
-
PH3 + __ → P2O5 + __
-
__ + O2 → NO
-
__ + O2 → SO2 + H2O
ЗАДАНИЕ 2: составьте уравнения реакций горения следующих простых веществ ( в скобках указана валентность данного элемента в получаемом оксиде)
-
Алюминия
-
Магния
-
Водорода
-
Серы (IV)
-
Железа (III)
ЗАДАНИЕ 3: составьте уравнения реакций, с помощью которых можно осуществить превращения:
-
KClO3 → O2 → Fe3O4
-
HgO → O2 → P2O5
-
KMnO4 → O2 → Al2O3
-
H2O → O2 → SO2
-
H2O2 → O2 → CuO
ЗАДАНИЕ 1: заполните пропуски в схемах реакций
-
Ca + HCl → __ + __
-
__ + H2 → KH
-
FeO + __ → Fe + __
-
H2 + Cl2 → __
-
__ + __ → H2S
ЗАДАНИЕ 2: составьте уравнения реакций взаимодействия водорода с
-
Оксидом алюминия
-
Натрием
-
Азотом
-
Оксидом меди (II)
-
Кислородом
ЗАДАНИЕ 3: составьте уравнения реакций, с помощью которых можно осуществить превращения:
-
Mg → H2 → Zn → ZnO
-
H2 → NH3 → NO → NO2
-
KMnO4 → O2 → CuO → Cu
-
HCl → H2 → H2O → O2 → CO
-
H2O2 → O2 → Fe3O4 → Fe
Подбор заданий к разделу 3: Растворы
ЗАДАНИЕ: решить задачи
-
масса соли, которая вводится в организм при вливании 353 г физиологического раствора, содержащего 0,85 % по массе поваренной соли, равна ___ г.
-
какая масса азотной кислоты содержится в 1 л ее 20 %-ного раствора плотностью 1,05 г/мл?
-
плотность 20,8 %-ного раствора азотной кислоты составляет 1,12 г/мл. Молярная концентрация кислоты в этом растворе равна ____ моль/л.
-
молярная концентрация серной кислоты в растворе равна 11,7 моль/л, а плотность раствора составляет 1,62 г/мл. Массовая доля кислоты в этом растворе равна ___ %.
-
массовая доля соли в стакане ёмкостью 350 мл, в который положили одну столовую ложку соли ___ %. В столовую ложку помещается примерно 25 г вещества.
-
до какой массы нужно упарить 300 г 10 %-ного раствора гидроксида калия, чтобы получить 20 %-ный раствор?
-
сколько грамм нитрата калия нужно добавить к 200 г его 10 %-ного раствора, чтобы получить 20 % -ный раствор?
-
к 200 г 10 %-ного раствора KCl добавили 50 г воды. Массовая доля KCl в полученном растворе равна ___ %.
-
сколько граммов воды надо удалить путем выпаривания, чтобы из 200 г 20 %-ного раствора К2SO4 получить 30 %-ный раствор этой соли?
-
масса 70 %-ной уксусной кислоты, необходимая для приготовления 150 г столового уксуса с массовой долей 3,5 %, равна ____г?
ЗАДАНИЕ: решить задачи
-
Сколько граммов 10%-го раствора соли надо добавить к 300 г 30%-го раствора этой же соли, чтобы получить 14%-ный раствор?
-
Из 600 г 10%-го раствора соли необходимо приготовить 12%-й раствор. Сколько грамм воды для этого потребуется выпарить?
-
К раствору, состоящему из 45 г воды и 15 г соли, добавили 65 г воды и 10 г той же соли. Вычислите массовую долю соли в полученном растворе.
-
К 250 г 20 %-ной серной кислоты добавили 50 мл 60 %-ной кислоты (плотностью 1,6 г/мл). Вычислите массовую долю кислоты в полученном растворе.
-
Из 400 г горячего 50 %-ного раствора соли при охлаждении выпало 80 г кристаллов соли. Вычислите массовую долю соли в растворе над осадком.
-
Вычислите массу воды, которую нужно добавить к 30 г 20 %-ного раствора гидроксида натрия, чтобы понизить его концентрацию до 15 %.
-
Сколько граммов 98 %-ной серной кислоты надо добавить к 300 г воды, чтобы получить 10 %-ный раствор кислоты?
-
При охлаждении 400 г горячего 50 %-го раствора нитрата калия выпал осадок, не содержащий кристаллизационной воды. Чему равна масса осадка (в г), если раствор над осадком содержал 34 % нитрата калия по массе?
-
При разбавлении 25 %-го раствора аммиака получили 300 г 10 %-го раствора. Сколько граммов 25 %-го раствора было взято?
-
Вычислите массу воды, которую нужно испарить из 500 г 10 %-ного раствора гидроксида натрия, чтобы увеличить его концентрацию в 1,5 раза.
ЗАДАНИЕ: решить задачи
-
Смешали 25 г медного купороса CuSO4∙5H2O и 175 г 10%-ного раствора сульфата меди (II). Вычислите массовую долю сульфата меди (II) в образовавшемся растворе.
-
Вычислите массу медного купороса CuSO4∙5H2O и массу 10%-ного раствора сульфата меди (II), необходимых для приготовления 200 г 16%-ного раствора сульфата меди (II).
-
Вычислите массу порции железного купороса FeSO4∙7H2O и объем воды, необходимых для приготовления 1520 г 10%-ного раствора сульфата железа (II).
-
Какую массу медного купороса CuSO4∙5H2O нужно добавить к 540 мл воды, чтобы получить 10%-ного раствора сульфата меди (II).
-
К 250 г 10%-ного раствора сульфата натрия добавили 50 г глауберовой соли (сульфата натрия десятиводного Na2SO4∙10H2O). Вычислите массовую долю сульфата натрия в образовавшемся растворе.
Подбор заданий к разделу 4: Количество вещества
ЗАДАНИЕ: сделать расчет
-
Массы 1 моль N2;
-
Количества вещества, содержащегося в 168 г железа;
-
Количества атомов кислорода 2 моль О3;
-
Объема 3 моль СО2;
-
Массы 3,01∙1024 молекул кислорода;
-
В какой порции вещества содержится больше молекул в 5 моль воды или 44 г углекислого газа;
-
В каком количестве вещества сульфата натрия Na2SO4 содержится 3 моль атомов серы;
-
В какой массе воды содержится столько же молекул, сколько молекул содержится в 4,4 г углекислого газа;
-
Известно, что 5 моль двухатомных молекул некоторого неметалла имеют массу 140 г. О каком неметалле идет речь?
-
Известно, что 140 г некоторого металла содержат 2,5 моль атомов. О каком металле идет речь?
ЗАДАНИЕ: решить задачи
-
Вычислите количество кислорода (в моль), необходимого для полного сжигания 6,72 л (н. у.) сероводорода.
-
Вычислите количество хлорида алюминия (в моль), образующегося при взаимодействии избытка алюминия с 2,24 л (н. у.) хлора.
-
Вычислите количество кислорода, необходимое для полного сгорания 4,6 г метана (СН4).
-
Вычислите количество железной окалины, образующейся при сгорании в кислороде 5,1 г железа.
-
Вычислите количество хлорида алюминия, образующегося при действии избытка хлора на 2,7 г алюминия.
-
Вычислите количество газа, выделяющегося при действии соляной кислоты на 10 г магния.
-
Вычислите количество соляной кислоты (HCl), необходимое для получения 0.25 моль хлорида кальция из оксида кальция (СаО).
-
Вычислите количество соединения, образовавшегося в результате сгорания в избытке кислорода 0,5 моль металлического натрия.
-
Смешали 3 моль серы и 2 моль порошка меди и нагрели. Полностью ли вещества вступят в реакцию?
-
Хватит ли 0,25 моль кислорода, чтобы полностью окислить 0,45 моль меди?
ЗАДАНИЕ: решить задачи
-
Вычислите объем кислорода (н.у.), необходимого для полного сжигания 64 г серы.
-
Вычислите объём газа (н. у.), образовавшийся в результате растворения 40 г карбоната кальция в избытке соляной кислоты.
-
Вычислите объём газа (н. у.), который выделится при растворении 28,0 г железа в соляной кислоте.
-
При полном разложении навески дихромата аммония масса твёрдого остатка составила 38,0 г. Вычислите объём образовавшегося при этом азота (н. у.).
-
Вычислите объём хлора (н. у.), который потребуется на взаимодействие с 112 г железа.
-
Вычислите объём (в литрах при н. у.) кислорода, который образуется при разложении 4 моль пероксида водорода.
-
Вычислите объём (в литрах при н. у.) углекислого газа, который образуется при разложении 100 г известняка (СаСО3).
-
Вычислите объём (в литрах при н. у.) кислорода, который образуется в процессе фотосинтеза из 10 моль глюкозы (С6Н12О6).
-
При реакции водорода с кислородом образуется вода, количеством вещества 1,2 моль. Вычислите объемы газов (в литрах при н. у.), вступивших в реакцию.
-
Вычислите объем воздуха (н.у.), необходимый для сжигания 24 г угля.
ЗАДАНИЕ: решить задачи
-
К цинку массой 130 г прилили соляную кислоту. Вычислите массу образовавшейся соли.
-
Какая масса оксида магния получиться при сжигании 3 моль магния.
-
Вычислите массу раствора соляной кислоты, которую прилили к карбонату кальция, если при этом выделяется 0,224 л углекислого газа (н.у.).
-
Вычислите массу перманганата калия, который необходимо прокалить для получения 6,72 л (н. у.) кислорода.
-
При растворении железа в хлороводородной кислоте выделилось 3,36 л газа (н. у.). Вычислите массу железа, которое вступило в реакцию.
-
Вычислите массу соединения, образовавшегося в результате сгорания в избытке кислорода 18,4 г металлического кальция.
-
Для полного восстановления раскалённого оксида свинца (II) до металла потребовалось 4,48 л водорода (в пересчёте на н. у.). Вычислите массу образовавшегося свинца.
-
Вычислите массу хлорида алюминия, образующегося при действии избытка хлора на 2 моль алюминия.
-
Вычислите массу соединения, образовавшегося при поглощении 5,6 л (н. у.) углекислого газа избытком гидроксида бария.
-
Какая масса малахита (СuOH)2CO3 подверглась разложению если в результате реакции образовалось 0,4 моль оксида меди (II)?
ЗАДАНИЕ 1: вычислить относительную плотность
-
Хлора по водороду
-
Азота по фтору
-
Углекислого газа по воздуху
-
Метана по аргону
-
Кислорода по аммиаку
ЗАДАНИЕ 2: вычислить молярную массу газа, если
-
Его плотность по водороду равна 22
-
Его плотность по воздуху равна 1,517
-
Его плотность по азоту равна 1,571
-
Его плотность по аргону равна 1,1
-
Его плотность по кислороду равна 1,0625
ЗАДАНИЕ 3: вычислить
-
Плотность по кислороду смеси, состоящей из 5 л метана и 20 л неона.
-
Плотность по азоту смеси, состоящей из 10 мл аргона, 20 мл кислорода и
100 мл хлороводорода.
-
Объемные доли газов в смеси, состоящей из этана и пропана. Плотность по водороду данной смеси равна 19,9.
ЗАДАНИЕ: решить задачи
-
Вычислите объём азота (н. у.), который образуется при полном сгорании 20 л аммиака в избытке кислорода.
-
Вычислите максимально возможный объём (н. у.) аммиака, который может быть получен исходя из 40 л водорода и 30 л азота.
-
Вычислите объём водорода, который можно получить при разложении 250 л метана. Объемы газов измерены при одинаковых условиях.
-
Вычислите объём азота (при н. у.), который необходимо взять для получения 67,2 л аммиака.
-
При разложении нитрата меди (II) образовалось 12 л оксида азота (IV). Вычислите объём образовавшегося кислорода. Объёмы газов измерены при одинаковых условиях.
-
Для обжига сульфида цинка потребовалось 240 л кислорода. Вычислите объём образовавшегося оксида серы(IV). Объёмы газов измерены при одинаковых условиях.
-
При полном разложении нитрата меди (II) образовалась смесь газов общим объёмом 35 л. Вычислите объём кислорода в этой смеси. Объёмы газов измерены при одинаковых условиях.
-
При разложении оксида азота (I) образовалось 25 л азота и 12,5 л кислорода. Вычислите объём вступившего в реакцию оксида азота. Объёмы газов измерены при одинаковых условиях.
-
При паровой конверсии метана образовалась смесь оксида углерода (II) и водорода общим объёмом 800 л. Вычислите объём израсходованного метана.
-
Вычислите объем воздуха, из которого можно получить 10 л озона.
-
-
Вычисления по химическим уравнениям количества, объема, массы одного из продуктов реакции по количеству, объему, массе исходного вещества, содержащего определенную долю примесей
ЗАДАНИЕ: решить задачи
-
Определите объем сероводорода (н.у.), образовавшегося при реакции соляной кислоты с 200 г сульфида железа (II), содержащего 10% примесей.
-
Вычислите массу соли, образовавшейся при взаимодействии соляной кислоты с мелом, массой 50 г, содержащим 85% карбоната кальция.
-
Вычислите массу технического хлорида натрия, содержащего 10% примесей, которая потребуется для того, чтобы при взаимодействии с 170 г нитрата серебра получился осадок хлорида серебра.
-
Вычислите массу гидроксида калия, образовавшегося при взаимодействии 10 г калия, содержащего 5 % примесей с избытком воды.
-
Вычислите массу соли, образовавшейся при растворении 100 г гидроксида алюминия в серной кислоте, если после реакции на дне пробирки осталось 24 г непрореагировавшего остатка.
-
При прокаливании 500 г перманганата калия KMnO4 получили 33,6 л кислорода. Какова массовая доля примесей в исходном веществе?
-
Вычислите объем водорода (н. у.), выделившегося результате взаимодействия 143 г алюминия содержащего 15% примесей с соляной кислотой.
-
Кислород объемом 33,6 л (н.у.) выделится при разложении нитрата калия, содержащего 20% примесей, масса которого равна?
-
При действии избытка серной кислоты на 780 г технического хлорида натрия, содержащего 25 % примесей, выделился газ объемом (н.у.)?
-
Какой объем оксида углерода (II) может быть получен при взаимодействии 36,73 г кокса, содержащего 98% углерода, с оксидом углерода (IV) (н.у.)?
ЗАДАНИЕ: решить задачи
-
На 47 г гидроксид калия подействовали раствором, содержащим 40 г азотной кислоты. Найдите массу образовавшегося нитрата калия.
-
На оксид магния количеством вещества 0,1 моль подействовали раствором, содержащим 15 г серной кислоты. Вычислите массу полученной соли.
-
Вычислите массу соли, образовавшейся в результате взаимодействия 7,3 г хлороводорода с 5,6 л аммиака (н. у.)
-
Вычислите объём водорода, выделившегося при взаимодействии цинка массой 13 г с раствором, содержащим 30 г серной кислоты (н.у.).
-
Для сгорания 24 г угля взяли 67,2 л (н.у.) кислорода. Вычислите объем образовавшегося углекислого газа.
-
Найдите массу осадка, который образуется при взаимодействии 20,8 г хлорида бария с 98 г серной кислоты.
-
Найдите объем газа, который образуется при взаимодействии 106 г карбоната натрия с 36,5 г соляной кислоты.
-
К раствору, содержащему 16 г сульфата меди (II), прибавили 12 г железных опилок. Вычислите массу выделившейся меди.
-
Определить объем газа, который получится при взаимодействии 3,5 л водорода и 1 л азота.
-
К раствору, в котором находится 42,6 г нитрата алюминия, прилили раствор, содержащий 16 г гидроксида натрия. Вычислить массу осадка.
Подбор заданий к разделу 5: Основные классы неорганических соединений
ЗАДАНИЕ 1: выполнить тестовые задания с составлением уравнений
1. Оксид серы (VI) реагирует с
| 1) нитратом натрия 3) оксидом алюминия | 2) хлором 4) оксидом кремния |
2. Среди веществ: KOH, SO3, H2O, HCl— в реакцию с оксидом кальция вступает(-ют)
| 1) только HCl 3) HCl, SO3 и H2O | 2) KOH и HCl 4) все перечисленные вещества |
3. Химическая реакция возможна между
| 1) оксидом серы(IV) и соляной кислотой 2) оксидом алюминия и гидроксидом натрия 3) оксидом берилия и кислородом 4) оксидом железа(II) и оксидом калия |
4. Оксид алюминия взаимодействует с каждым из веществ:
| 1) медью и азотной кислотой 2) азотом и хлороводородом 3) оксидом калия и оксидом серы(VI) 4) гидроксидом кальция и сульфатом цинка |
5. Раствор серной кислоты реагирует с раствором
| 1) Cu(NO3)2 | 2) FeCl3 | 3) Na2SO4 | 4) BaBr2 |
6. Гидроксид меди(II) реагирует с
| 1) оксидом бария 3) хлоридом калия | 2) соляной кислотой 4) гидроксидом натрия |
7. При взаимодействии растворов хлорида железа(III) и гидроксида натрия образуются
| 1) Na2O, Fe2O3 и HCl 3) NaCl, Fe2O3 и H2 | 2) NaCl и Fe(OH)3 4) NaCl и Fe(OH)2 |
8. Продуктами реакции разбавленной серной кислоты с оксидом алюминия являются
| 1) → Al2(SO4)3 + H2↑ 3) → Al2O3 + H2↑+ SO3 | 2) → Al2O3 + H2O + SO2↑ 4) → Al2(SO4)3 + H2O |
9. И с серебром, и с оксидом меди(II) будет реагировать
| 1) соляная кислота 3) азотная кислота | 2) фосфорная кислота 4) угольная кислота |
10. Между какими веществами возможно взаимодействие?
| 1) CaCl2 и NH4NO3 3) AlCl3 и Na2SO4 | 2) AgCl и HNO3 4) BaCl2 и CuSO4 |
ЗАДАНИЕ 2: закончить уравнения
-
K2SiO3 + HCl → -
AlCl3 + KOH → -
Na2CO3 + HNO3 → -
BaCl2 + Na2CO3 → -
Zn(OH)2 –t → -
SO2 + MgO → -
MgO + H2SO4 → -
CaO + H2O → -
Fe(OH)3 + HCl (p-p)→ -
Ca(OH)2 (избыток) + СO2 –t → |
ЗАДАНИЕ: написать уравнения реакций, с помощью которых можно осуществить следующие превращения веществ
-
Cu → CuО → CuCl2 → Cu(OН)2 –t → X
-
NH4Cl –NaOH → X → (NH4)2SO4 → BaSO4
-
Zn(OH)2 –t → X → ZnCl2 → Zn3(PO4)2
-
MgO → MgCO3 –t → X → Mg(NO3)2 → Mg(OH)2
-
K2SiO3 → H2SiO3 –t → X → Na2SiO3 → CaSiO3
-
Ca –H2O → X → CaCO3 → CaO → Ca(OН)2
-
Na2S → FeS → H2S –O2 (изб) → X → K2SO3
-
Ba → BaO → BaCl2 → BaCO3 –HNO3 → X
-
Fe → FeCl3 –NaOH→ X1 → X2 → Fe(OH)3
-
Na → Na2O2 –H2O, t→ X → Na3PO4
ЗАДАНИЕ: решить задачи
-
К 200 г соляной кислоты медленно добавляли карбонат натрия до прекращения выделения газа, которого было собрано 4,48 л (н.у.). Определите массовую долю хлороводорода в соляной кислоте.
-
К 300 г баритовой воды добавили избыток раствора карбоната натрия, выпал осадок массой 11,82 г. Определите массовую долю гидроксида бария в исходном растворе.
-
Для определения концентрации серной кислоты к её раствору добавляли хлорид бария до прекращения выпадения осадка. Для взаимодействия с 20 г раствора кислоты потребовалось 52 г 10-процентного раствора хлорида бария. Определите массовую долю серной кислоты в исходном растворе.
-
Соляную кислоту добавляли к раствору нитрата серебра до окончания выпадения осадка. Для взаимодействия с 50 г раствора соли потребовалось 10 г 7,3-процентной соляной кислоты. Определите массовую долю нитрата серебра в исходном растворе.
-
Через раствор гидроксида натрия пропустили 4,48 л сернистого газа. Образовалось 126 г раствора сульфита натрия. Вычислите массовую долю соли в полученном растворе.
-
Вычислите массу осадка, который образуется при действии раствора избытка хлорида меди (II) на 80 г 10 %-ного раствора гидроксида натрия.
-
К 340 г раствора с массовой долей нитрата серебра 6 % добавили избыток раствора хлорида железа (III). Вычислите массу образовавшегося осадка.
-
При взаимодействии 7,1 г оксида фосфора(V) с избытком раствора гидроксида натрия получили 164 г раствора средней соли. Вычислите массовую долю соли в полученном растворе.
-
К 360 г раствора сульфата аммония добавили избыток щёлочи, полученный раствор нагрели до прекращения выделения газа. Общий объём газа составил 13,44 л (н. у.). Определите массовую долю сульфата аммония в растворе.
-
Для полной нейтрализации серной кислоты к 250 г её раствора потребовалось добавить 280 г 10-процентного раствора гидроксида натрия. Определите массовую долю серной кислоты в исходном растворе.
ЗАДАНИЕ: решить задачи
-
Какое количество цинка может вступить в реакцию с хлороводородной кислотой, образовавшейся при растворении хлороводорода, полученного из 11,2 л хлора с водородом?
-
Какой объем метана сгорит в кислороде, образовавшемся при разложении 150 г перманганата калия?
-
Какой объем углекислого газа можно получить, путем разложения карбоната кальция, полученного при сливании карбоната натрия и известковой воды, содержащей 50 г гидроксида кальция?
-
Какая масса осадка выпадет при взаимодействии хлорида цинка и гидроксида натрия, полученного при растворении 46 г натрия в воде?
-
Какую массу нужно сжечь, чтобы при дальнейшем окислении продукта и последующем растворении в воде получить 10 г серной кислоты?
-
Какую массу 10-ного раствора азотной кислоты нужно взять для растворения гидроксида меди (II), полученного при сливании раствора гидрокисда калия, содержащего 10 моль вещества и сульфата меди (II)?
-
Сколько литров воды нужно разложить электрическим током, чтобы водорода хватило на восстановление 192 г оксида меди (II)?
-
Сколько грамм фосфорной кислоты можно получить при сжигании 62 г фосфора, с последующим растворение продукта в воде?
-
Какое количество соли образуется при взаимодействии аммиака с хлороводородом, полученным при взаимодействии 22,4 л водорода с хлором?
-
Хватит ли кислорода, полученного из 0,4 моль перекиси водорода. Для сжигания 0,4 моль фосфора?
ЗАДАНИЕ: решить задачи
-
9,86 г смеси сульфатов алюминия и натрия растворили в воде и прибавили избыток раствора нитрата бария. Выпавший осадок имел массу 18,64 г. Какова масса сульфата алюминия в исходной смеси?
-
20 г смеси алюминия и меди обработали концентрированной серной кислотой при обычной температуре. В результате выделилось 5,6 л газа (при н.у.). Определить массовую долю алюминия в смеси.
-
Для получения сульфата меди (II) на растворение 9 г смеси меди и оксида меди (II) израсходован раствор серной кислоты, содержащий 25 г вещества. Вычислите массу меди в исходной смеси.
-
Определить процентный состав смеси магния и железа, если известно, что 4 г смеси при обработке соляной кислотой выделяет 2,24 л водорода.
-
На 2 г смеси из железа, оксида железа (II), оксида железа (III) подействовали соляной кислотой, при этом выделилось 224 мл водорода. При восстановлении 2 г этой же смеси водородом получено 0,423 г воды. Определите состав исходной смеси.
61







 Какому веществу оно соответствует?
Какому веществу оно соответствует?

















