СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока


Рабочая программа по химии 8 класс
Просмотр содержимого документа
«Рабочая программа по химии 8 класс»
Миллеровский район, сл.Рогалик
Муниципальное бюджетное общеобразовательное учреждение
Рогаликовская основная общеобразовательная школа.
«Утверждаю»
Директор МОУ
Рогаликовской ООШ
Приказ от 24.08.20 №82
_______ Стахурлова Н.П.
РАБОЧАЯ ПРОГРАММА
по химии
основного общего образования в 8 классе
Количество часов: ч
Учитель: Улейская Зинаида Петровна
Программа разработана на основе программы по химии 8-11 класс. (Сборник “Программы для общеобразовательных учреждений: Химия 8-11 кл.”/ Сост. О.С.Габриелян, Дрофа, 2018 год.)
2020 г.
Пояснительная записка
Рабочая программа по химии 8 класса составлена на основе:
- федерального компонента государственного образовательного стандарта основного общего образования по химии;
- программы по химии основного общего образования (базовый уровень) для общеобразовательных школ. Сборник программ курса химии для 8-11 классов общеобразовательных учреждений / О.С. Габриелян. М. Дрофа, 2018 год.
-федерального перечня учебников, рекомендованных Министерством образования Российской Федерации к использованию в образовательных учреждениях;
- с учетом требований к оснащению образовательного процесса в соответствии с содержанием наполнения учебных предметов компонента государственного стандарта общего образования;
- образовательных стандартов по химии.
Документы, взятые за основу при составлении программы
Реализация программы обеспечивается нормативными документами:
Федеральным законом «Об образовании в Российской Федерации»;
Федеральным компонентом государственного стандарта основного общего образования по химии;
Примерным недельным учебным планом общеобразовательных организаций Ростовской области на уровне основного общего образования в рамках федерального государственного образовательного стандарта основного общего образования на 2020-2021 учебный год;
Учебным планом школы на 2020-2021 учебный год;
Изучение курса проводится по учебнику Габриелян О.С., Остроумова И.Г., Сладкова С.А. "Химия" – 8 класс. Учебник для общеобразовательных учреждений. Москва, «Просвещение» 2020 год
Содержание программы направлено на освоение учащимися знаний, умений и навыков на базовом уровне.
Цели курса:
Формирование у учащихся целостной естественно-научной картины мира.
Развитие познавательных интересов, интеллектуальных и творческих способностей учащихся в процессе изучения химической науки и её вклада в современный научно - технический прогресс; формирование важнейших логических операций мышления (анализ, синтез, обобщение, конкретизация, сравнение и др.) в процессе познания системы важнейших понятий, законов и теорий о составе, строении, свойствах и применении химических веществ.
Воспитание убеждённости в том, что применение полученных знаний и умений по химии является объективной необходимостью для безопасной работы с веществами и материалами в быту и на производстве.
Проектирование и реализация выпускниками основной школы личной образовательной траектории: выбор профиля обучения в старшей школе или профессионального образовательного учреждения.
Овладение ключевыми компетенциями: учебно-познавательными, информационными, ценностно-смысловыми, коммуникативными.
Для достижения этих целей в курсе химии на ступени основного общего образования решаются следующие задачи:
формируются знания основ химической науки — основных фактов, понятий, химических законов и теорий, выраженных посредством химического языка;
развиваются умения наблюдать и Объясняют химические явления, происходящие в природе, лабораторных условиях, в быту и на производстве;
приобретаются специальные умения и навыки по безопасному обращению с химическими веществами, материалами и процессами;
формируется гуманистическое отношение к химии как производительной силе общества, с помощью которой решаются глобальные проблемы человечества;
осуществляется интеграция химической картины мира в единую научную картину.
Содержание программы
Химия 8 класс
(70 часов, 2 часа в неделю)
Начальные понятия и законы химии
Тела и вещества. Свойства веществ. Эталонные физические свойства веществ. Материалы и материаловедение. Роль химии в жизни современного общества. Отношение общества к химии: хемофилия и хемофобия.
Методы изучения химии. Наблюдение. Эксперимент. Моделирование. Модели материальные и знаковые или символьные.
Газы. Жидкости. Твёрдые вещества. Взаимные переходы между агрегатными состояниями вещества: возгонка (сублимация) и десублимация, конденсация и испарение, кристаллизация и плавление.
Физические явления. Чистые вещества и смеси. Гомогенные и гетерогенные смеси. Смеси газообразные, жидкие и твёрдые. Способы разделения смесей: перегонка, или дистилляция, отстаивание, фильтрование, кристаллизация или выпаривание. Хроматография. Применение этих способов в лабораторной практике, на производстве и в быту.
Химические элементы. Атомы и молекулы. Простые и сложные вещества. Аллотропия на примере кислорода. Основные положения атомно - молекулярного учения. Ионы. Вещества молекулярного и немолекулярного строения.
Знаки (символы) химических элементов. Информация, которую несут знаки химических элементов. Этимология названий некоторых химических элементов. Периодическая таблица химических элементов Д. И. Менделеева: короткопериодный и длиннопериодный варианты. Периоды и группы. Главная и побочная подгруппы, или А- и Б-группы. Относительная атомная масса.
Химические формулы. Индексы и коэффициенты. Относительная молекулярная масса. Массовая доля химического элемента в соединении. Информация, которую несут химические формулы.
Валентность. Структурные формулы. Химические элементы с постоянной и переменной валентностью. Вывод формулы соединения по валентности. Определение валентности химического элемента по формуле вещества. Составление названий соединений, состоящих из двух химических элементов, по валентности. Закон постоянства состава веществ.
Химические реакции. Реагенты и продукты реакции. Признаки химических реакций. Условия их протекания и прекращения. Реакции горения. Экзотермические и эндотермические реакции.
Закон сохранения массы веществ. Химические уравнения. Составление химических уравнений. Информация, которую несёт химическое уравнение.
Классификация химических реакций по составу и числу реагентов и продуктов. Типы химических реакций. Реакции соединения, разложения, замещения и обмена. Катализаторы и катализ.
Демонстрации
Модели кристаллических решёток.
Агрегатные состояния воды.
Разделение двух несмешивающихся жидкостей с помощью делительной воронки.
Портреты Й. Я. Берцелиуса и Д. И. Менделеева.
Короткопериодный и длиннопериодный варианты Периодической системы Д. И. Менделеева
Портреты М. В. Ломоносова и А. Л. Лавуазье.
Опыты, иллюстрирующие закон сохранения массы веществ.
Взаимодействие соляной кислоты с цинком.
Практические работы:
« Знакомство с лабораторным оборудованием. Правила техники безопасности при работе в кабинете химии. Некоторые виды работ».
«Наблюдение за горящей свечой».
«Анализ почвы»
Важнейшие представители неорганических веществ. Количественные отношения в химии.
Состав воздуха. Понятие об объёмной доле компонента природной газовой смеси - воздуха. Расчёт объёма компонента газовой смеси по его объемной доле и наоборот.
Кислород. Озон. Получение кислорода. Собирание и распознавание кислорода. Химические свойства кислорода: взаимодействие с металлами, неметаллами и сложными веществами. Применение кислорода. Круговорот кислорода в природе.
Оксиды. Образование названий оксидов по их формулам. Составление формул оксидов по их названиям. Представители оксидов: вода и углекислый газ, негашёная известь.
Водород в природе. Физические и химические свойства водорода, его получение и применение.
Кислоты, их состав и классификация. Индикаторы. Таблица растворимости. Соляная и серная кислоты, их свойства и применение.
Соли, их состав и названия. Растворимость солей в воде. Представители солей: хлорид натрия, карбонат натрия, фосфат кальция.
Постоянная Авогадро. Количество вещества. Моль. Молярная масса. Кратные единицы измерения количества вещества — миллимоль и киломоль, миллимолярная и киломолярная массы вещества.
Расчёты с использованием понятий «количество вещества», «молярная масса», «постоянная Авогадро».
Закон Авогадро. Молярный объём газообразных веществ. Относительная плотность одного газа по другому.
Кратные единицы измерения — миллимолярный и киломолярный объемы газообразных веществ.
Расчёты с использованием понятий «количество вещества», «молярная масса», «молярный объем газов», «постоянная Авогадро».
Расчёты с использованием понятий «количество вещества», «молярная масса», «молярный объём газов», «число Авогадро».
Гидросфера. Круговорот воды в природе. Физические и химические свойства воды: взаимодействие с оксидами.
Основания, их состав. Растворимость оснований в воде. Изменение окраски индикаторов в щелочной среде. Представители щелочей: гидроксиды натрия, калия и кальция.
Растворитель и растворённое вещество. Растворы. Растворение. Гидраты. Массовая доля растворённого вещества. Расчёты, связанные с использованием понятия «массовая доля растворённого вещества».
Лабораторные опыты
Помутнение известковой воды при пропускании углекислого газа.
2. Получение водорода взаимодействием цинка и соляной кислоты.
3. Ознакомление с препаратами домашней или школьной аптечки — растворами пероксида водорода, спиртовой настойки иода и нашатырного спирта.
Практические работы
4. Получение, собирание и распознавание кислорода.
Получение, собирание и распознавание водорода.
Приготовление растворов солей с их заданной массовой долей.
Основные классы неорганических соединений.
Обобщение сведений об оксидах, их классификации, названиях и свойствах. Способы получения оксидов.
Основания, их классификация, названия и свойства. Взаимодействие с кислотами, кислотными оксидами и солями. Разложение нерастворимых оснований. Способы получения оснований.
Кислоты, их классификация и названия. Общие химические свойства кислот. Взаимодействие кислот с металлами. Электрохимический ряд напряжений металлов. Взаимодействие кислот с оксидами металлов.
Взаимодействие кислот с основаниями — реакция нейтрализации. Взаимодействие кислот с солями. Получение бескислородных и кислородсодержащих кислот.
Соли, их классификация и свойства. Взаимодействие солей с металлами, особенности этих реакций. Взаимодействие солей с солями.
Генетические ряды металла и неметалла. Генетическая связь между классами неорганических веществ.
Лабораторные опыты
1. Взаимодействие оксида кальция с водой.
2. Помутнение известковой воды.
3. Реакция нейтрализации.
4. Взаимодействие кислот с металлами.
Практическая работа № 7 «Решение экспериментальных задач по теме «Основные классы неорганических соединений»
Периодический закон и Периодическая система химических элементов
Д. И. Менделеева и строение атома
Естественные семейства химических элементов: щелочные и щелочноземельные металлы, галогены, инертные (благородные) газы. Амфотерность. Амфотерные оксиды и гидроксиды. Комплексные соли.
Открытие Д. И. Менделеевым Периодического закона и создание им Периодической системы химических элементов.
Атомы как форма существования химических элементов. Основные сведения о строении атомов. Доказательства сложности строения атомов. Опыты Резерфорда. Планетарная модель строения атома.
Состав атомных ядер: протоны, нейтроны. Относительная атомная масса. Взаимосвязь понятий «протон», «нейтрон», «относительная атомная масса».
Микромир. Электроны. Строение электронных уровней атомов химических элементов №№ 1-20. Понятие о завершенном электронном уровне.
Изотопы. Физический смысл символики Периодической системы. Современная формулировка Периодического закона. Изменения свойств элементов в периодах и группах, как функция строения электронных оболочек атомов.
Характеристика элемента-металла и элемента-неметалла по их положению в Периодической системе химических элементов Д. И. Менделеева.
Демонстрации
Различные формы таблиц периодической системы.
Моделирование построения Периодической системы Д. И. Менделеева.
Модели атомов химических элементов.
Модели атомов элементов 1—3-го периодов
Химическая связь. Окислительно-восстановительные реакции
Ионная химическая связь. Ионы, образованные атомами металлов и неметаллов. Схемы образования ионной связи для бинарных соединений. Ионные кристаллические решётки и физические свойства веществ с этим типом решёток. Понятие о формульной единице вещества.
Ковалентная химическая связь. Электронные и структурные формулы. Ковалентная неполярная связь. Схемы образования ковалентной связи для бинарных соединений. Молекулярные и атомные кристаллические решётки, и свойства веществ с этим типом решёток.
Электроотрицательность. Ряд электроотрицательности. Ковалентная полярная химическая связь. Диполь. Схемы образования ковалентной полярной связи для бинарных соединений. Молекулярные и атомные кристаллические решётки, свойства веществ с этим типом решёток.
Металлическая химическая связь и металлическая кристаллическая решётка. Свойства веществ с этим типом решёток. Единая природа химических связей.
Степень окисления. Сравнение степени окисления и валентности. Правила расчёта степеней окисления по формулам химических соединений.
Окислительно-восстановительные реакции. Определение степеней окисления для элементов, образующих вещества разных классов. Реакции ионного обмена и окислительно-восстановительные реакции. Окислитель и восстановитель, окисление и восстановление. Составление уравнений окислительно-восстановительных реакций методом электронного баланса.
Место учебного предмета «Химия 8 класс» в учебном плане.
В соответствии с учебным планом на изучение химии в 8 классе отводится 2 часа в неделю, 70 часов в год, при нормативной продолжительности учебного года 35 учебных недель. В связи с тем, что государственные праздники выпадают на рабочие дни (23 февраля), то количество уроков сокращается на 1 час и составляет 69 часов. Программный материал отрабатывается за счет уплотнения по теме «Обобщение знаний по теме «Растворение. Растворы», «Обобщение материала по теме «Соединения химических элементов».
Учебно-тематический план
| № | Наименование разделов (тем) | Количество часов по программе | В том числе на проведение | |
| Практических работ | Контрольных работ | |||
| 8 класс | ||||
| 1 | Начальные понятия и законы химии | 21 | 3 | 1 |
| 2 | Важнейшие представители неорганических веществ. Количественные отношения в химии | 18 | 3 | 1 |
| 3 | Основные классы неорганических соединений | 10 | 1 | 1 |
| 4 | Периодический закон и Периодическая система химических элементов Д. И. Менделеева и строение атома | 8 | | |
| 5 | Химическая связь. Окислительно -восстановительные реакции | 11 | 0 | 2 |
| Повторение изученного материала | 2 | | | |
| Итого | 70 | 7 | 5 | |
Календарно- тематическое планирование
8 класс
| № п/п | Дата | Тема урока | Форма организации урока | Виды учебной деятельности | |||
| План | Факт | ||||||
| Начальные понятия и законы химии (21 ч) | |||||||
| 1 | 1.09 | | Предмет химии. Роль химии в жизни человека | Урок усвоения новых знаний | Объясняют, что предметом изучения химии являются вещества, их свойства и их превращения. Различают тела и вещества, вещества и материалы. Устанавливают причинно-следственные связи между свойствами веществ и их применением Характеризуют положительную и отрицательную роль химии в жизни современного общества. Аргументируют своё отношение к хемофилии и хемофобии. | ||
| 2 | 3.09 | | Методы изучения химии | Урок усвоения новых знаний | Характеризуют основные методы изучения естественно-научных дисциплин. Приводят примеры материальных и знаковых или символьных моделей, используемых на уроках физики, биологии и географии. Собирают объёмные и шаростержневые модели некоторых химических веществ | ||
| 3 | 8.09 | | Агрегатные состояния веществ | Урок усвоения новых знаний | Различают три агрегатных состояния вещества. Устанавливают взаимосвязи между ними на основе взаимных переходов. Иллюстрируют эти переходы примерами. Наблюдают химический эксперимент и делают выводы на основе наблюдений | ||
| 4 | 10.09 | | Практическая работа № 1 «Знакомство с лабораторным оборудованием. Правила ТБ при работе в кабинете химии» | Урок - практикум | Работают с лабораторным оборудованием и нагревательными приборами в соответствии с правилами техники безопасности. Выполняют простейшие манипуляции с лабораторным оборудованием: с лабораторным штативом, со спиртовкой Оформляют отчёт о проделанной работе | ||
| 5 | 15.09 | | Практическая работа № 2 «Горение свечи» | Урок - практикум | Наблюдение за горящей свечой. Выполнение простейших опытов. Применение методов изучения химии: наблюдения, эксперимента, гипотезы. | ||
| 6 | 17.09 | | Физические явления в химии | Комбинированный урок | Различают физические и химические явления, чистые вещества и смеси. Классифицируют смеси. Приводят примеры смесей различного агрегатного состояния. Устанавливают причинно-следственные связи между физическими свойствами веществ смеси и способами их разделения. Различают их, описывают и характеризуют практическое значение. | ||
| 7 | 22.09 | | Практическая работа № 3 «Анализ почвы» | Урок - практикум | Работают с лабораторным оборудованием и нагревательными приборами в соответствии с правилами техники безопасности. Выполняют простейшие приёмы обращения с лабораторным оборудованием: воронкой, фильтром, спиртовкой. Наблюдают за свойствами веществ и явлениями, происходящими с веществами. Делают выводы по результатам проведённого эксперимента | ||
| 8 | 24.09 | | Атомно- молекулярное учение. Химические элементы | Урок усвоения новых знаний | Объясняют что такое химический элемент, атом, молекула, аллотропия, ионы. Различают простые и сложные вещества, вещества молекулярного и немолекулярного строения. Формулируют основные положения атомно-молекулярного учения | ||
| 9 | 29.09 | | Знаки химических элементов. | Урок-исследование | Называют и записывают знаки химических элементов. Характеризуют информацию, которую несут знаки химических элементов. Объясняют этимологические начала названий химических элементов и их отдельных групп. | ||
| 10 | 1.10 | | Периодическая таблица, знаки химических элементов | Урок-исследование | Описывают структуру таблицы химических элементов Д. И. Менделеева. Различают короткопериодный и длиннопериодный варианты Периодической системы Д. И. Менделеева | ||
| 11 | 6.10 | | Химические формулы | Урок усвоения новых знаний | Отображают состав веществ с помощью химических формул. Различают индексы и коэффициенты. Находят относительную молекулярную массу вещества и массовую долю химического элемента в соединении. Транслируют информацию, которую несут химические формулы | ||
| 12 | 8.10 | | Химические формулы | Урок-исследование | |||
| 13 | 13.10 | | Валентность | Урок усвоения новых знаний | Объясняют что такое валентность. Понимают отражение порядка соединения атомов в молекулах веществ посредством структурных формул. Учатся составлять формулы соединений по валентности и определять валентность элемента по формуле его соединения | ||
| 14 | 15.10 | | Валентность | Урок-практикум | |||
| 15 | 20.10 | | Химические реакции. | Обобщающий урок | Характеризуют химическую реакцию и её участников (реагенты и продукты реакции). Описывают признаки и условия течения химических реакций. Различают экзотермические и эндотермические реакции. Соотносят реакции горения и экзотермические реакции.
| ||
| 16 | 22.10 | | Химические уравнения | Урок -практикум | Транслируют информацию, которую несут химические уравнения. Экспериментально подтверждают справедливость закона сохранения массы веществ. | ||
| 17 | 5.11 | | Химические уравнения | Урок -практикум | |||
| 18 | 10.11 | | Типы химических реакций | Урок усвоения новых знаний | Классифицируют химические реакции по признаку числа и состава реагентов и продуктов. Характеризуют роль катализатора в протекании химической реакции. Наблюдают и описывают химический эксперимент с помощью русского (родного) языка и языка химии
| ||
| 19 | 12.11 | | Типы химических реакций | Урок -практикум | |||
| 20 | 17.11 | | Повторение и обобщение темы «Первоначальные химические понятия» | Обобщающий урок | Обобщают и систематизируют свои знания по теме: «Начальные понятия и законы химии». Применяют на практике ранее изученный материал, работая по группам с заданиями разного уровня сложности
| ||
| 21 | 19.11 | | Контрольная работа .№ 1 «Начальные понятия и законы химии» | Урок – контроля знаний обучающихся | Применяют на практике ранее изученный материал, работая по группам с заданиями разного уровня сложности, выполняют контрольную работу.
| ||
| Важнейшие представители неорганических веществ. Количественные отношения в химии (18 ч) | |||||||
| 22 | 24.11 | | Воздух и его состав | Урок усвоения новых знаний | Характеризуют объёмную долю компонента такой природной газовой смеси, как воздух, и рассчитывают её по объёму этой смеси. Описывают объёмный состав атмосферного воздуха и понимают значение постоянства этого состава для здоровья | ||
| 23 | 26.11 | | Кислород | Урок усвоения новых знаний | Характеризуют озон, как аллотропную модификацию кислорода. Описывают физические и химические свойства, получение и применение кислорода. | ||
| 24 | 1.12 | | Практическая работа .№4 «Получение, собирание и распознавание кислорода» | Урок практикум | С помощью видеоопыта наблюдают за свойствами веществ и явлениями, происходящими с веществами. Описывают химический эксперимент. Составляют отчёт по результатам проведенного эксперимента | ||
| 25 | 3.12 | | Оксиды | Урок-исследование | Выделяют существенные признаки оксидов. Дают названия оксидов по их формулам. Составляют формулы оксидов по их названиям. Характеризуют таких представителей оксидов, как вода, углекислый газ и негашёная известь | ||
| 26 | 8.12 | | Водород | Урок усвоения новых знаний | Характеризуют состав молекулы, физические и химические свойства, получение и применение водорода. Устанавливают причинно-следственные связи между физическими свойствами и способами собирания водорода, между химическими свойствами и его применением. | ||
| 27 | 10.12 | | П.р. №5 «Получение, собирание и распознавание водорода» | Урок-практикум | С помощью видеоопыта наблюдают за собиранием водорода методом вытеснения воздуха и распознавания его. Наблюдают за свойствами веществ и явлениями, происходящими с веществами. Описывают химический эксперимент. Составляют отчёт по результатам проведенного эксперимента | ||
| 28 | 15.12 | | Кислоты | Урок усвоения новых знаний | Анализируют состав кислот. Характеризуют представителей кислот: соляную и серную. Характеризуют растворимость соединений с помощью таблицы растворимости. Устанавливают причинно-следственные связи между свойствами соляной и серной кислот и областями их применения. | ||
| 29 | 17.12 | | Соли | Урок-исследование | Характеризуют соли как продукты замещения водорода в кислоте на металл. Записывают формулы солей по валентности. Называют соли по формулам. Используют таблицу растворимости для характеристики свойств солей. Проводят расчёты по формулам солей | ||
| 30 | 22.12 | | Количество вещества | Урок-исследование | Объясняют что такое количество вещества, моль, постоянная Авогадро, молярная масса. | ||
| 31 | 24.12 | | Решение расчетных задач | Урок- практикум | Решают задачи с использованием понятий «количество вещества», «молярная масса», «постоянная Авогадро | ||
| 32 | 12.01 | | Молярный объем газообразных веществ | Урок усвоения новых знаний | Объясняют что такое молярный объем газов, нормальные условия. Решают задачи с использованием понятий «количество вещества», «молярная масса», «молярный объём газов», «постоянная Авогадро». | ||
| 33 | 14.01 | | Расчёты по химическим уравнениям | Урок усвоения новых знаний | Характеризуют количественную сторону химических объектов и процессов. Решают задачи с использованием понятий «количество вещества», «молярная масса», «молярный объем газов», «постоянная Авогадро» | ||
| 34 | 18.01 | | Расчёты по химическим уравнениям | Урок - практикум | |||
| 35 | 21.01 | | Вода. Основания | Урок-исследование | Объясняют что такое «основания», «щелочи», «качественная реакция», «индикатор». Классифицируют основания по растворимости в воде. Определяют принадлежности неорганических веществ к классу оснований по формуле. Характеризуют свойства отдельных представителей оснований. Используют таблицу растворимости для определения растворимости оснований. | ||
| 36 | 25.01 | | Растворы. Массовая доля растворённого вещества | Урок решения задач | Объясняют что такое «массовая доля растворенного вещества». Устанавливают аналогии с объёмной долей компонентов газовой смеси. Решают задачи с использованием понятий «массовая доля элемента в веществе», «массовая доля растворенного вещества», «объемная доля газообразного вещества» | ||
| 37 | 28.01 | | П.р. № 6 «Приготовление растворов солей с их заданной массовой долей» | Урок - практикум | Наблюдают за свойствами веществ и явлениями, происходящими с веществами. Описывают эксперимент. Составляют отчёты по результатам проведенного эксперимента
| ||
| 38 | 2.02 | | Обобщение и систематизация знаний по теме: «Важнейшие представители неорганических веществ. Количественные отношения в химии» | Обобщающий урок | Обобщают и систематизируют свои знания по теме: «Важнейшие представители неорганических веществ. Количественные отношения в химии». Применяют на практике ранее изученный материал, работая по группам с заданиями разного уровня сложности
| ||
| 39 | 4.02 | | К.р.№2 по теме: «Важнейшие представители неорганических веществ. Количественные отношения в химии»
| Урок – контроля знаний | Применяют на практике ранее изученный материал, работая самостоятельно с заданиями разного уровня сложности, выполняют контрольную работу.
| ||
| Основные классы неорганических соединений (10 ч) | |||||||
| 40 | 9.02 | | Оксиды: классификация и свойства | Урок усвоения новых знаний | Объясняют что такое несолеобразующие оксиды, солеобразующие оксиды, основные оксиды, кислотные оксиды. Характеризуют общие химические свойства солеобразующих оксидов (кислотных и основных) Составляют уравнения реакций с участием оксидов. Наблюдают и описывают реакции с участием оксидов. | ||
| 41 | 11.02 | | Основания: классификация и свойства | Урок-исследование | Составляют уравнения реакций с участием оснований.
| ||
| 42 | 15.02 | | Кислоты. Классификация кислот | Урок усвоения новых знаний | Характеризуют общие химические свойства кислот Составляют уравнения реакций с участием кислот. Наблюдают и описывают реакции с участием кислот. Проводят опыты, подтверждающие химические свойства кислот, с соблюдением правил техники безопасности | ||
| 43 | 18.02 | | Свойства кислот | Комбинированный урок | |||
| 44 | 22.02 | | Классификация солей | Урок усвоения новых знаний | Различают понятия «средние соли», «кислые соли», «основные соли».
| ||
| 45 | 25.02 | | Свойства солей | Комбинированный урок | Характеризуют общие химические свойства солей. Составляют уравнения реакций с участием солей.
| ||
| 46 | 2.03 | | Генетическая связь между классами неорганических веществ | Урок усвоения новых знаний | Характеризуют понятие «генетический ряд». Иллюстрируют генетическую взаимосвязь между веществами: простое вещество — оксид — гидроксид — соль. Записывают уравнения реакций, соответствующих последовательности («цепочке») превращений неорганических веществ различных классов. | ||
| 47 | 4.03 | | П.р. № 7 «Решение экспериментальных задач» | Урок - практикум | С помощью видеоопыта наблюдают свойства электролитов и происходящие с ними явления. Наблюдают и описывают реакции с участием электролитов. Формулируют выводы по результатам проведенного эксперимента | ||
| 48 | 9.03 | | Обобщение и систематизация знаний по теме: «Основные классы неорганических соединений» | Обобщающий урок | Обобщают и систематизируют свои знания по теме: «Основные классы неорганических соединений». Применяют на практике ранее изученный материал, работая по группам с заданиями разного уровня сложности
| ||
| 49 | 11.03 | | К.р. №3 по теме: «Основные классы неорганических соединений» | Урок – контроля | Применяют на практике ранее изученный материал, работая самостоятельно с заданиями разного уровня сложности, выполняют контрольную работу.
| ||
| Периодический закон и Периодическая система химических элементов Д. И. Менделеева и строение атома (8 ч) | |||||||
| 50 | 16.03 | | Естественные семейства химических элементов. Амфотерность | Урок усвоения новых знаний | Объясняют что такое «амфотерные соединения». Наблюдают и описывают реакций между веществами. Характеризуют двойственный характере свойств амфотерных оксидов и гидроксидов. Проводят опыты по получению и подтверждению химических свойств амфотерных оксидов и гидроксидов с соблюдением правил техники безопасности. | ||
| 51 | 18.03 | | Открытие Д. И. Менделеевым Периодического закона | Урок усвоения новых знаний | Различают естественную и искусственную классификации. Аргументируют отнесение Периодического закона к естественной классификации. Моделируют химические закономерности с выделением существенных характеристик объекта и представлением их в пространственно-графической или знаково-символической форме | ||
| 52 | 23.03 | | Основные сведения о строении атомов. | Урок усвоения новых знаний | Объясняют что такое «протон», «нейтрон», «электрон», «химический элемент», «массовой число». Описывают строение ядра атома используя Периодическую систему химических элементов Д. И. Менделеева. Получают информацию по химии из различных источников, анализируют её. | ||
| 53 | 25.03 | | Строение электронных уровней атомов химических элементов №«№1-20 в таблице Д. И. Менделеева. | Урок-исследование | Объясняют что такое электронный слой или энергетический уровень. Составляют схемы распределения электронов по электронным слоям в электронной оболочке | ||
| 54 | 6.04 | | Периодический закон Д. И. Менделеева и строение атома | Урок-исследование | Раскрывают физический смысл: порядкового номера химического элемента, номера периода и номера группы. Объясняют закономерности изменения металлических и неметаллических свойств химических элементов и их соединений в периодах и группах
| ||
| 55 | 8.04 | | Характеристика химического элемента на основании его положения в Периодической системе | Урок-исследование | Характеризуют химические элементы 1—3-го периодов по их положению в Периодической системе химических элементов Д. И. Менделеева. Аргументируют свойства оксидов и гидроксидов металлов и неметаллов посредством уравнений реакций | ||
| 56 | 13.04 | | Характеристика химического элемента на основании его положения в Периодической системе | Урок-практикум | |||
| 57 | 15.04 | | Значение Периодического закона и Периодической системы химических элементов Д. И. Менделеева | Урок-исследование | Определяют источники химической информации. Получают необходимую информацию из различных источников, анализируют её, оформляют информационный продукт, презентуют его, ведут научную дискуссию, отстаивают свою точку зрения
| ||
| Химическая связь. Окислительно-восстановительные реакции (11 ч) | |||||||
| 58 | 20.04 | | Ионная химическая связь | Урок-исследование | Объясняют что такое ионная связь, ионы. Характеризуют механизм образования ионной связи. Составляют схемы образования ионной связи. Определяют тип химической связи по формуле вещества. Приводят примеры веществ с ионной связью. | ||
| 59 | 22.04 | | Ковалентная химическая связь | Урок-исследование | Объясняют что такое ковалентная связь, валентность. Составляют схемы образования ковалентной неполярной химической связи. Используют знаковое моделирование. Определяют тип химической связи по формуле вещества. Приводят примеры веществ с ковалентной связью. | ||
| 60 | 27.04 | | Ковалентная полярная химическая связь | Урок-исследование | Объясняют что такое ковалентная полярная связь, электроотрицательность, возгонка или сублимация. Составляют схемы образования ковалентной полярной химической связи. Используют знаковое моделирование. Характеризуют механизм образования полярной ковалентной связи. Определяют тип химической связи по формуле вещества. Приводят примеры веществ с ковалентной полярной связью.
| ||
| 51 | 29.04 | | Металлическая химическая связь | Урок-исследование | Объясняют что такое металлическая связь. Составляют схемы образования металлической химической связи. Использовать знаковое моделирование. Характеризуют механизм образования металлической связи. Определяют тип химической связи по формуле вещества. Приводят примеры веществ с металлической связью. | ||
| 62 | 4.05 | | Степень окисления | Урок усвоения новых знаний | Объясняют что такое «степень окисления», «валентность». Составляют формулы бинарных соединений на основе общего способа их названий. Сравнивают валентность и степень окисления. Рассчитывают степени окисления по формулам химических соединений | ||
| 63 | 6.05 | | Окислительно- восстановительные реакции
| Урок усвоения новых знаний | Объясняют что такое окислительно-восстановительные реакции, окислитель, восстановитель, окисление, восстановление. Классифицируют химические реакций по признаку «изменение степеней окисления элементов». Определяют окислитель и восстановитель, процессы окисления и восстановления. | ||
| 64 | 11.05 | | Окислительно-восстановительные реакции | Урок - практикум | |||
| 65 | 13.05 | | Обобщение и систематизация знаний по темам: «ПЗ и ПСХЭ» и «Строение вещества. ОВР» | Обобщающий урок | Обобщают и систематизируют свои знания по теме: «ПЗ и ПСХЭ» и «Строение вещества. ОВР». Применяют на практике ранее изученный материал, работая по группам с заданиями разного уровня сложности | ||
| 66 | 18.05 | | Контрольная работа по темам: «ПЗ и ПСХЭ» и «Строение вещества. ОВР» | Урок – контроля знаний | Применяют на практике ранее изученный материал, работая по группам с заданиями разного уровня сложности, выполняют контрольную работу. | ||
| 67 | 20.05 | | Решение расчетных задач | Урок - практикум | Решают расчетные задачи. | ||
| 68 | 25.05 | | Итоговая контрольная работа | Урок – контроля знаний | Применяют на практике ранее изученный материал, работая по группам с заданиями разного уровня сложности, выполняют контрольную работу. | ||
| 69 | 27.05 | | Обобщение материала по теме «Количественные отношения в химии» | Обобщающий урок | Обобщают и систематизируют свои знания по теме: «Количественные отношения в химии».Применяют на практике ранее изученный материал, работая по группам с заданиями разного уровня сложности | ||
| 70 | | | Обобщение материала по теме « Основные классы неорганических соединений» | Обобщающий урок | Обобщают и систематизируют свои знания по теме: « Основные классы неорганических соединений». Применяют на практике ранее изученный материал, работая по группам с заданиями разного уровня сложности | ||
Личностные результаты обучения
Личностными результатами изучения предмета «Химия» в 8 классе являются следующие умения:
осознавать единство и целостность окружающего мира, возможности его познаваемости и объяснимости на основе достижений науки;
постепенно выстраивать собственное целостное мировоззрение: осознавать потребность и готовность к самообразованию, в том числе и в рамках самостоятельной деятельности вне школы;
оценивать жизненные ситуации с точки зрения безопасного образа жизни и сохранения здоровья;
оценивать экологический риск взаимоотношений человека и природы.
формировать экологическое мышление: умение оценивать свою деятельность и поступки других людей с точки зрения сохранения окружающей среды - гаранта жизни и благополучия людей на Земле.
Метапредметными результатами изучения курса «Химия» является формирование универсальных учебных действий (УУД).
Регулятивные УУД:
самостоятельно обнаруживать и формулировать учебную проблему, определять цель учебной деятельности;
выдвигать версии решения проблемы, осознавать конечный результат, выбирать из предложенных и искать самостоятельно средства достижения цели;
составлять (индивидуально или в группе) план решения проблемы;
работая по плану, сверять свои действия с целью и, при необходимости, исправлять ошибки самостоятельно;
в диалоге с учителем совершенствовать самостоятельно выработанные критерии оценки.
Познавательные УУД:
анализировать, сравнивать, классифицировать и обобщать факты и явления. Выявлять причины и следствия простых явлений.
осуществлять сравнение, классификацию, самостоятельно выбирая основания и критерии для указанных логических операций;
строить логическое рассуждение, включающее установление причинно-следственных связей.
создавать схематические модели с выделением существенных характеристик объекта.
составлять тезисы, различные виды планов (простых, сложных и т.п.).
преобразовывать информацию из одного вида в другой (таблицу в текст и пр.).
уметь определять возможные источники необходимых сведений, производить поиск информации, анализировать и оценивать её достоверность.
Коммуникативные УУД:
Самостоятельно организовывать учебное взаимодействие в группе (определять общие цели, распределять роли, договариваться друг с другом и т.д.).
Предметные результаты изучения учебного предмета «Химия» отражают:
формирование первоначальных систематизированных представлений о веществах, их превращениях и практическом применении; овладение понятийным аппаратом и символическим языком химии;
осознание объективной значимости основ химической науки как области современного естествознания, химических превращений неорганических и органических веществ как основы многих явлений живой и неживой природы; углубление представлений о материальном единстве мира;
овладение основами химической грамотности: способностью анализировать и объективно оценивать жизненные ситуации, связанные с химией, навыками безопасного обращения с веществами, используемыми в повседневной жизни; умением анализировать и планировать экологически безопасное поведение в целях сохранения здоровья и окружающей среды;
формирование умений устанавливать связи между реально наблюдаемыми химическими явлениями и процессами, происходящими в микромире, объяснять причины многообразия веществ, зависимость их свойств от состава и строения, а также зависимость применения веществ от их свойств;
приобретение опыта использования различных методов изучения веществ: наблюдения за их превращениями при проведении несложных химических экспериментов с использованием лабораторного оборудования и приборов;
формирование представлений о значении химической науки в решении современных экологических проблем, в том числе в предотвращении техногенных и экологических катастроф.
Требования к уровню подготовки учащихся 8 класса.
Обучающиеся научатся:- характеризовать основные методы познания: наблюдение, измерение, эксперимент;
- соблюдать правила безопасной работы при проведении опытов;
- пользоваться лабораторным оборудованием и посудой;
- описывать свойства твердых, жидких, газообразных веществ, выделяя их существенные признаки;
- раскрывать смысл основных химических понятий «атом», «молекула», «химический элемент»,
«простое вещество», «сложное вещество», «валентность», «химическая реакция», используя знаковую систему химии;
- раскрывать смысл законов сохранения массы веществ, постоянства состава, атомно-
молекулярной теории;
- различать химические и физические явления;
- определять тип химических реакций;
- называть признаки и условия протекания химических реакций;
- составлять уравнения химических реакций;
- вычислять количество, объем или массу вещества по количеству, объему, массе
реагентов или продуктов реакции;
- вычислять массовую долю растворенного вещества в растворе;
- приготовлять растворы с определенной массовой долей растворенного вещества;
- характеризовать физические и химические свойства основных классов неорганических
веществ: оксидов, кислот, оснований, солей;
- характеризовать взаимосвязь между классами неорганических соединений;
- характеризовать химические элементы (от водорода до кальция) на основе их
положения в периодической системе Д.И. Менделеева и особенностей строения их
атомов;
- раскрывать смысл понятий: «химическая связь», «электроотрицательность»;
- характеризовать зависимость физических свойств веществ от типа кристаллической решетки;
- определять вид химической связи в неорганических соединениях;
- изображать схемы строения молекул веществ, образованных разными видами химических связей;
- объяснять сущность процесса электролитической диссоциации и реакций ионного обмена;
- составлять уравнения окислительно-восстановительных реакций;
- называть факторы, влияющие на скорость химической реакции;
- оценивать влияние химического загрязнения окружающей среды на организм человека;
- грамотно обращаться с веществами в повседневной жизни.
- выдвигать и проверять экспериментально гипотезы о химических свойствах веществ на основе их состава и строения, их способности вступать в химические реакции, о характере и продуктах различных химических реакций;
- характеризовать вещества по составу, строению и свойствам, устанавливать причинно- следственные связи между данными характеристиками вещества;
-выдвигать и проверять экспериментально гипотезы о результатах воздействия различных факторов на изменение скорости химической реакции;
- использовать приобретенные ключевые компетенции при выполнении проектов и учебно- исследовательских задач по изучению свойств, способов получения и распознавания веществ;
-создавать модели и схемы для решения учебных и познавательных задач; понимать необходимость соблюдения предписаний, предлагаемых в инструкциях по использованию лекарств, средств бытовой химии и др.
-осознавать значение теоретических знаний по химии для практической деятельности человека;
-грамотно обращаться с веществами в повседневной жизни;
-использовать приобретённые ключевые компетентности при выполнении исследовательских проектов по изучению свойств, способов получения и распознавания веществ;
-развивать коммуникативную компетентность, используя средства устной и письменной коммуникации при работе с текстами учебника и дополнительной литературой, справочными таблицами, проявлять готовность к уважению иной точки зрения при обсуждении результатов выполненной работы;
-критически относиться к псевдонаучной информации, недобросовестной рекламе в средствах массовой информации.
Планируемые результаты обучения:
• описывать свойства твёрдых, жидких, газообразных веществ, выделяя их существенные признаки;
• характеризовать вещества по составу, строению и свойствам, устанавливать причинно-следственные связи между данными характеристиками вещества;
• раскрывать смысл основных химических понятий «атом», «молекула», «химический элемент», «простое вещество», «сложное вещество», «валентность», используя знаковую систему химии;
• изображать состав простейших веществ с помощью химических формул и сущность химических реакций с помощью химических уравнений;
• вычислять относительную молекулярную и молярную массы веществ, а также массовую долю химического элемента в соединениях для оценки их практической значимости;
• сравнивать по составу оксиды, основания, кислоты, соли;
• классифицировать оксиды и основания по свойствам, кислоты и соли по составу;
• пользоваться лабораторным оборудованием и химической посудой;
• проводить несложные химические опыты и наблюдения за изменениями свойств веществ в процессе их превращений; соблюдать правила техники безопасности при проведении наблюдений и опытов;
• различать экспериментально кислоты и щёлочи, пользуясь индикаторами; осознавать необходимость соблюдения мер безопасности при обращении с кислотами и щелочами.
• раскрывать смысл периодического закона Д. И. Менделеева;
• описывать и характеризовать табличную форму периодической системы химических элементов;
• характеризовать состав атомных ядер и распределение числа электронов по электронным слоям атомов химических элементов малых периодов периодической системы, а также калия и кальция;
• различать виды химической связи: ионную, ковалентную полярную, ковалентную неполярную и металлическую;
• изображать электронно-ионные формулы веществ, образованных химическими связями разного вида;
• выявлять зависимость свойств веществ от строения их кристаллических решёток: ионных, атомных, молекулярных, металлических;
• характеризовать химические элементы и их соединения на основе положения элементов в периодической системе и особенностей строения их атомов;
• характеризовать научное и мировоззренческое значение периодического закона и периодической системы химических элементов Д. И. Менделеева; • объяснять суть химических процессов и их принципиальное отличие от физических;
• называть признаки и условия протекания химических реакций;
• устанавливать принадлежность химической реакции к определённому типу по одному из классификационных признаков: 1) по числу и составу исходных веществ и продуктов реакции (реакции соединения, разложения, замещения и обмена); 2) по выделению или поглощению теплоты (реакции экзотермические и эндотермические); 3) по изменению степеней окисления химических элементов (реакции окислительно-восстановительные); 4) по обратимости процесса (реакции обратимые и необратимые);
• составлять уравнения электролитической диссоциации кислот, щелочей, солей; полные и сокращённые ионные уравнения реакций обмена; уравнения окислительно-восстановительных реакций;
• прогнозировать продукты химических реакций по формулам/названиям исходных веществ; определять исходные вещества по формулам/названиям продуктов реакции;
• составлять уравнения реакций, соответствующих последовательности («цепочке») превращений неорганических веществ различных классов;
• выявлять в процессе эксперимента признаки, свидетельствующие о протекании химической реакции;
• приготовлять растворы с определённой массовой долей растворённого вещества;
• определять характер среды водных растворов кислот и щелочей по изменению окраски индикаторов;
• проводить качественные реакции, подтверждающие наличие в водных растворах веществ отдельных ионов
• определять принадлежность неорганических веществ к одному из изученных классов/групп: металлы и неметаллы, оксиды, основания, кислоты, соли;
• составлять формулы веществ по их названиям;
• определять валентность и степень окисления элементов в веществах;
• составлять формулы неорганических соединений по валентностям и степеням окисления элементов, а также зарядам ионов, указанным в таблице растворимости кислот, оснований и солей;
• объяснять закономерности изменения физических и химических свойств простых веществ (металлов и неметаллов) и их высших оксидов, образованных элементами второго и третьего периодов;
• называть общие химические свойства, характерные для групп оксидов: кислотных, оснóвных;
• называть общие химические свойства, характерные для каждого из классов неорганических веществ: кислот, оснований, солей;
• приводить примеры реакций, подтверждающих химические свойства неорганических веществ: оксидов, кислот, оснований и солей;
• определять вещество-окислитель и вещество-восстановитель в окислительно-восстановительных реакциях;
• составлять окислительно-восстановительный баланс (для изученных реакций) по предложенным схемам реакций;
• проводить лабораторные опыты, подтверждающие химические свойства основных классов неорганических веществ;
Выпускник получит возможность научиться:
• грамотно обращаться с веществами в повседневной жизни;
• осознавать необходимость соблюдения правил экологически безопасного поведения в окружающей природной среде;
• понимать смысл и необходимость соблюдения предписаний, предлагаемых в инструкциях по использованию лекарств, средств бытовой химии и др.;
• использовать приобретённые ключевые компетентности при выполнении исследовательских проектов по изучению свойств, способов получения и распознавания веществ;
• развивать коммуникативную компетентность, используя средства устной и письменной коммуникации при работе с текстами учебника и дополнительной литературой, справочными таблицами, проявлять готовность к уважению иной точки зрения при обсуждении результатов выполненной работы;
• объективно оценивать информацию о веществах и химических процессах, критически относиться к псевдонаучной информации, недобросовестной рекламе, касающейся использования различных веществ.
• осознавать значение теоретических знаний для практической деятельности человека;
• описывать изученные объекты как системы, применяя логику системного анализа;
• применять знания о закономерностях периодической системы химических элементов для объяснения и предвидения свойств конкретных веществ;
• развивать информационную компетентность посредством углубления знаний об истории становления химической науки, её основных понятий, периодического закона как одного из важнейших законов природы, а также о современных достижениях науки и техники.
• составлять молекулярные и полные ионные уравнения по сокращённым ионным уравнениям;
• приводить примеры реакций, подтверждающих существование взаимосвязи между основными классами неорганических веществ;
• прогнозировать результаты воздействия различных факторов на изменение скорости химической реакции;
• прогнозировать результаты воздействия различных факторов на смещение химического равновесия.
• прогнозировать химические свойства веществ на основе их состава и строения;
• прогнозировать способность вещества проявлять окислительные или восстановительные свойства с учётом степеней окисления элементов, входящих в его состав;
• выявлять существование генетической взаимосвязи между веществами в ряду: простое вещество — оксид — гидроксид — соль;
• организовывать, проводить ученические проекты по исследованию свойств веществ, имеющих важное практическое значение.
Формы и средства контроля
Контроль (текущий, итоговый) за уровнем знаний учащихся предусматривает проведение лабораторных, практических, самостоятельных, тестовых и контрольных работ.
Контрольных работ - 4, по темам: «Атомы химических элементов», «Соединения химических элементов», «Изменения, происходящие с веществами», «Растворение. Растворы. Свойства растворов электролитов», самостоятельная работа по теме «Простые вещества».
Кроме вышеперечисленных основных форм контроля проводятся текущие самостоятельные работы в рамках каждой темы в виде фрагмента урока.
Критерии и нормы оценки знаний обучающихся
1. Оценка устного ответа
Отметка «5»:
- ответ полный и правильный на основании изученных теорий;
- материал изложен в определенной логической последовательности, литературным языком;
- ответ самостоятельный.
Ответ «4»;
- ответ полный и правильный на сновании изученных теорий;
- материал изложен в определенной логической последовательности, при этом допущены две-три несущественные ошибки, исправленные по требованию учителя.
Отметка «З»:
- ответ полный, но при этом допущена существенная ошибка или ответ неполный, несвязный.
Отметка «2»:
- при ответе обнаружено непонимание учащимся основного содержания учебного материала или допущены существенные ошибки, которые учащийся не может исправить при наводящих вопросах учителя, отсутствие ответа.
2. Оценка экспериментальных умений
Оценка ставится на основании наблюдения за учащимися и письменного отчета за работу.
Отметка «5»:
- работа выполнена полностью и правильно, сделаны правильные наблюдения и выводы;
- эксперимент осуществлен по плану с учетом техники безопасности и правил работы с веществами и оборудованием;
- проявлены организационно - трудовые умения, поддерживаются чистота рабочего места и порядок (на столе, экономно используются реактивы).
Отметка «4»:
- работа выполнена правильно, сделаны правильные наблюдения и выводы, но при этом эксперимент проведен не полностью или допущены несущественные ошибки в работе с веществами и оборудованием.
Отметка «3»:
- работа выполнена правильно не менее чем наполовину или допущена существенная ошибка в ходе эксперимента в объяснении, в оформлении работы, в соблюдении правил техники безопасности на работе с веществами и оборудованием, которая исправляется по требованию учителя.
Отметка «2»:
- допущены две (и более) существенные ошибки в ходе: эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые учащийся не может исправить даже по требованию учителя;
- работа не выполнена, у учащегося отсутствует экспериментальные умения.
3. Оценка умений решать расчетные задачи
Отметка «5»:
- в логическом рассуждении и решении нет ошибок, задача решена рациональным способом;
Отметка «4»:
- в логическом рассуждении и решения нет существенных ошибок, но задача решена нерациональным способом, или допущено не более двух несущественных ошибок.
Отметка «3»:
- в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах.
Отметка «2»:
- имеется существенные ошибки в логическом рассуждении и в решении;
- отсутствие ответа на задание.
4. Оценка письменных контрольных работ
Отметка «5»:
- ответ полный и правильный, возможна несущественная ошибка.
Отметка «4»:
- ответ неполный или допущено не более двух несущественных ошибок.
Отметка «3»:
- работа выполнена не менее чем наполовину, допущена одна существенная ошибка и при этом две-три несущественные.
Отметка «2»:
- работа выполнена меньше чем наполовину или содержит несколько существенных ошибок;
- работа не выполнена.
При оценке выполнения письменной контрольной работы необходимо учитывать требования единого орфографического режима.
5. Оценка тестовых работ
Тесты, состоящие из пяти вопросов можно использовать после изучения каждого материала (урока). Тест из 10-15 вопросов используется для периодического контроля. Тест из 20-30 вопросов необходимо использовать для итогового контроля.
При оценивании используется следующая шкала:
для теста из пяти вопросов
• нет ошибок — оценка «5»;
• одна ошибка — оценка «4»;
• две ошибки — оценка «З»;
• три ошибки — оценка «2».
Для теста из 30 вопросов:
• 25-З0 правильных ответов — оценка «5»;
• 19-24 правильных ответов — оценка «4»;
• 13-18 правильных ответов — оценка «З»;
• меньше 12 правильных ответов — оценка «2».
6. Оценка реферата.
Реферат оценивается по следующим критериям:
• соблюдение требований к его оформлению;
• необходимость и достаточность для раскрытия темы приведенной в тексте реферата информации;
• умение обучающегося свободно излагать основные идеи, отраженные в реферате;
• способность обучающегося понять суть задаваемых членами аттестационной комиссии вопросов и сформулировать точные ответы на них.
СОГЛАСОВАНО СОГЛАСОВАНО
Протокол заседания Заместитель директора по УВР
педагогического совета __________ Улейская З.П.
от 24.08.2020 г № 1 24 .08 2020г
Председатель педсовета
______ Стахурлова Н.П.
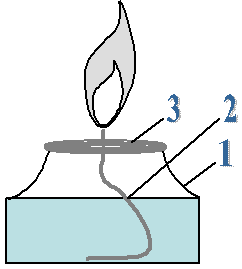
17.09.2014г Практическая работа №1
«Приемы обращения с лабораторным оборудованием. ТБ»
Инструктаж по технике безопасности.
Цель работы: Познакомиться с устройством и основными приемами обращения с лабораторным оборудованием.
Оборудование: Штатив, спиртовка, лабораторная посуда.
Ход работы
1. Устройство штатива (нарисовать штатив, обозначить его составные части)
| | Чугунная подставка Стержень Муфта Лапка Кольцо |
2.Устройство спиртовки (нарисовать спиртовку, обозначить её составные части)
| | 1.Сосуд 2.Фитиль 3.Металлическая трубка с диском 4.Колпачок | 1.Снять колпачок 2.Прроверить плотно ли прилегает диск к отверстию сосуда 3. Зажечь спиртовку горящей спичкой (НЕЛЬЗЯ ЗАЖИГАТЬ СПИРТОВКУ ОТ ДРУГОЙ ГОРЯЩЕЙ СПИРТОВКИ!)4. Погасить спиртовку накрыв пламя колпачком |
3.Посуда (нарисовать пробирки, колбы, химический стакан)
4.Фильтрование
1. приготовить фильтровальную бумагу;
2. смочить фильтровальную бумагу;
3. вложить в воронку;
4. жидкость наливают, по стеклянной палочке, направляя её на стенку воронки;
5. фильтрат, стекает по стенке стакана, а не в центр, чтобы не выплёскивался.
Найти в тексте определения фильтрата, осадка и процесса фильтрования.
| 23.09.2014 Практическая работа №2 «Физические и химические явления при горении свечи» Инструктаж по технике безопасности Цель работы: Изучение строения пламени. Определение продуктов горения. Оборудование: Свеча, резиновая груша, пробирки Реактивы: Известковая вода. Ход работы Опыт 1. Физические явления при горении: Зажгли свечу. Наблюдали: таяние парафина. Это физический процесс – плавление. Опыт 2. Наблюдали: на предметном стекле, внесённом в зону темного конуса пламени, образовалось чёрное пятно – сажа. Вывод: Наблюдали: сухая пробирка, находящаяся над пламенем запотела. Вывод: Наблюдали: в эту же пробирку быстро прилили известковой воды, она помутнела. Вывод: Опыт 3. Наблюдали: усиление яркости пламени при продувании грушей около пламени. Вывод: Наблюдали: горение свечи дольше под 3-х литровой банкой, чем под пол-литровой. Вывод: |
22.10.2014г.
Контрольная работа № 1 «Атомы химических элементов»
1 вариант
1. Расположите химические элементы
А) в порядке возрастания неметаллических свойств P, Cl, Mg.
Б) в порядке возрастания неметаллических свойств Tl, Al, Ga.
2. Дайте характеристику химических элементов B, C, Si
по плану:
химический символ и название элемента.
порядковый номер.
номер периода, группы, главная или побочная подгруппа.
заряд ядра атома.
число протонов и нейтронов в ядре.
общее число электронов.
число энергетических уровней.
число электронов на внешнем энергетическом уровне.
схема строения атома.
свойства химического элемента (металлические или неметаллические).
3. Укажите тип химической связи в соединениях: O2, Na, HBr, NaF. Запишите схему образования одного вида связи (по выбору).
Контрольная работа № 1 «Атомы химических элементов»
2 вариант
1. Расположите химические элементы
А) в порядке возрастания неметаллических свойств C, Be, N.
Б) в порядке возрастания неметаллических свойств Ba, Mg, Sr.
2. Дайте характеристику химических элементов O, S, Cl
по плану:
химический символ и название элемента.
порядковый номер.
номер периода, группы, главная или побочная подгруппа.
заряд ядра атома.
число протонов и нейтронов в ядре.
общее число электронов.
число энергетических уровней.
число электронов на внешнем энергетическом уровне.
схема строения атома.
свойства химического элемента (металлические или неметаллические).
Укажите тип химической связи в соединениях: H2O, F2, K, KCl. Запишите схему образования одного вида связи (по выбору).
25.11.14 Самостоятельная работа по теме «Простые вещества»
1. Запишите схемы образования молекул азота, брома, кислорода.
2. Запишите схему образования химических связей в соединениях: оксиде лития, хлориде калия, фториде кальция.
Найдите массу и число молекул при н.у. для 11,2л кислорода.
| 13.01.15 Практическая работа №3 «Очистка поваренной соли». Инструктаж по технике безопасности Цель работы: Научиться проводить разделение смесей, очистку веществ, фильтрование. Оборудование: смесь песка с солью, 2 стаканчика, стеклянная палочка, промывалка с водой, фильтр, воронка, спички, спиртовка, зажим, чашка для выпаривания. Ход работы Фронтальное обсуждение последовательности действий при разделении смеси песка и соли. Оформление таблицы и её заполнение по ходу работы.
В графе «Что делал» рисунки с подписями. Дополнительное задание. Составить план разделения смеси: а) речной песок, бензин, соль; б) железные, медные опилки, сахарный песок. |
14.01.15 Практическая работа №4
«Приготовление раствора сахара и определение массовой доли его в растворе»
Инструктаж по технике безопасности.
Цель работы: Научиться готовить растворы и определять их массовые доли.
Оборудование: Мерный цилиндр, коническая колба, чайная ложка, лабораторные весы, стеклянная палочка.
Реактивы: Сахар, вода.
Ход работы
Определить массу сахара (взвесить);
Приготовить раствор;
Рассчитать массовые доли сахара и воды в полученном растворе;
Рассчитать число молекул сахара в полученном растворе.
Д ано:
ано:
Н2О, С12Н22О12
mсахара=.
Vводы = 50мл.
______________
ωсахара =?
ωводы = ?
20.01.2015г
Контрольная работа №2 «Соединения химических элементов»
1 вариант
Рассчитайте степени окисления в следующих соединениях: NO2, NO, N2O, H3N.
(4 балла)
Определите вид химической связи в соединениях, формулы которых O2 , H3N, Mg, KCl.
(4 балла)
Определите класс вещества по формуле и назовите вещества H3PO4, CaCO3, P2O5, Fe(OH)3.
(8 баллов)
В 60г раствора содержится 18г соли. Определите массовую долю соли в данном растворе.
(30%), (4 балла)
Какой объём кислорода может быть получен из 5м3 воздуха, если объёмная доля кислорода в воздухе равна 21%7
(1,05%), (4 балла)
Максимум 24 балла, 95% от выполненной работы - «5», 70% - «4», 50% - «5»
Контрольная работа №2 «Соединения химических элементов»
2 вариант
Рассчитайте степени окисления в следующих соединениях: CO2, SiH4, H3P, P2O5.
(4 балла)
Определите вид химической связи в соединениях, формулы которых SO3, N2, Ca, FeCl3.
(4 балла)
Определите класс вещества по формуле и назовите вещества SO3, HCl, Cu(OH)2, FeCl3.
(8 баллов)
В 200г воды растворили 50г соли. Определите массовую долю соли в данном растворе.
(20%),(4 балла)
Какой объём азота может быть получен из 12м3 воздуха, если объёмная доля азота в воздухе равна 78%7
(9,36%), (4 балла)
Максимум 24 балла, 95% от выполненной работы – «5», 70% - «4», 50% - «3»
25.02.2014г
Контрольная работа №3 «Изменения, происходящие с веществами»
1 вариант
Разделите явления на физические и химические:
а) плавление металла, б) ржавление железа, в) образование зелёного налёта на бронзовых изделиях, г) движение автомобиля, д) полёт самолёта.
(5 баллов)
Расставьте коэффициенты в уравнениях химических реакций, укажите тип реакций:
А) Li + N2 → Li3N (1 балл)
Б) Al2O3 + Na→ Na2O + Al (1 балл)
В) SO2 + O2 → SO3 (1 балл)
Г) HCl + Cu(OH)2 → CuCl2 + H2O (1 балл)
3. Решить задачу.
Какой объём кислорода (н.у.) потребуется для полного сжигания 36г углерода (угля)?
( Ответ 67,2л) (6 баллов)
Решить задачу.
Какая масса оксида кальция образуется при сжигании в кислороде 8г кальция?
( Ответ 11,2г) (7 баллов).
Контрольная работа №3 «Изменения, происходящие с веществами»
2 вариант
Разделите явления на физические и химические:
а) плавление парафина, б)созревание плодов, в) сгорание бензина в автомобильном двигателе, г) движение велосипеда по шоссе, д) растворение сахара в чае.
(5 баллов)
Расставьте коэффициенты в уравнениях химических реакций, укажите тип реакций:
А) Al + CuCl2→ Cu + AlCl3 (1 балл)
Б) HgO → Hg + O2 (1 балл)
В) Zn + HCl → ZnCl2 + H2 (1 балл)
Г) Al + O2 → Al2O3 (1 балл)
3. Решить задачу.
Сколько граммов лития необходимо сжечь в кислороде для получения 15 г оксида лития по уравнению 4Li + O2 =2Li2O ) ( Ответ 7г) (6 баллов)
Решить задачу.
Какая масса фосфора может вступить в реакцию с 5,6л кислорода по уравнению 4Р + 5О2 =2Р2О5 ( Ответ 6,2л) (7 баллов).
3.03.15 Практическая работа №5
«Признаки химических реакций».
Инструктаж по технике безопасности
Цель работы: 1)провести химические реакции;
2) по признакам химических реакций доказать их осуществление.
Оборудование: спиртовка, штатив с пробирками.
Реактивы: медная проволока, H2SO4, HCl, роданид калия,
мел (CaCO3), FeCl3, Na2SO4, BaCl3.
Ход работы
Опыт 1. Прокаливание медной проволоки, получение оксида меди (II)
Cu + O2 =
Тип реакции:
Взаимодействие оксида меди(II) с серной кислотой.
CuO + H2SO4 =
Наблюдения:
Тип реакции:
Вывод:
Опыт 2. Взаимодействие мела с кислотой
CaCO3 + HCl =
Наблюдения:
Тип реакции:
Вывод:
Опыт 3. Взаимодействие хлорида железа (III) с роданидом калия
FeCl3 + KSCN =
Наблюдения:
Тип реакции:
Вывод:
Опыт 4. Взаимодействие карбоната натрия с хлоридом кальция
Na2CO3 + CaCl2 =
Наблюдения:
Тип реакции: Вывод:
13.05.2014г.
Контрольная работа №4 «Растворение. Растворы. Свойства растворов электролитов»
1 вариант
Даны уравнения:
FeO + 2H+ = H2O + Fe2+
2H+ + Cu(OH)2 = Cu2+ + 2H2O
SiO32- + 2H+ = H2SiO3↓
2H+ + CO32- = CO2↑ + H2O
Zn0 + 2H+ = Zn2+ + H20↑
А) Свойства какого класса электролитов описаны этими ионными уравнениями?
Б) Запишите молекулярные уравнения, соответствующие каждому из приведенных ионных уравнений. Для уравнения под номером 4 запишите два молекулярных уравнения.
Даны переходы:
Ca → CaO → Ca(OH)2 → Ca(NO3)2 → CaCO3
А) Генетический ряд какого элемента описан цепочкой превращений?
Б) Запишите молекулярные уравнения переходов.
В) Рассмотрите 1-й переход в свете ОВР, а последний – в свете ТЭД.
Напишите молекулярные и сокращенные ионно-молекулярные уравнения качественных реакций для сульфата железа (III).
Контрольная работа №4 «Растворение. Растворы. Свойства растворов электролитов»
2 вариант
Даны уравнения:
H2SiO3 + 2ОН- = 2H2O + SiO32-
H+ + ОН- = H2O
Cu2+ + 2OH- = Cu(OH)2↓
SO2 + 2OH- = SO32- + H2O
NH4+ + OH- = NH3↑ + H2O
А) Свойства какого класса электролитов описаны этими ионными уравнениями?
Б) Запишите молекулярные уравнения, соответствующие каждому из приведенных ионных уравнений. Для уравнения под номером 3 запишите два молекулярных уравнения.
Даны переходы:
S → SO2 → H2SO3 → Na2SO3 → SO2
А) Генетический ряд какого элемента описан цепочкой превращений?
Б) Запишите молекулярные уравнения переходов.
В) Рассмотрите 1-й переход в свете ОВР, а последний – в свете ТЭД.
Напишите молекулярные и сокращенные ионно-молекулярные уравнения качественных реакций для хлорида бария.
| 26.05.15 Практическая работа № 7 «Решение экспериментальных задач» Инструктаж по технике безопасности. Цель работы: Научиться опытным путем получать или определять вещества. Оборудование: спиртовка, штатив с пробирками. Реактивы: KCl, MgSO4, Zn, PbNO3, BaCl2, H2SO4 Ход работы
Выводы: Задание: Обнаружение сульфат-ионов SO42- и хлорид-ионов Cl- (стр.238 опыт 3); Получить хлорид цинка ZnSO4 (стр.242 задание 1): определить тип реакции, обратимость; для реакций ионного обмена привести уравнения в молекулярном, в полном и сокращенном ионном виде. окислительно-восстановительные реакции уравнять методом электронного баланса. |