

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Рабочие программы на 2016 - 2017 уч. год
Программы конкретизируют содержание стандарта, дают распределение учебных часов по разделам курса и рекомендуемую последовательность изучения тем и разделов с учетом межпредметных и внутрипредметных связей, логики учебного процесса, возрастных особенностей учащихся. В программах определен перечень демонстраций, лабораторных опытов, практических занятий и расчетных задач.
Просмотр содержимого документа
«РП БИОЛОГИЯ 5-6 класс ФГОС»

ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Главная цель совершенствования российского образования — повышение его доступности, качества и эффективности. Это предполагает значительное обновление содержания образования, приведение его в соответствие с требованиями времени и задачами развития государства. Образовательные учреждения должны осуществлять индивидуальный и дифференцированный подход к каждому ученику, стремиться максимально полно раскрыть его творческие способности, обеспечивать возможность успешной социализации.
Рабочая программа по биологии построена на основе фундаментального ядра содержания основного общего образования, Федерального государственного образовательного стандарта основного общего образования, Закона об образовании и основной программы образовательного процесса МБОУ «Сарагашская сош» на 2016-2017 уч. год.
Принятие нового государственного стандарта основного общего образования для 5—9 классов привело к изменению структуры школьного биологического образования. В настоящее время базовое биологическое образование должно обеспечить выпускникам высокую биологическую, экологическую и природоохранительную грамотность. Решить эту задачу можно на основе преемственного развития знаний в области основных биологических законов, теорий и идей, обеспечивающих фундамент для практической деятельности учащихся, формирования их научного мировоззрения.
Настоящая программа включает следующие разделы:
1) основное содержание;
2) тематическое планирование;
3) учебно-методическое обеспечение учебного процесса;
4) ожидаемые результаты обучения.
Рабочая программа по биологии построена на основе фундаментального ядра содержания основного общего образования, Федерального государственного образовательного стандарта основного общего образования, программы развития и формирования универсальных учебных действий, программы духовно-нравственного развития и воспитания личности.
Содержание курса биологии представляет собой первую ступень конкретизации положений, содержащихся в фундаментальном ядре содержания общего образования. Тематическое планирование — это следующая ступень конкретизации содержания образования по биологии. Оно даёт представление об основных видах учебной деятельности в процессе освоения курса биологии в основной школе. В примерном тематическом планировании указано число часов, отводимых на изучение каждого раздела.
В программе соблюдается преемственность с примерными программами начального общего образования, в том числе и в использовании основных видов учебной деятельности обучающихся.
Программа конкретизирует содержание предметных тем, перечисленных в образовательном стандарте, рекомендует последовательность их изучения и приводит примерное распределение учебных часов на изучение каждого раздела курса.
В программе особое внимание уделено содержанию, способствующему формированию современной естественнонаучной картины мира, показано практическое применение биологических знаний.
Отбор содержания проведён с учётом культуросообразного подхода, в соответствии с которым учащиеся должны освоить содержание, значимое для формирования познавательной, нравственной и эстетической культуры, сохранения окружающей среды и собственного здоровья, для повседневной жизни и практической деятельности.
Построение учебного содержания курса осуществляется последовательно от общего к частному с учётом реализации внутрипредметных и метапредметных связей. В основу положено взаимодействие научного, гуманистического, аксиологического, культурологического, личностно-деятельностного, историко-проблемного, интегративного, компетентностного подходов.
Изучение биологии на ступени основного общего образования традиционно направлено на формирование у учащихся представлений об отличительных особенностях объектов живой природы, их многообразии и эволюции; о человеке как биосоциальном существе. Для формирования у учащихся основ научного мировоззрения, развития интеллектуальных способностей и познавательных интересов в процессе изучения биологии основное внимание уделяется знакомству учащихся с методами научного познания живой природы, постановке проблем, требующих от учащихся самостоятельной деятельности по их разрешению.
Содержание курса направлено на формирование универсальных учебных действий, обеспечивающих развитие познавательных и коммуникативных качеств личности. Обучающиеся включаются в проектную и исследовательскую деятельность, основу которой составляют такие учебные действия, как умение видеть проблемы, ставить вопросы, классифицировать, наблюдать, проводить эксперимент, делать выводы, объяснять, доказывать, защищать свои идеи, давать определения понятий, структурировать материал и др. Учащиеся включаются в коммуникативную учебную деятельность, где преобладают такие её виды, как умение полно и точно выражать свои мысли, аргументировать свою точку зрения, работать в группе, представлять и сообщать информацию в устной и письменной форме, вступать в диалог и т. д.
Предлагаемая рабочая программа реализуется в учебниках биологии и учебно-методических пособиях, созданных коллективом авторов под руководством В. В. Пасечника.
Учебное содержание курса биологии включает следующие разделы:
1) «Бактерии. Грибы. Растения» — 35 часов (5 класс);
2) «Многообразие покрытосеменных растений» — 35 часов (6 класс);
Такое построение программы сохраняет лучшие традиции в подаче учебного материала с постепенным усложнением уровня его изложения в соответствии с возрастом учащихся. Оно предполагает последовательное формирование и развитие основополагающих биологических понятий с 5 по 9 класс.
В 5 классе учащиеся узнают, чем живая природа отличается от неживой; получают общие представления о структуре биологической науки, ее истории и методах исследования, царствах живых организмов, средах обитания организмов, нравственных нормах и принципах отношения к природе. Учащиеся получают сведения о клетке, тканях и органах живых организмов, углубляются их знания об условиях жизни и разнообразии, распространении и значении бактерий, грибов и растений, о значении этих организмов в природе и жизни человека.
В 6—7 классах учащиеся получают знания о строении, жизнедеятельности и многообразии растений и животных, принципах их классификации; знакомятся с эволюцией строения живых организмов, взаимосвязью строения и функций органов и их систем, с индивидуальным развитием и эволюцией растений и животных. Они узнают о практическом значении биологических знаний как научной основе охраны природы, природопользования, сельскохозяйственного производства, медицины и здравоохранения, биотехнологии и отраслей производства, основанных на использовании биологических систем.
В 8 классе получают знания о человеке как о биосоциальном существе, его становлении в процессе антропогенеза и формировании социальной среды. Определение систематического положения человека в ряду живых существ, его генетическая связь с животными предками позволяют осознать учащимся единство биологических законов, их проявление на разных уровнях организации, понять взаимосвязь строения и функций органов и систем и убедиться в том, что выбор того или иного сценария поведения возможен лишь в определенных границах, за пределами которых теряется волевой контроль и процессы идут по биологическим законам, не зависящим от воли людей. Таким образом, выбор между здоровым образом жизни и тем, который ведет к болезни, возможен лишь на начальном этапе. Отсюда следует важность знаний о строении и функциях человеческого тела, о факторах, благоприятствующих здоровью человека и нарушающих его. Методы самоконтроля, способность выявить возможные нарушения здоровья и вовремя обратиться к врачу, оказать при необходимости доврачебную помощь, отказ от вредных привычек — важный шаг к сохранению здоровья и высокой работоспособности. В курсе уделяется большое внимание санитарно-гигиенической службе, охране природной среды, личной гигиене.
Включение сведений по психологии позволит более рационально организовать учебную, трудовую, спортивную деятельность и отдых, легче вписаться в коллектив сверстников и стать личностью.
В 9 классе обобщают знания о жизни и уровнях ее организации, раскрывают мировоззренческие вопросы о происхождении и развитии жизни на Земле, обобщают и углубляют понятия об эволюционном развитии организмов. Учащиеся получат знания основ цитологии, генетики, селекции, теории эволюции.
Полученные биологические знания служат основой при рассмотрении экологии организма, популяции, биоценоза, биосферы и об ответственности человека за жизнь на Земле.
Учащиеся должны усвоить и применять в своей деятельности основные положения биологической науки о строении и жизнедеятельности организмов, их индивидуальном и историческом развитии, структуре, функционировании, многообразии экологических систем, их изменении под влиянием деятельности человека; научиться принимать экологически правильные решения в области природопользования.
Изучение биологии по предлагаемой программе предполагает ведение фенологических наблюдений, опытнической и практической работы. Для понимания учащимися сущности биологических явлений в программу введены лабораторные работы, экскурсии, демонстрации опытов, проведение наблюдений. Все это дает возможность направленно воздействовать на личность учащегося: тренировать память, развивать наблюдательность, мышление, обучать приемам самостоятельной учебной деятельности, способствовать развитию любознательности и интереса к предмету.
Содержание программы
Биология.
Бактерии. Грибы. Растения. 5 класс
(34 часа, 1 час в неделю)
Введение (6 часов)
Биология — наука о живой природе. Методы исследования в биологии. Царства бактерий, грибов, растений и животных. Отличительные признаки живого и неживого. Связь организмов со средой обитания. Взаимосвязь организмов в природе. Экологические факторы и их влияние на живые организмы. Влияние деятельности человека на природу, ее охрана.
Лабораторные и практические работы
Фенологические наблюдения за сезонными изменениями в природе. Ведение дневника наблюдений.
Экскурсии
Многообразие живых организмов, осенние явления в жизни растений и животных.
Предметные результаты обучения
Учащиеся должны знать:
— о многообразии живой природы;
— царства живой природы: Бактерии, Грибы, Растения, Животные;
— основные методы исследования в биологии: наблюдение, эксперимент, измерение;
— признаки живого: клеточное строение, питание, дыхание, обмен веществ, раздражимость, рост, развитие, размножение;
— экологические факторы;
— основные среды обитания живых организмов: водная среда, наземно-воздушная среда, почва как среда обитания, организм как среда обитания;
— правила работы с микроскопом;
— правила техники безопасности при проведении наблюдений и лабораторных опытов в кабинете биологии.
Учащиеся должны уметь:
— определять понятия «биология», «экология», «биосфера», «царства живой природы», «экологические факторы»;
— отличать живые организмы от неживых;
— пользоваться простыми биологическими приборами, инструментами и оборудованием;
— характеризовать среды обитания организмов;
— характеризовать экологические факторы;
— проводить фенологические наблюдения;
— соблюдать правила техники безопасности при проведении наблюдений и лабораторных опытов.
Метапредметные результаты обучения
Учащиеся должны уметь:
— составлять план текста;
— владеть таким видом изложения текста, как повествование;
— под руководством учителя проводить непосредственное наблюдение;
— под руководством учителя оформлять отчет, включающий описание наблюдения, его результаты, выводы;
— получать биологическую информацию из различных источников;
— определять отношения объекта с другими объектами;
— определять существенные признаки объекта.
Раздел 1. Клеточное строение организмов (10 часов)
Устройство увеличительных приборов (лупа, световой микроскоп). Клетка и ее строение: оболочка, цитоплазма, ядро, вакуоли, пластиды. Жизнедеятельность клетки: поступление веществ в клетку (дыхание, питание), рост, развитие и деление клетки. Понятие «ткань».
Демонстрации
Микропрепараты различных растительных тканей.
Лабораторные и практические работы
Устройство лупы и светового микроскопа. Правила работы с ними. Изучение клеток растения с помощью лупы. Приготовление препарата кожицы чешуи лука, рассматривание его под микроскопом. Приготовление препаратов и рассматривание под микроскопом пластид в клетках листа элодеи, плодов томатов, рябины, шиповника. Приготовление препарата и рассматривание под микроскопом движения цитоплазмы в клетках листа элодеи. Рассматривание под микроскопом готовых микропрепаратов различных растительных тканей.
Предметные результаты обучения
Учащиеся должны знать:
— строение клетки;
— химический состав клетки;
— основные процессы жизнедеятельности клетки;
— характерные признаки различных растительных тканей.
Учащиеся должны уметь:
— определять понятия: «клетка», «оболочка», « цитоплазма», « ядро», «ядрышко», «вакуоли», « пластиды», « хлоропласты», «пигменты», «хлорофилл»;
— работать с лупой и микроскопом;
— готовить микропрепараты и рассматривать их под микроскопом;
— распознавать различные виды тканей.
Метапредметные результаты обучения
Учащиеся должны уметь:
— анализировать объекты под микроскопом;
— сравнивать объекты под микроскопом с их изображением на рисунках и определять их;
— оформлять результаты лабораторной работы в рабочей тетради;
— работать с текстом и иллюстрациями учебника.
Раздел 2. Царство Бактерии. Царство Грибы (7 часов)
Строение и жизнедеятельность бактерий. Размножение бактерий. Бактерии, их роль в природе и жизни человека. Разнообразие бактерий, их распространение в природе.
Грибы. Общая характеристика грибов, их строение и жизнедеятельность. Шляпочные грибы. Съедобные и ядовитые грибы. Правила сбора съедобных грибов и их охрана. Профилактика отравления грибами. Дрожжи, плесневые грибы. Грибы-паразиты. Роль грибов в природе и жизни человека.
Демонстрация
Муляжи плодовых тел шляпочных грибов. Натуральные объекты (трутовик, ржавчина, головня, спорынья).
Лабораторные и практические работы
Строение плодовых тел шляпочных грибов. Строение плесневого гриба мукора. Строение дрожжей.
Предметные результаты обучения
Учащиеся должны знать:
— строение и основные процессы жизнедеятельности бактерий и грибов;
— разнообразие и распространение бактерий и грибов;
— роль бактерий и грибов в природе и жизни человека.
Учащиеся должны уметь:
— давать общую характеристику бактериям и грибам;
— отличать бактерии и грибы от других живых организмов;
— отличать съедобные грибы от ядовитых;
— объяснять роль бактерий и грибов в природе и жизни человека.
Метапредметные результаты обучения
Учащиеся должны уметь:
— работать с учебником, рабочей тетрадью и дидактическими материалами;
— составлять сообщения на основе обобщения материала учебника и дополнительной литературы.
Раздел 3. Царство Растения (9 часов)
Растения. Ботаника — наука о растениях. Методы изучения растений. Общая характеристика растительного царства. Многообразие растений, их связь со средой обитания. Роль в биосфере. Охрана растений.
Основные группы растений (водоросли, мхи, хвощи, плауны, папоротники, голосеменные, цветковые).
Водоросли. Многообразие водорослей. Среда обитания водорослей. Строение одноклеточных и многоклеточных водорослей. Роль водорослей в природе и жизни человека, охрана водорослей.
Лишайники, их строение, разнообразие, среда обитания. Значение в природе и жизни человека.
Мхи. Многообразие мхов. Среда обитания. Строение мхов, их значение.
Папоротники, хвощи, плауны, их строение, многообразие, среда обитания, роль в природе и жизни человека, охрана.
Голосеменные, их строение и разнообразие. Среда обитания. Распространение голосеменных, значение в природе и жизни человека, их охрана.
Цветковые растения, их строение и многообразие. Среда обитания. Значение цветковых в природе и жизни человека.
Происхождение растений. Основные этапы развития растительного мира.
Демонстрация
Гербарные экземпляры растений. Отпечатки ископаемых растений.
Лабораторные и практические работы
Строение зеленых водорослей. Строение мха (на местных видах). Строение спороносящего хвоща. Строение спороносящего папоротника. Строение хвои и шишек хвойных (на примере местных видов).
Предметные результаты обучения
Учащиеся должны знать:
— основные методы изучения растений;
— основные группы растений (водоросли, мхи, хвощи, плауны, папоротники, голосеменные, цветковые), их строение и многообразие;
— особенности строения и жизнедеятельности лишайников;
— роль растений в биосфере и жизни человека;
— происхождение растений и основные этапы развития растительного мира.
Учащиеся должны уметь:
— давать общую характеристику растительного царства;
— объяснять роль растений биосфере;
— давать характеристику основным группам растений (водоросли, мхи, хвощи, плауны, папоротники, голосеменные, цветковые);
— объяснять происхождение растений и основные этапы развития растительного мира.
Метапредметные результаты обучения
Учащиеся должны уметь:
— выполнять лабораторные работы под руководством учителя;
— сравнивать представителей разных групп растений, делать выводы на основе сравнения;
— оценивать с эстетической точки зрения представителей растительного мира;
— находить информацию о растениях в научно-популярной литературе, биологических словарях и справочниках, анализировать и оценивать её, переводить из одной формы в другую.
Личностные результаты обучения
Учащиеся должны:
— испытывать чувство гордости за российскую биологическую науку;
— знать правила поведения в природе;
— понимать основные факторы, определяющие взаимоотношения человека и природы;
— уметь реализовывать теоретические познания на практике;
— понимать социальную значимость и содержание профессий, связанных с биологией;
— испытывать любовь к природе;
— признавать право каждого на собственное мнение;
— проявлять готовность к самостоятельным поступкам и действиям на благо природы;
— уметь отстаивать свою точку зрения;
— критично относиться к своим поступкам, нести ответственность за последствия;
— уметь слушать и слышать другое мнение.
Резервное время — 3 часа
Тематическое планирование
5 класс. Бактерии. Грибы. Растения (34 часа, 1 час в неделю)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Содержание программы
Биология. Многообразие покрытосеменных растений. 6 класс
(34 часа, 1 час в неделю)
Раздел 1. Строение и многообразие покрытосеменных растений
(14 часов)
Строение семян однодольных и двудольных растений. Виды корней и типы корневых систем. Зоны (участки) корня. Видоизменения корней.
Побег. Почки и их строение. Рост и развитие побега.
Внешнее строение листа. Клеточное строение листа. Видоизменения листьев.
Строение стебля. Многообразие стеблей. Видоизменения побегов.
Цветок и его строение. Соцветия. Плоды и их классификация. Распространение плодов и семян.
Демонстрация
Внешнее и внутреннее строения корня. Строение почек (вегетативной и генеративной) и расположение их на стебле. Строение листа. Макро- и микростроение стебля. Различные виды соцветий. Сухие и сочные плоды.
Лабораторные и практические работы
Строение семян двудольных и однодольных растений. Виды корней. Стержневая и мочковатая корневые системы. Корневой чехлик и корневые волоски. Строение почек. Расположение почек на стебле. Внутреннее строение ветки дерева. Видоизмененные побеги (корневище, клубень, луковица). Строение цветка. Различные виды соцветий. Многообразие сухих и сочных плодов.
Предметные результаты обучения
Учащиеся должны знать:
— внешнее и внутреннее строение органов цветковых растений;
— видоизменения органов цветковых растений и их роль в жизни растений.
Учащиеся должны уметь:
— различать и описывать органы цветковых растений;
— объяснять связь особенностей строения органов растений со средой обитания;
— изучать органы растений в ходе лабораторных работ.
Метапредметные результаты обучения
Учащиеся должны уметь:
— анализировать и сравнивать изучаемые объекты;
— осуществлять описание изучаемого объекта;
— определять отношения объекта с другими объектами;
— определять существенные признаки объекта;
— классифицировать объекты;
— проводить лабораторную работу в соответствии с инструкцией.
Раздел 2. Жизнь растений (10 часов)
Основные процессы жизнедеятельности (питание, дыхание, обмен веществ, рост, развитие, размножение).
Минеральное и воздушное питание растений. Фотосинтез. Дыхание растений. Испарение воды. Листопад. Передвижение воды и питательных веществ в растении. Прорастание семян. Способы размножения растений. Размножение споровых растений. Размножение голосеменных растений. Половое и бесполое (вегетативное) размножение покрытосеменных растений.
Демонстрация
Опыты, доказывающие значение воды, воздуха и тепла для прорастания семян; питание проростков запасными веществами семени; получение вытяжки хлорофилла; поглощение растениями углекислого газа и выделение кислорода на свету; образование крахмала; дыхание растений; испарение воды листьями; передвижение органических веществ по лубу.
Лабораторные и практические работы
Передвижение воды и минеральных веществ по древесине. Вегетативное размножение комнатных растений. Определение всхожести семян растений и их посев.
Экскурсии
Зимние явления в жизни растений.
Предметные результаты обучения
Учащиеся должны знать:
— основные процессы жизнедеятельности растений;
— особенности минерального и воздушного питания растений;
— виды размножения растений и их значение.
Учащиеся должны уметь:
— характеризовать основные процессы жизнедеятельности растений;
— объяснять значение основных процессов жизнедеятельности растений;
— устанавливать взаимосвязь между процессами дыхания и фотосинтеза;
— показывать значение процессов фотосинтеза в жизни растений и в природе;
— объяснять роль различных видов размножения у растений;
— определять всхожесть семян растений.
Метапредметные результаты обучения
Учащиеся должны уметь:
— анализировать результаты наблюдений и делать выводы;
— под руководством учителя оформлять отчет, включающий описание эксперимента, его результатов, выводов.
Раздел 3. Классификация растений (6 часов)
Основные систематические категории: вид, род, семейство, класс, отдел, царство. Знакомство с классификацией цветковых растений.
Класс Двудольные растения. Морфологическая характеристика 3—4 семейств (с учетом местных условий).
Класс Однодольные растения. Морфологическая характеристика злаков и лилейных.
Важнейшие сельскохозяйственные растения, биологические основы их выращивания и народнохозяйственное значение. (Выбор объектов зависит от специализации растениеводства в каждой конкретной местности.)
Демонстрация
Живые и гербарные растения, районированные сорта важнейших сельскохозяйственных растений.
Лабораторные и практические работы
Выявление признаков семейства по внешнему строению растений.
Экскурсии
Ознакомление с выращиванием растений в защищенном грунте.
Предметные результаты обучения
Учащиеся должны знать:
— основные систематические категории: вид, род, семейство, класс, отдел, царство;
— характерные признаки однодольных и двудольных растений;
— признаки основных семейств однодольных и двудольных растений;
— важнейшие сельскохозяйственные растения, биологические основы их выращивания и народнохозяйственное значение.
Учащиеся должны уметь:
— делать морфологическую характеристику растений;
— выявлять признаки семейства по внешнему строению растений;
— работать с определительными карточками.
Метапредметные результаты обучения
Учащиеся должны уметь:
— различать объем и содержание понятий;
— различать родовое и видовое понятия;
— определять аспект классификации;
— осуществлять классификацию.
Раздел 4. Природные сообщества (3 часа)
Взаимосвязь растений с другими организмами. Симбиоз. Паразитизм. Растительные сообщества и их типы.
Развитие и смена растительных сообществ. Влияние деятельности человека на растительные сообщества и влияние природной среды на человека.
Экскурсии
Природное сообщество и человек. Фенологические наблюдения за весенними явлениями в природных сообществах.
Предметные результаты обучения
Учащиеся должны знать:
— взаимосвязь растений с другими организмами;
— растительные сообщества и их типы;
— закономерности развития и смены растительных сообществ;
— о результатах влияния деятельности человека на растительные сообщества и влияния природной среды на человека.
Учащиеся должны уметь:
— устанавливать взаимосвязь растений с другими организмами;
— определять растительные сообщества и их типы;
— объяснять влияние деятельности человека на растительные сообщества и влияние природной среды на человека;
— проводить фенологические наблюдения за весенними явлениями в природных сообществах.
Метапредметные результаты обучения
Учащиеся должны уметь:
— под руководством учителя оформлять отчет, включающий описание объектов, наблюдений, их результаты, выводы;
— организовывать учебное взаимодействие в группе (распределять роли, договариваться друг с другом и т. д.).
Личностные результаты обучения
Учащиеся должны:
— испытывать чувство гордости за российскую биологическую науку;
— соблюдать правила поведения в природе;
— понимать основные факторы, определяющие взаимоотношения человека и природы;
— уметь реализовывать теоретические познания на практике;
— осознавать значение обучения для повседневной жизни и осознанного выбора профессии;
— понимать важность ответственного отношения к учению, готовности и способности обучающихся к саморазвитию и самообразованию на основе мотивации к обучению и познанию;
— проводить работу над ошибками для внесения корректив в усваиваемые знания;
— испытывать любовь к природе, чувства уважения к ученым, изучающим растительный мир, и эстетические чувства от общения с растениями;
— признавать право каждого на собственное мнение;
— проявлять готовность к самостоятельным поступкам и действиям на благо природы;
— уметь отстаивать свою точку зрения;
— критично относиться к своим поступкам, нести ответственность за их последствия;
— понимать необходимость ответственного, бережного отношения к окружающей среде;
— уметь слушать и слышать другое мнение;
— уметь оперировать фактами как для доказательства, так и для опровержения существующего мнения.
Тематическое планирование.
Биология. Многообразие покрытосеменных растений.
6 класс (34 часа, 1 час в неделю)
| Раздел 1. Строение и многообразие покрытосеменных растений (13 часов)
| ||
| Строение семян двудольных растений | Строение семян. Лабораторная работа Изучение строения семян двудольных растений | Определяют понятия «однодольные растения», «двудольные растения», «семядоля», «эндосперм», «зародыш», «семенная кожура», «семяножка», «микропиле» . Отрабатывают умения, необходимые для выполнения лабораторных работ. Изучают инструктаж-памятку последовательности действий при проведении анализа |
| Строение семян однодольных растений | Особенности строения семян однодольных растений Лабораторная работа Изучение строения семян однодольных растений | Закрепляют понятия из предыдущего урока. Применяют инструктаж-памятку последовательности действий при проведении анализа строения семян |
| Виды корней. Типы корневых систем | Функции корня. Главный, боковые и придаточные корни. Стержневая и мочковатая корневые системы. Лабораторная работа Виды корней. Стержневые и мочковатые корневые системы | Определяют понятия «главный корень», «боковые корни», «придаточные корни», «стержневая корневая система», «мочковатая корневая система». Анализируют виды корней и типы корневых систем |
| Строение корней | Участки (зоны) корня. Внешнее и внутреннее строение корня. Лабораторная работа Корневой чехлик и корневые волоски | Определяют понятия «корневой чехлик», «корневой волосок», «зона деления», «зона растяжения», «зона всасывания», «зона проведения». Анализируют строение корня |
| Условия произрастания и видоизменения корней | Приспособления корней к условиям существования. Видоизменения корней | Определяют понятия «корнеплоды», «корневые клубни», «воздушные корни», «дыхательные корни». Устанавливают причинно-следственные связи между условиями существования и видоизменениями корней |
| Побег. Почки и их строение. Рост и развитие побега | Побег. Листорасположение. Строение почек. Расположение почек на стебле. Рост и развитие побега. Лабораторная работа Строение почек. Расположение почек на стебле | Определяют понятия «побег», «почка», «верхушечная почка», «пазушная почка», придаточная почка», «вегетативная почка», «генеративная почка», «конус нарастания», «узел», «междоузлие», «пазуха листа», «очередное листорасположение», «супротивное листорасположение», «мутовчатое расположение». Анализируют результаты лабораторной работы и наблюдений за ростом и развитием побега |
| Внешнее строение листа | Внешнее строение листа. Форма листа. Листья простые и сложные. Жилкование листьев. Лабораторная работа Листья простые и сложные, их жилкование и листорасположение | Определяют понятия «листовая пластинка», «черешок», «черешковый лист», «сидячий лист», «простой лист», «сложный лист», «сетчатое жилкование», «параллельное жилкование», «дуговое жилкование». Заполняют таблицу по результатам изучения различных листьев |
| Клеточное строение листа. Видоизменение листьев | Строение кожицы листа, строение мякоти листа. Влияние факторов среды на строение листа. Видоизменения листьев. Лабораторные работы Строение кожицы листа Клеточное строение листа | Определяют понятия «кожица листа», «устьица», «хлоропласты», «столбчатая ткань листа», «губчатая ткань листа», « мякоть листа», «проводящий пучок», «сосуды», « ситовидные трубки», «волокна», «световые листья», «теневые листья», «видоизменения листьев». Выполняют лабораторные работы и обсуждают их результаты |
| Строение стебля. Многообразие стеблей | Строение стебля. Многообразие стеблей. Лабораторная работа Внутреннее строение ветки дерева | Определяют понятия «травянистый стебель», «деревянистый стебель», «прямостоячий стебель», «вьющийся стебель», «лазающий стебель», «ползучий стебель», «чечевички», «пробка», «кора», «луб», «ситовидные трубки», « лубяные волокна», «камбий», «древесина», «сердцевина», «сердцевинные лучи». Выполняют лабораторную работу и обсуждают ее результаты |
| Видоизменение побегов | Строение и функции видоизмененных побегов. Лабораторная работа Изучение видоизмененных побегов (корневище, клубень, луковица) | Определяют понятия «видоизмененный побег», «корневище», «клубень», «луковица». Выполняют лабораторную работу и обсуждают ее результаты |
| Цветок и его строение | Строение цветка. Венчик цветка. Чашечка цветка. Околоцветник. Строение тычинки и пестика. Растения однодомные и двудомные. Формула цветка. Лабораторная работа Изучение строения цветка | Определяют понятия «пестик», «тычинка», «лепестки», «венчик», «чашелистики», « чашечка», «цветоножка», «цветоложе», «простой околоцветник», «двойной околоцветник», «тычиночная нить», «пыльник», «рыльце», «столбик», «завязь», «семязачаток», «однодомные растения», «двудомные растения». Выполняют лабораторную работу и обсуждают ее результаты
|
| Соцветия | Виды соцветий. Значение соцветий. Лабораторная работа Ознакомление с различными видами соцветий | Выполняют лабораторную работу. Заполняют таблицу по результатам работы с текстом учебника и дополнительной литературой |
| Плоды и их классификация | Строение плодов. Классификация плодов. Лабораторная работа Ознакомление с сухими и сочными плодами | Определяют понятия «околоплодник», «простые плоды», «сборные плоды», «сухие плоды», «сочные плоды», «односемянные плоды», «многосемянные плоды», «ягода», « костянка», «орех», « зерновка», «семянка», «боб», «стручок», «коробочка», «соплодие». Выполняют лабораторную работу. Анализируют и сравнивают различные плоды. Обсуждают результаты работы
|
| Распространение плодов и семян | Способы распространения плодов и семян. Приспособления, выработавшиеся у плодов и семян в связи с различными способами распространения | Работают с текстом учебника, коллекциями, гербарными экземплярами. Наблюдают за способами распространения плодов и семян в природе. Готовят сообщение «Способы распространения плодов и семян и их значение для растений» |
| Раздел 2. Жизнь растений (10 часов)
| ||
| Минеральное питание растений | Почвенное питание растений. Поглощение воды и минеральных веществ. Управление почвенным питанием растений. Минеральные и органические удобрения. Способы, сроки и дозы внесения удобрений. Вред, наносимый окружающей среде использованием значительных доз удобрений. Меры охраны природной среды | Определяют понятия «минеральное питание», «корневое давление», «почва», «плодородие», «удобрение». Выделяют существенные признаки почвенного питания растений. Объясняют необходимость восполнения запаса питательных веществ в почве путём внесения удобрений. Оценивают вред, наиносимый окружающей среде использованием значительных доз удобрений. Приводят доказательства (аргументация) необходимости защиты окружающей среды, соблюдения правил отношения к живой природе |
| Фотосинтез | Фотосинтез. Хлоропласты, хлорофилл, их роль в фотосинтезе. Управление фотосинтезом растений: условия, влияющие на интенсивность фотосинтеза. Значение фотосинтеза. Роль растений в образовании и накоплении органических веществ и кислорода на Земле | Выявляют приспособленность растений к использованию света в процессе фотосинтеза. Определяют условия протекания фотосинтеза. Объясняют значение фотосинтеза и роль растений в природе и жизни человека |
| Дыхание растений | Дыхание растений, его сущность. Роль устьиц, чечевичек и межклетников в газообмене у растений. Взаимосвязь процессов дыхания и фотосинтеза | Выделяют существенные признаки дыхания. Объясняют роль дыхания в процессе обмена веществ. Объясняют роли кислорода в процессе дыхания. Раскрывают значение дыхания в жизни растений. Устанавливают взаимосвязь процессов дыхания и фотосинтеза |
| Испарение воды растениями. Листопад | Испарение воды растениями, его значение. Листопад, его значение. Осенняя окраска листьев | Определяют значение испарения воды и листопада в жизни растений |
| Передвижение воды и питательных веществ в растении | Передвижение веществ в растении. Транспорт веществ как составная часть обмена веществ. Проводящая функция стебля. Передвижение воды, минеральных и органических веществ в растении. Запасание органических веществ в органах растений, их использование на процессы жизнедеятельности. Защита растений от повреждений. Лабораторная работа Передвижение веществ по побегу растения | Объясняют роль транспорта веществ в процессе обмена веществ. Объясняют механизм осуществления проводящей функции стебля. Объясняют особенности передвижения воды, минеральных и органических веществ в растениях. Проводят биологические эксперименты по изучению процессов жизнедеятельности организмов и объясняют их результаты. Приводят доказательства (аргументация) необходимости защиты растений от повреждений |
| Прорастание семян | Роль семян в жизни растений. Условия, необходимые для прорастания семян. Посев семян. Рост и питание проростков. Лабораторная работа Определение всхожести семян растений и их посев | Объясняют роль семян в жизни растений. Выявляют условия, необходимые для прорастания семян. Обосновывают необходимость соблюдения сроков и правил проведения посевных работ |
| Способы размножения растений | Размножение организмов, его роль в преемственности поколений. Размножение как важнейшее свойство организмов. Способы размножения организмов. Бесполое размножение растений. Половое размножение, его особенности. Половые клетки. Оплодотворение. Значение полового размножения для потомства и эволюции органического мира | Определяют значение размножения в жизни организмов. Характеризуют особенности бесполого размножения. Объясняют значение бесполого размножения. Раскрывают особенности и преимущества полового размножения по сравнению с бесполым. Объясняют значение полового размножения для потомства и эволюции органического мира |
| Размножение споровых растений | Размножение водорослей, мхов, папоротников. Половое и бесполое размножение у споровых. Чередование поколений | Определяют понятия «заросток», «предросток», «зооспора», «спорангий». Объясняют роль условий среды для полового и бесполого размножения, а также значение чередования поколений у споровых растений |
| Размножение семенных растений | Размножение голосеменных и покрытосеменных растений. Опыление. Способы опыления. Оплодотворение. Двойное оплодотворение. Образование плодов и семян | Определение понятий: «пыльца», «пыльцевая трубка», «пыльцевое зерно», «зародышевый мешок», «пыльцевход», «центральная клетка», «двойное оплодотворение», «опыление», «перекрестное опыление», «самоопыление», «искусственное опыление». Объясняют преимущества семенного размножения перед споровым. Сравнивают различные способы опыления и их роли. Объясняют значение оплодотворения и образования плодов и семян. |
| Вегетативное размножение покрытосеменных растений | Способы вегетативного размножения. Лабораторная работа Вегетативное размножение комнатных растений | Определяют понятия «черенок», «отпрыск», «отводок», «прививка», «культура тканей», «привой», «подвой». Объясняют значение вегетативного размножения покрытосеменных растений и его использование человеком |
| Раздел 3. Классификация растений (6 часов) | ||
| Систематика растений | Основные систематические категории: вид, род, семейство, класс, отдел, царство. Знакомство с классификацией цветковых растений | Определяют понятия «вид», «род», «семейство», «класс», «отдел», «царство». Выделяют признаки, характерные для двудольных и однодольных растений |
| Класс Двудольные растения. Семейства Крестоцветные и Розоцветные | Признаки, характерные для растений семейств Крестоцветные и Розоцветные | Выделяют основные особенности растений семейств Крестоцветные и Розоцветные. Знакомятся с определительными карточками |
| Семейства Пасленовые и Бобовые | Признаки, характерные для растений семейств Пасленовые и Бобовые | Выделяют основные особенности растений семейств Пасленовые и Бобовые. Определяют растения по карточкам |
| Семейство Сложноцветные | Признаки, характерные для растений семейства Сложноцветные | Выделяют основные особенности растений семейства Сложноцветные. Определяют растения по карточкам |
| Класс Однодольные. Семейства Злаковые и Лилейные. | Признаки, характерные для растений семейств Злаковые и Лилейные | Выделяют основные особенности растений семейств Злаковые и Лилейные. Определяют растения по карточкам |
| Важнейшие сельскохозяйственные растения | Важнейшие сельскохозяйственные растения, агротехника их возделывания, использование человеком | Готовят сообщения на основе изучения текста учебника, дополнительной литературы и материалов Интернета об истории введения в культуру и агротехнике важнейших культурных двудольных и однодольных растений, выращиваемых в местности проживания школьников |
| Раздел 4. Природные сообщества (3 часа)
| ||
| Природные сообщества. Взаимосвязи в растительном сообществе | Типы растительных сообществ. Взаимосвязи в растительном сообществе. Сезонные изменения в растительном сообществе. Сожительство организмов в растительном сообществе | Определяют понятия «растительное сообщество», «растительность», «ярусность». Характеризуют различные типы растительных сообществ. Устанавливают взаимосвязи в растительном сообществе |
| Развитие и смена растительных сообществ | Смена растительных сообществ. Типы растительности. Экскурсия Природное сообщество и человек | Определяют понятие «смена растительных сообществ». Работают в группах. Подводят итоги экскурсии (отчет) |
| Влияние хозяйственной деятельности человека на растительный мир | Влияние хозяйственной деятельности человека на растительный мир. История охраны природы в нашей стране. Роль заповедников и заказников. Рациональное природопользование | Определяют понятия «заповедник», «заказник», «рациональное природопользование». Обсуждают отчет по экскурсии. Выбирают задание на лето |
29
Просмотр содержимого документа
«РП ХИМИЯ 10-11 класс»

Пояснительная записка
Настоящая программа для средней (полной) общеобразовательной школы разработана на основе содержания общего образования и требований к результатам среднего (полного) общего образования, представленных в федеральном Государственном стандарте среднего (полного) общего образования второго поколения.
В ней также учтены основные идеи и положения программы развития и формирования универсальных учебных действий для среднего (полного) общего образования и соблюдена преемственность с примерными программами для основного общего образования.
Настоящая программа по химии составлена на основе учебного плана МБОУ «Сарагашская сош» на 2016 – 2017 год, для учащихся 10-11 классов на базовом уровне в объеме 69 часов (1час в неделю в 10 классе, 1 час в неделю в 11 классе).
Целями изучения химии в средней (полной) школе являются:
формирование умения видеть и понимать ценность образования, значимость химического знания для каждого человека независимо от его профессиональной деятельности; умение различать факты и оценки, сравнивать оценочные выводы, видеть их связь с критериями оценок и связь критериев с определенной системой ценностей, формулировать и обосновывать собственную позицию;
формирование целостного представления о мире, представления о роли химии в создании современной естественно-научной картины мира, умения объяснять объекты и процессы окружающей действительности (природной, социальной, культурной, технической среды), используя для этого химические знания;
приобретение опыта разнообразной деятельности, опыта познания и самопознания, ключевых навыков (ключевых компетентностей), имеющих универсальное значение для различных видов деятельности – навыков решения проблем, принятия решений, поиска, анализа и обработки информации, коммуникативных навыков, навыков измерений, сотрудничества, безопасного обращения с веществами в повседневной жизни.
освоение знаний о химической составляющей естественнонаучной картины мира, важнейших химических понятий, законах и теориях;
овладение умениями применять полученные знания для объяснения разнообразных химических явлений и свойств веществ, оценки роли химии в развитии современных технологий и получении новых материалов;
развитие познавательных интересов и интеллектуальных способностей в процессе самостоятельного приобретения химических знаний с использованием различных источников информации, в том числе компьютерных;
воспитание убежденности в позитивной роли химии в жизни современного общества, необходимости химически грамотного отношения к своему здоровью и к окружающей среде;
применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
Особенности учебного курса химии.
Данная программа предусматривает формирование у учащихся общеучебных умений и навыков, универсальных способов деятельности и ключевых компетенций. В этом направлении приоритетами для учебного предмета «химия» в старшей школе на базовом уровне являются:
умение самостоятельно и мотивированно организовывать свою познавательную деятельность (от постановки цели до получения и оценки результата);
определение сущностных характеристик изучаемого объекта;
умение развернуто обосновывать суждения, давать определения, приводить доказательства; оценивание и корректировка своего поведения в окружающей среде;
выполнение в практической деятельности и в повседневной жизни экологических требований;
использование мультимедийных ресурсов и компьютерных технологий для обработки, передачи, систематизации информации, создание баз данных, презентации результатов познавательной и практической деятельности.
В основу программы положен принцип развивающего обучения. Программа опирается на материал, изученный в 8–9 классах, поэтому некоторые темы курса рассматриваются повторно, но уже на более высоком теоретическом уровне. Такой подход позволяет углублять и развивать понятие о веществе и химическом процессе, закреплять пройденный материал в активной памяти учащихся, а также сохранять преемственность в процессе обучения.
Программа обеспечивает сознательное усвоение учащимися важнейших химических законов, теорий и понятий; формирует представление о роли химии в развитии разнообразных отраслей производства; знакомит с веществами, окружающими человека. При этом основное внимание уделяется сущности химических реакций и методам их осуществления, а также способам защиты окружающей среды.
Программа составлена с учетом ведущей роли химического эксперимента. Предусматриваются все виды школьного химического эксперимента — демонстрации, лабораторные опыты и практические работы.
Реализация данной программы в процессе обучения позволит учащимся усвоить ключевые химические компетенции и понять роль химии среди других наук о природе, значение ее для человечества.
Учебно – методический комплект.
Программа предлагается для работы по новым учебникам химии авторов Г.Е. Рудзитиса и Ф.Г. Фельдмана, прошедшим экспертизу РАН и РАО и вошедшим в Федеральный перечень учебников, рекомендованных Министерством образования и науки РФ к использованию в образовательной процессе в общеобразовательных учреждениях на 2014 – 2015 учебный год.
1. Рудзитис Г.Е., Фельдман Ф.Г., Химия. 11 класс. – М.: Просвещение, 2011
2. Рудзитис Г.Е., Фельдман Ф.Г., Химия. 10 класс. – М.: Просвещение, 2011
Средства обучения.
Печатные пособия.
Таблицы:
Периодическая таблица химических элементов Д.И.Менделеева
Таблица растворимости кислот, оснований, солей
Портреты ученых
Строение атома
Типы химических связей
Технические средства обучения:
Интерактивная доска
Учебно – практическое и учебно – лабораторное оборудование:
Приборы и приспособления: комплект посуды и принадлежностей для проведения лабораторных работ и практических работ (штативы с пробирками, колбы, мерный цилиндр, фильтровальная бумага, химические стаканы, спиртовки, стеклянные палочки, фарфоровые чашки, спички, газоотводные трубки, лабораторные штативы, лучины, воронки, весы, индикаторы).
Реактивы и материалы: комплект реактивов для базового уровня
Натуральные объекты.
Коллекции нефти, каменного угля и продуктов переработки, пластмасс, волокон
Содержание программы 10 класс
35 ч/год (1 ч/нед.)
ОРГАНИЧЕСКАЯ ХИМИЯ
Тема 1. Теоретические основы органической химии (2 ч)
Формирование органической химии как науки. Органические вещества. Органическая химия. Теория строения органических соединений А. М. Бутлерова. Углеродный скелет. Радикалы. Функциональные группы. Гомологический ряд. Гомологи.
Структурная изомерия. Номенклатура. Значение теории строения органических соединений.
Электронная природа химических связей в органических соединениях. Способы разрыва связей в молекулах органических веществ. Электрофилы. Нуклеофилы.
Классификация органических соединений.
Демонстрации. Ознакомление с образцами органических веществ и материалов. Модели молекул органических веществ. Растворимость органических веществ в воде и неводных растворителях. Плавление, обугливание и горение органических веществ. УГЛЕВОДОРОДЫ
Тема 2. Предельные углеводороды (a.iкапы) (3 ч)
Электронное и пространственное строение алканов. Гомологический ряд. Номенклатура и изомерия. Физические и химические свойства алканов. Реакция замещения. Получение и применение алканов.
Циклоалканы. Строение молекул, гомологический ряд. Нахождение в природе. Физические и химические свойства.
Демонстрации. Взрыв смеси метана с воздухом. Отношение алканов к кислотам, щелочам, к раствору перманганата калия и бромной воде.
Лабораторные опыты. Изготовление моделей молекул углеводородов и галогенопроизводных.
Практическая работа. Качественное определение углерода, водорода и хлора в органических веществах.
Расчетные задачи. Нахождение молекулярной формулы органического соединения по массе (объему) продуктов сгорания.
Тема 3. Непредельные углеводороды (3 ч). Алкены.
Электронное и пространственное строение алкенов. Гомологический ряд.
Номенклатура. Изомерия: углеродной цепи, положения кратной связи, цис-, транс-изомерия. Химические свойства: реакции окисления, присоединения, полимеризации. Правило Марковникова. Получение и применение алкенов.
Алкадиены. Строение. Свойства, применение. Природный каучук.
Ллк-ипы. Электронное и пространственное строение ацетилена. Гомологи и изомеры. Номенклатура. Физические и химические свойства. Реакции присоединения и замещения. Получение. Применение.
Демонстрации. Получение ацетилена в лаборатории. Реакция ацетилена с раствором перманганата калия и бромной водой. Горение ацетилена. Разложение каучука при нагревании и испытание продуктов разложения.
Практическая работа. Получение этилена и изучение его свойств.
Тема 4. Ароматические углеводороды (арены) (2 ч)
Арены. Электронное и пространственное строение бензола. Изомерия и номенклатура. Физические и химические свойства бензола. Гомологи бензола. Особенности химических свойств гомологов бензола на примере толуола. Генетическая связь ароматических углеводородов с другими классами углеводородов.
Демонстрации. Бензол как растворитель, горение бензола. Отношение бензола к
бромной воде и раствору перманганата калия. Окисление толуола.
Тема 5. Природные источники углеводородов (2 ч)
Природный газ. Попутные нефтяные газы. Нефть и нефтепродукты. Физические свойства. Способы переработки нефти. Перегонка. Крекинг термический и каталитический. Коксохимическое производство.
Лабораторные опыты. Ознакомление с образцами продуктов нефтепереработки.
Расчетные задачи. Определение массовой или объемной доли выхода продукта реакции от теоретически возможного.
КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Тема 6. Спирты и фенолы (3 ч)
Одноатомные предельные спирты. Строение молекул, функциональная группа. Водородная связь. Изомерия и номенклатура. Свойства метанола (этанола), получение и применение. Физиологическое действие спиртов на организм человека. Генетическая связь одноатомных предельных спиртов с углеводородами.
Многоатомные спирты. Этиленгликоль, глицерин. Свойства, применение.
Фенолы. Строение молекулы фенола. Взаимное влияние атомов в молекуле на примере молекулы фенола. Свойства фенола. Токсичность фенола и его соединений. Применение фенола.
Демонстрации. Взаимодействие фенола с бромной водой и раствором гидроксида натрия.
Лабораторные опыты. Растворение глицерина в воде. Реакция глицерина с гидроксидом меди(И).
Расчетные задачи. Расчеты по химическим уравнениям при условии, что одно из реагирующих веществ дано в избытке.
Тема 7. Альдегиды, кетоны (2 ч)
Альдегиды. Строение молекулы формальдегида. Функциональная группа. Изомерия и номенклатура. Свойства альдегидов. Формальдегид и ацетальдегид: получение и применение.
Ацетон — представитель кетонов. Строение молекулы. Применение.
Демонстрации. Взаимодействие метаналя (этаналя) с аммиачным раствором оксида серебра(1) и гидроксида меди(И). Растворение в ацетоне различных органических веществ.
Лабораторные опыты. Получение этаналя окислением этанола. Окисление метаналя (этаналя) аммиачным раствором оксида серебра(1). Окисление метаналя (этаналя) гидроксидом меди(И).
Тема 8. Карбоновые кислоты (3 ч)
Одноосновные предельные карбоновые кислоты. Строение молекул. Функциональная группа. Изомерия и номенклатура. Свойства карбоновых кислот. Реакция этерификации. Получение карбоновых кислот и применение.
Краткие сведения о непредельных карбоновых кислотах.
Генетическая связь карбоновых кислот с другими классами органических соединений.
Практические работы
Получение и свойства карбоновых кислот.
Решение экспериментальных задач на распознавание органических веществ.
Тема 9. Сложные эфиры. Жиры (2 ч)
Сложные эфиры: свойства, получение, применение. Жиры. Строение жиров. Жиры в природе. Свойства. Применение. Моющие средства. Правила безопасного обращения со средствами бытовой химии.
Лабораторные опыты. Растворимость жиров, доказательство их непредельного характера, омыление жиров. Сравнение свойств мыла и синтетических моющих средств. Знакомство с образцами моющих средств. Изучение их состава и инструкций по применению. Тема 10. Углеводы (4 ч)
Глюкоза. Строение молекулы. Оптическая (зеркальная) изомерия. Фруктоза — изомер глюкозы. Свойства глюкозы. Применение. Сахароза. Строение молекулы. Свойства, применение.
Крахмал и целлюлоза — представители природных полимеров. Реакция поликонденсации. Физические и химические свойства. Нахождение в природе. Применение. Ацетатное волокно.
Лабораторные опыты. Взаимодействие глюкозы с гидроксидом меди(П). Взаимодействие глюкозы с аммиачным раствором оксида серебра(1). Взаимодействие сахарозы с гидроксидом кальция. Взаимодействие крахмала с иодом. Гидролиз крахмала. Ознакомление с образцами природных и искусственных волокон.
Практическая работа. Решение экспериментальных задач на получение и распознавание органических веществ.
АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Тема 11. Амины и аминокислоты (2 ч)
Амины. Строение молекул. Аминогруппа. Физические и химические свойства. Строение молекулы анилина. Взаимное влияние атомов в молекуле на примере молекулы анилина. Свойства анилина. Применение.
Аминокислоты. Изомерия и номенклатура. Свойства. Аминокислоты как амфотерные органические соединения. Применение. Генетическая связь аминокислот с другими классами органических соединений. Тема 12. Белки (2 ч)
Белки — природные полимеры. Состав и строение. Физические и химические свойства. Превращение белков в организме. Успехи в изучении и синтезе белков.
Понятие об азотсодержащих гетероциклических соединениях. Пиридин. Пиррол. Пиримидиновые и пуриновые основания. Нуклеиновые кислоты: состав, строение.
Химия и здоровье человека. Лекарства. Проблемы, связанные с применением лекарственных препаратов.
Демонстрации. Окраска ткани анилиновым красителем. Доказательство наличия функциональных групп в растворах аминокислот. Цветные реакции на белки (биуретовая и ксантопротеиновая реакции).
Лабораторные опыты. Цветные реакции на белки (биуретовая и ксантопротеиновая реакции).
ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ (4 ч)
Тема 13. Синтетические полимеры (4 ч)
Понятие о высокомолекулярных соединениях. Полимеры, получаемые в реакциях полимеризации. Строение молекул. Стереонерегулярное и стереорегулярное строение полимеров. Полиэтилен. Полипропилен. Термопластичность. Полимеры, получаемые в реакциях поликонденсации. Фенолформальдегидные смолы. Термореактивность.
Синтетические каучуки. Строение, свойства, получение и применение.
Синтетические волокна. Капрон. Лавсан.
Обобщение знаний по курсу органической химии. Органическая химия, человек и природа.
Демонстрации. Образцы пластмасс, синтетических ка-учуков и синтетических волокон.
Лабораторные опыты. Изучение свойств термопластичных полимеров. Определение хлора в поливинилхлориде. Изучение свойств синтетических волокон.
Практическая работа. Распознавание пластмасс и волокон.
Расчетные задачи. Определение массовой или объемной доли выхода продукта реакции от теоретически возможного.
Требования к уровню подготовки десятиклассников.
Требования к уровню подготовки выпускников сформулированы в соответствии с целями образования, его содержанием и спецификой процесса обучения химии.
Выпускник должен уметь:
1 называть вещества по их химическим формулам; общие свойства металлов и неметаллов, классов неорганических и органических веществ; функциональные группы органических веществ; виды химических связей; типы кристаллических решеток; основные положения теории химического строения органических веществ А.М.Бутлерова; признаки классификаций химических элементов; признаки классификации неорганических и органических веществ; аллотропные видоизменения химических элементов; гомологи и изомеры различных классов органических веществ; признаки и условия осуществления химических реакций; типы химических реакций; среду раствора при растворении различных солей в воде; факторы, влияющие на скорость химических реакций; условия смещения химического равновесия; области применения отдельных неорганических и органических веществ; области практического применения металлических сплавов, силикатных материалов, пластмасс, продуктов важнейших химических производств, а также продуктов переработки нефти, природного газа и каменного угля;
определять простые и сложные вещества; принадлежность веществ к определенному классу; валентность и степень окисления химических элементов по формулам соединений; заряд иона в ионных и ковалентно-полярных соединениях; вид химической связи в соединениях; наличие водородных связей между молекулами органических веществ; тип химических реакций по всем известным признакам; окислитель и восстановитель в окислительно-восстановительных реакциях; условия, при которых реакции ионного обмена идут до конца;
составлять формулы оксидов, гидроксидов, кислот, водородных соединений по валентности химических элементов или степени окисления; молекулярные и структурные формулы органических веществ; схемы распределения электронов первых четырех периодов; уравнения химических реакций различных типов;
уравнения химических реакций, подтверждающих свойства неорганических и органических веществ, их генетическую связь; уравнения электролитической диссоциации кислот, щелочей, солей; полные и сокращенные уравнения реакций ионного обмена; уравнения окислительно-восстановительных реакций; химические уравнения электролиза растворов солей безкислородных кислот; уравнения реакции гидролиза солей, в результате которой раствор приобретает щелочную или кислую среду; уравнения химических реакций, лежащих в основе промышленного получения аммиака, серной кислоты, чугуна, стали, метанола; план решения экспериментальных задач, распознавания веществ, принадлежащих к различным классам; отчет о проведенной практической работе по получению веществ и изучению их химических свойств;
характеризовать качественный и количественный состав вещества; химические элементы первых четырех периодов по их положению в периодической системе Д.И.Менделеева и строению их атомов; свойства их высших оксидов и соответствующих им гидроксидов; химические свойства неорганических и органических веществ; строение атомов металлов; строение атомов неметаллов; общие и особые свойства металлов и наметаллов и их важнейших соединений; химическое строение органических веществ; связь между составом, строением, свойствами веществ и их применением; свойства и физиологическое действие на организм оксида углерода (II), аммиака, хлора, озона, ртути, этилового спирта, бензина; типы сплавов и их свойства; круговороты кислорода, азота и углерода в природе; химическое загрязнение окружающей среды как следствие производственных процессов и неправильного использования веществ в быту; способы защиты окружающей среды от загрязнения; условия и способы предупреждения коррозии металлов;
объяснять зависимость свойств химических элементов от заряда ядер атомов и строения атомных электронных оболочек; физический смысл номеров групп, периода, порядкового номера в периодической системе Д.И.Менделеева; закономерностей изменения свойств химических элементов расположенных: а) в одном периоде, б) в одной группе, главной подгруппы; сущность основных положений теории химического строения А.М.Бутлерова; закон сохранения массы веществ при химических реакциях; зависимость физических свойств веществ от типа их кристаллической решетки; способы образования ионной, ковалентной, донорно-акцепторной, металлической и водородной связей; механизм электролитической диссоциации кислот, щелочей, солей; сущность реакций ионного обмена; сущность процессов окисления и восстановления; причины многообразия органических веществ; зависимость скорости реакций от различных факторов;
должны соблюдать правила техники безопасности при работе с химической посудой, лабораторным оборудованием и химическими реактивами, личного поведения в химической лаборатории, повседневной жизни при обращении с веществами, способствующими защите окружающей среды от загрязнения, оказания первой помощи себе и пострадавшим от неумелого обращения с веществами;
должны проводить опыты по получению, собиранию и изучению свойств неорганических и органических веществ; нагревание, отстаивание, выпаривание и фильтрование; распознавание кислорода, водорода, углекислого газа, растворов кислот и щелочей, хлорид-, сульфат-, и карбонат-ионов, предельных и непредельных органических соединений; изготовление моделей молекул веществ: вода, углекислый газ, хлороводород, метан, этан, ацетилен, этанол, уксусная кислота; вычисления: а) молекулярной массы и молярной массы вещества по химическим формулам; б) массовой доли растворенного вещества в растворе; в)
массовой доли элемента в веществе; г) количества вещества (массы) по количеству вещества (массе) одного из веществ, участвующих в реакции; д) массы одного из продуктов по массе исходного вещества, содержащего определенную долю примесей; е) массу одного из продуктов по массе раствора, содержащего определенную массовую долю одного из исходных веществ; расчеты по установлению формулы органического вещества.
Демонстрации:
Некоторые свойства аминокислот.
Растворение, осаждение белка, денатурация.
Видеофильм «Органическая химия. Ч. 5».
Компакт-диск «Сложные химические соединения в повседневной жизни».
Лабораторный опыт: цветные реакции на белок.
Учебно-тематический план 10 класс
| № п/п | Наименование темы | Количество часов |
| 1 | Повторение | 1 |
| 2 | Теория химического строения | 3 |
| 3 | Углеводороды | 10 |
| 4 | Кислородсодержащие | 11 |
| 5 | Азотосодержащие | 5 |
| 6 | Высокомолекулярные | 2 |
| 7 | Химия и жизнь | 1 |
| 8 | Резерв | 2 |
| | ИТОГО: | 35 часов |
| | Контрольные работы | 2 |
| | Практические работы | 1 |
11класс 34 ч/год (1 ч/нед.)
СОДЕРЖАНИЕ УЧЕБНОЙ ПРОГРАММЫ
Тема 1. ВАЖНЕЙШИЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ (2 часа)
Химический элемент. Закон сохранения массы веществ, закон сохранения и превращения энергии, закон постоянства состава. Классификация неорганических веществ.
Демонстрации:
Плакат «Классификация веществ».
Видеофильм «Химические элементы».
Тема 2. ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА В СВЕТЕ УЧЕНИЯ О СТРОЕНИИ АТОМА (4 часа)
Периодический закон, структура Периодической системы, орбиталь, энергетические уровни, подуровни, s-, р-, d-элементы. Значение периодического закона. Валентность и валентные возможности атомов. Изменение свойств оксидов, гидроксидов и водородных соединений химических элементов в зависимости от положения элементов в Периодической системе.
Демонстрации: комплект таблиц «Электронные оболочки атомов».
Т е м а 3. СТРОЕНИЕ ВЕЩЕСТВА (3 часа)
Основные типы химической связи: ковалентная (полярная и неполярная), водородная, ионная, металлическая; механизмы их образования, характеристики химической связи, кристаллические решётки.
Демонстрации:
Таблицы «Химическая связь».
Модели кристаллических решёток.
Транспаранты «Виды химической связи».
Т е м а 4. ХИМИЧЕСКИЕ РЕАКЦИИ (7 часов)
Классификация химических реакций. Скорость химических реакций. Факторы, влияющие на скорость реакций. Химическое равновесие. Условия, влияющие на смещение химического равновесия (принцип Ле Шателье).
_ Демонстрации:
Реакции экзо- и эндотермические.
Влияние на скорость химической реакции:
а) концентрации реагирующих веществ;
б) поверхности соприкосновения реагирующих веществ;
в) температуры;
г) катализатора.
3. Видеофильм «Основы молекулярно-кинетической теории».
5. НЕМЕТАЛЛЫ (6 часов)
Неметаллы. Характеристика элементов и простых веществ. Водородные соединения неметаллов, оксиды неметаллов, кислородсодержащие кислоты, окислительные свойства азотной и серной кислот.
Демонстрации:
Образцы неметаллов.
Модели кристаллических решёток йода, алмаза, графита.
Получение аммиака и хлороводорода. Растворение их в воде, доказательство кислотно-основных свойств этих веществ.
Сжигание угля и серы в кислороде, определение химических свойств продуктов сгорания.
Взаимодействие концентрированной серной кислоты с медью.
Взаимодействие концентрированной азотной кислоты с медью.
Взаимодействие разбавленной азотной кислоты с медью.
Практическое занятие: решение практических расчетных задач. Получение, собирание и распознавание газов. (1 час)
Т е м а 6. МЕТАЛЛЫ (9 часов)
Металлы. Характеристика элементов и простых веществ. Металлы главных и побочных подгрупп Периодической системы химических элементов Д. И. Менделеева. Оксиды и гидроксиды железа, меди, хрома. Общие способы получения металлов. Электролиз. Сплавы.
Демонстрации:
Образцы металлов, их оксидов, некоторых солей.
Доказательство амфотерности алюминия.
Взаимодействие железа с кислородом.
Взаимодействие железа, меди, хрома с соляной и серной кислотами.
Получение гидроксидов меди и хрома, оксида меди.
Взаимодействие оксидов и гидроксидов металлов с кислотами.
Доказательство амфотерности соединений хрома (III), кислотных свойств хромовой кислоты.
Образцы сплавов и изделий из них.
Электролиз раствора сульфата меди.
10. Видеофильмы «Металлы главных подгрупп», «Металлы побочных подгрупп».
Практическое занятие: решение экспериментальных задач по неорганической химии». (1 час)
Тема 7. ХИМИЯ И ЖИЗНЬ (2 часа)
Бытовая химическая грамотность. Продукты питания. Бытовая химия. Мебель. Лекарственные препараты. Химическое загрязнение окружающей среды и его последствия. Способы защиты окружающей среды и способы очистки и утилизации промышленных отходов.
количество часов на изучение учебного материала соответствует Примерной программе. Резервное время - 1 час отводится на проведение контрольной работы № 2.
включена тема «Генетическая связь между классами неорганических и органических веществ»; так как данная тема позволяет систематизировать знания учащихся по разделу «Неорганическая химия»
При оформлении рабочей программы были использованы следующие условные обозначения:
СР - самостоятельная работа, УО - устный опрос; ТФЕГЭ - тест в формате ЕГЭ;
красным цветом в тексте выделены элементы содержания Примерной программы, черным - авторской;
синим - элементы содержания, которые есть в Примерной программе, но отсутствуют в Стандарте;
зеленым - элементы содержания, которые указаны в Стандарте, но отсутствует в Примерной программе;
курсивом выделен материал, который подлежит изучению, но не включается в «Требования к уровню подготовки выпускников».
ТРЕБОВАНИЯ К УРОВНЮ ПОДГОТОВКИ
Требования выражены в личностно-деятельностной форме и предполагают выполнение действий различной сложности:
- называть;
- определять;
- составлять;
- характеризовать;
- объяснять;
- проводить;
- соблюдать правила.
В результате изучения химии в 11 классе обучающийся должен знать (понимать):
1. Называть:
1.1. Вещества по их химическим формулам.
1.2. Общие свойства классов неорганических и органических соединений, металлов и неметаллов.
1.3. Функциональные группы органических веществ.
1.4. Типы кристаллических решеток в веществах с различным видом химической связи.
1.5. Признаки классификации химических элементов.
1.6. Признаки классификации неорганических и органических веществ.
1.7. Признаки и условия осуществления химических реакций, типы реакций.
1.9. Факторы, влияющие на скорость химической реакции, условия смещения химического равновесия.
1.10. Реакцию среды раствора при растворении различных солей в воде.
1.11. Области применения отдельных неорганических и органических веществ (например, пищевая сода, медный купорос, иод, глюкоза, сахароза, крахмал, целлюлоза и др.)
2. Определять:
2.1. Простые и сложные вещества.
2.2. Принадлежность веществ к соответствующему классу.
2.3. Валентность и степень окисления химических элементов по формулам соединений.
2.4. Заряд иона в ионных и ковалентно-полярных соединениях.
2.5. Вид химической связи в соединениях.
2.6. Возможность образования водородной связи между молекулами органических веществ.
2.7. Тип химической реакции по всем известным признакам классификации.
2.8. Окислитель и восстановитель в реакциях окисления-восстановления.
2.9. Условия, при которых реакции ионного обмена идут до конца.
3. Составлять:
3.1. Формулы оксидов, оснований, кислот, солей, водородных соединений по валентности химических элементов или степени окисления.
3.2. Молекулярные и структурные формулы органических веществ.
3.3. Схемы распределения электронов в атомах химических элементов первых трех периодов, а также калия и кальция.
3.4. Уравнения химических реакций, различных типов, подтверждающих свойства неорганических и органических веществ, их генетическую связь.
3.5. Уравнения электролитической диссоциации кислот, щелочей, солей.
3.6. Полные и сокращенные уравнения реакций обмена.
3.7. Уравнения окислительно-восстановительных реакций.
3.8. химические уравнения электролиза растворов солей бескислородных кислот.
3.9. Уравнения реакций гидролиза солей, образованных сильным основанием и слабой кислотой, слабым основанием и сильной кислотой.
3.10. План решения экспериментальных задач по распознаванию веществ, принадлежащих к различным классам соединений.
3.11. Отчет о проведении практической работы по получению веществ и изучению их химических свойств.
4. Характеризовать:
4.1. Качественный и количественный состав веществ.
4.2. Химические элементы первых трех периодов, а также калий и кальций по их положению в периодической системе Д.И.Менделеева и строению их атомов.
4.3. Свойства высших оксидов химических элементов первых трех периодов, а также соответствующих им гидроксидов, исходя из положения элементов в периодической системе Д.И.Менделеева.
4.4. Химические свойства веществ – представителей важнейших классов неорганических и органических соединений.
4.5. Общие химические свойства металлов и их соединений на основе представлений об окислительно-восстановительных реакциях и реакциях ионного обмена.
4.6. Общие и специфические свойства неметаллов и их важнейших соединений на основе представлений об окислительно-восстановительных реакциях и реакциях ионного обмена.
4.7. Типы сплавов и их свойства.
4.8. Круговороты углерода, кислорода, азота в природе.
4.9. Химическое загрязнение окружающей среды как следствие производственных процессов и неправильного использования веществ в быту, сельском хозяйстве.
4.10. Способы защиты окружающей среды от загрязнений.
4.11. Условия и способы предупреждения коррозии металлов.
5. Объяснять:
5.1. Зависимость свойств химических элементов от заряда ядер атомов и строения атомных электронных оболочек.
5.2. Физический смысл номеров группы и периода, порядкового (атомного) номера химического элемента в периодической системе Д.И. Менделеева.
5.3. Закономерности изменения свойств химических элементов, расположенных: а) в одном периоде; б) в главной подгруппе периодической системы Д.И.Менделеева
5.4. Сходство и различие в строении атомов химических элементов одного периода и одной главной подгруппы периодической системы Д.И.Менделеева.
5.5. Закон сохранения массы веществ при химических реакциях.
5.6. Зависимость физических свойств веществ от типа кристаллической решетки.
5.7. Способы образования ионной, ковалентной (неполярной и полярной), донорно-акцепторной, металлической и водородной связей.
5.8. Зависимость скорости химических реакций от: а) природы реагирующих веществ; б) концентрации реагентов; в) температуры; г) наличия веществ-катализаторов.
6. Соблюдать правила:
6.1. Техники безопасности при обращении с химической посудой, лабораторным оборудованием и химическими реактивами.
6.2. Личного поведения при обращении с веществами в химической лаборатории и повседневной жизни.
6.3. Оказания первой помощи пострадавшим от неумелого обращения с веществами.
7. Проводить:
7.1. Опыты по получению, собиранию и изучению свойств неорганических и органических веществ.
7.2. Нагревание, отстаивание, фильтрование и выпаривание.
7.3 Распознавание предельных и непредельных органических соединений.
7.4. Вычисления: а) молекулярной и молярной массы веществ по химическим формулам; б) массовой доли растворенного вещества в растворе;
в) массовой доли химического элемента в веществе; г) количества вещества (массы) по количеству вещества (массе) одного из веществ, участвующих в реакции; д) массы одного из продуктов по массе исходного вещества, содержащего примеси; е) массу одного из продуктов по массе раствора, содержащего определенную массовую долю одного из исходных веществ.
Учебно-тематический план 11 КЛАСС
| № п/п | Наименование темы | Количество часов | |
| 1 | Законы химии | 2 | |
| 2 | Периодический закон | 4 | |
| 3 | Строение вещества | 3 | |
| 4 | Химические реакции | 7 | |
| 5 | Неметаллы | 6 | |
| 6 | Металлы | 9 | |
| 7 | Химия и жизнь | 2 | |
| 8 | Резерв | 1 | |
| | ИТОГО: | 34 часа | |
| Практические работы | : | |||||
| 1. | Практическая работа № 1 «Получение, собирание и распознавание газов» | | | | | |
| 2. | Практическая работа №2 «Идентификация неорганических соединений» | | | | | |
| 3. | Практическая работа №3 «Решение экспериментальных задач по теме: «Металлы и неметаллы» | | | | | |
| Контрольные работы | ||||||
| 1. | Контрольная работа № 1 по теме: «Теоретические основы химии» | | | | | |
| 2. | Контрольная работа № 2 по теме «Неорганическая химия» | | | | | |
Требования к уровню подготовки обучающихся на ступени среднего (полного) образования
Результаты освоения курса химии.
Деятельность образовательного учреждения общего образования в обучении химии в средней (полной) школе должна быть направлена на достижение следующих личностных результатов:
в ценностно-ориентационной сфере – воспитание чувства гордостиза российскую химическую науку, гуманизма, целеустремленности;
в трудовой сфере – готовность к осознанному выбору дальнейшей образовательной траектории;
в познавательной сфере – умение управлять своей познавательной деятельностью.
Метапредметными результатами освоения выпускниками основной школы программы по химии являются:
использование умений и навыков различных видов познавательной деятельности, применение основных методов познания (системно-информационный анализ, моделирование) для изучения различных сторон окружающей действительности;
использование основных интеллектуальных операций: формулирование гипотез, анализ и синтез, сравнение, обобщение, систематизация, выявление причинно-следственных связей, поиск аналогов;
умение генерировать идеи и определять средства, необходимые для их реализации;
умение определять цели и задачи деятельности, выбирать средства реализации цели и применять их на практике;
использование различных источников информации, понимание зависимости содержания и формы представления информации от целей коммуникации и адресата.
В области предметных результатов образовательное учреждение общего образования предоставляет ученику возможность на ступени среднего (полного) общего образования научиться:
в познавательной сфере:
давать определения научным понятиям;
описывать демонстрационные и самостоятельно проводимые эксперименты, используя для этого естественный (русский) язык и язык химии;
описывать и различать изученные классы неорганических и органических соединений, химические реакции;
классифицировать изученные объекты и явления;
наблюдать демонстрируемые и самостоятельно проводимые опыты, химические реакции, протекающие в природе и в быту;
делать выводы и умозаключения из наблюдений, изученных химических закономерностей, прогнозировать свойства неизученных веществ по аналогии со свойствами изученных;
структурировать изученный материал;
интерпретировать химическую информацию, полученную из других источников;
описывать строение атомов элементов I-IV периодов с использованием электронных конфигураций атомов;
моделировать строение простейших молекул неорганических и органических веществ, кристаллов;
в ценностно-ориентационной сфере:
анализировать и оценивать последствия для окружающей среды бытовой и производственной деятельности человека, связанной с переработкой веществ;
в трудовой сфере:
проводить химический эксперимент;
в сфере физической культуры:
оказывать первую помощь при отравлениях, ожогах и других травмах, связанных с веществами и лабораторным оборудованием.
Проверка и оценка знаний и умений учащихся
Результаты обучения химии должны соответствовать общим задачам предмета и требованиям к его усвоению.
Результаты обучения оцениваются по пятибалльной системе. При оценке учитываются следующие качественные показатели ответов:
глубина (соответствие изученным теоретическим обобщениям);
осознанность (соответствие требуемым в программе умениям применять полученную информацию);
полнота (соответствие объему программы и информации учебника).
При оценке учитываются число и характер ошибок (существенные или несущественные).
Существенные ошибки связаны с недостаточной глубиной и осознанностью ответа (например, ученик неправильно указал основные признаки понятий, явлений, характерные свойства веществ, неправильно сформулировал закон, правило и т.п. или ученик не смог применить теоретические знания для объяснения и предсказания явлений, установления причинно-следственных связей, сравнения и классификации явлений и т. п.).
Несущественные ошибки определяются неполнотой ответа (например, упущение из вида какого-либо нехарактерного факта при описании вещества, процесса). К ним можно отнести оговорки, описки, допущенные по невнимательности (например, на два и более уравнения реакций в полном ионном виде допущена одна ошибка в обозначении заряда иона).
Результаты обучения проверяются в процессе устных и письменных ответов учащихся, а также при выполнении ими химического эксперимента.
Оценка теоретических знаний
Отметка «5»:
ответ полный и правильный на основании изученных теорий;
материал изложен в определенной логической последовательности, литературным языком;
ответ самостоятельный.
Отметка «4»:
ответ полный и правильный на основании изученных теорий;
материал изложен в определенной логической последовательности, при этом допущены две-три несущественные ошибки, исправленные по требованию учителя.
Отметка «3»:
ответ полный, но при этом допущена существенная ошибка или ответ неполный, несвязный.
Отметка «2»:
при ответе обнаружено непонимание учащимся основного содержания учебного материала или допущены существенные ошибки, которые учащийся не может исправить при наводящих вопросах учителя.
Оценка экспериментальных умений
Оценка ставится на основании наблюдения за учащимся и письменного отчета за работу.
Отметка «5»:
работа выполнена полностью и правильно, сделаны правильные наблюдения и выводы;
эксперимент проведен по плану с учетом техники безопасности и правил работы с веществами и оборудованием;
проявлены организационно-трудовые умения (поддерживаются чистота рабочего места и порядок на столе, экономно используются реактивы).
Отметка «4»:
работа выполнена правильно, сделаны правильные наблюдения и выводы, но при этом эксперимент проведен не полностью или допущены несущественные ошибки в работе с веществами и оборудованием.
Отметка «3»:
работа выполнена правильно не менее чем наполовину или допущена существенная ошибка в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которая исправляется по требованию учителя.
Отметка «2»:
допущены две (и более) существенные ошибки в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые учащийся не может исправить даже по требованию учителя.
Оценка умений решать экспериментальные задачи
работа выполнена полностью и правильно, сделаны правильные наблюдения и выводы;
Отметка «5»:
эксперимент проведен по плану с учетом техники безопасности и правил работы с веществами и оборудованием;
проявлены организационно-трудовые умения (поддерживаются чистота рабочего места и порядок на столе, экономно используются реактивы).
Отметка «4»:
работа выполнена правильно, сделаны правильные наблюдения и выводы, но при этом эксперимент проведен не полностью или допущены несущественные
ошибки в работе с веществами и оборудованием.
Отметка «3»:
работа выполнена правильно не менее чем наполовину или допущена существенная ошибка в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которая исправляется по требованию учителя.
Отметка «2»:
допущены две (и более) существенные ошибки в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые учащийся не может исправить даже по требованию учителя.
Оценка умений решать расчетные задачи
Отметка «5»:
в логическом рассуждении и решении нет ошибок, задача решена рациональным способом.
Отметка «4»:
в логическом рассуждении и решении нет существенных ошибок, но задача решена нерациональным способом или допущено не более двух несущественных ошибок.
Отметка «3»:
в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах.
Отметка «2»:
имеются существенные ошибки в логическом рассуждении и решении.
Отметка «1»:
задача не решена.
Оценка письменных контрольных работ
Отметка «5»:
ответ полный и правильный, возможна несущественная ошибка.
Отметка «4»:
ответ неполный или допущено не более двух несущественных ошибок.
Отметка «3»:
работа выполнена не менее чем наполовину, допущена одна существенная ошибка и две-три несущественные.
Отметка «2»:
работа выполнена менее чем наполовину или содержит несколько существенных ошибок.
Календарно-тематическое планирование в 10 классе, 34 часа (1 час в неделю), практических работ –4, контрольных работ - 2
| № п\п | Тема урока | Кол- во часов | Тип урока | Обязательные элементы содержания | Химический эксперимент (оборудование) | Характеристика основных видов деятельности ученика | Измерители (вид контроля) | Д/З | Дата проведения | |||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |||
| Раздел 1. Тема 1. Теоретические основы органической химии (3 часа) | ||||||||||||
| 1 (1) | Предмет органической химии. | 1 | УИНЗ | ТХС, ее значение. А.М.Бутлерова. Формирование органической химии как науки. Органические вещества. Органическая химия. Номенклатура. Изомерия, радикал | Демонстрации: Образцы органических веществ и материалов. Шаростержневые модели молекул органических веществ. Плавление, обугливание и горение Растворимость органических веществ в воде и неводных растворителях органических веществ | Использование элементов причинно-следственного и структурно-функционального анализа. Исследование несложных реальных связей и зависимостей. Объяснение изученных положений на самостоятельно подобранных конкретных примерах Определение сущностных характеристик изучаемого объекта; самостоятельный выбор критериев для сравнения, сопоставления, оценки и классификации объектов | Фронтальная беседа. | § 1- 2, с 10 , упр.1-12 | 1-ая неделя | |||
| 2 (2) | Электронная природа химических связей в органических соединениях | 1 | УИНЗ | Электронная природа химических связей в органических соединениях, способы ее разрыва. | Демонстрации: Шаростержневые модели молекул органических веществ. | Текущий опрос | § 3, с 13, упр. 1-5 | 2-ая неделя | ||||
| 3 (3) | Классификация органических соединений Решение задач на вывод химических формул | 1 | КУ | Классификация и номенклатура органических соединений Расчетные задачи. Нахождение молекулярной формулы органического соединения по массе (объему) продуктов сгорания | Демонстрации: Образцы органических веществ и материалов. Модели молекул органических веществ. Алгоритм решения задач, справочные таблицы. | Текущий опрос, письмен. работа по ДМ: А.М. Радецкий, стр.4-5, 7-8 | § 4, задачи в тетради | 3-я неделя | ||||
| Раздел 2. УГЛЕВОДОРОДЫ (12 ч) Тема 2. Предельные углеводороды (алканы) - 3 часа | ||||||||||||
| 1 (4) | Строение алканов. Гомологический ряд. Номенклатура и изомерия | 1 | КУ | Классификация и органических соединений. Гомологический ряд, гомологи. Структурная изомерия. Строение алканов. Номенклатура и изомерия номенклатура | ЛО № 1. Составление шаростержневых моделей молекул алканов | Использование элементов причинно-следственного и структурно-функционального анализа для:
Использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
| Текущий опрос, письм. работа по ДМ : А.М.Радецкий , стр.-6 | § 5 – 6, с 27, упр. 1-5, 7-11, задачи 1-3 | 4-ая неделя | |||
| 2 (5) | Свойства, получение и применение алканов. Циклоалканы. | 1 | КУ | Физические и химические свойства алканов. Реакция замещения. Получение и применение алканов | Демонстрации. Взрыв смеси метана с воздухом. Отношение алканов к кислотам, щелочам, раствору перманганата калия и бромной воде. | Текущий опрос. | § 7-8, с 28 Упр.13-21 задачи 4-5 | 5-ая неделя | ||||
| 3 (6) | Правила ТБ Качественное определение углерода, водорода и хлора в органических соединениях. | 1 | УЗЗ | Исследовать свойства органических соединений, определить их качественный состав. | Практическая работа № 1 Оборудование и материалы для практической работы. Инструкции ТБ. | Практическ. работа №1 Оформление работы. | с 28, задачи 6, 7 | 6-ая неделя | ||||
| Тема 3. Непредельные углеводороды - 4 ч | ||||||||||||
| 1 (7) | Алкены. Строение, гомологический ряд, изомерия, номенклатура. Свойства алкенов и их применение | 1 | УИНЗ | Строение алкенов. Гомологический ряд. Номенклатура, изомерия: углеродной цепи, положения кратной связи, цис-, транс- изомерия. Химические свойства: реакция окисления, присоединения. Применение алкенов | Демонстрации: Модели молекул изомеров и гомологов. | Определять: принадлежность веществ к различным классам органических соединений, давать им названия; объяснять зависимость свойств веществ от их состава и строения; природу химической связи; использовать приобретенные знания и умения в практической деятельности и повседневной жизни; знать важнейшие вещества и материалы для безопасного обращения с горючи-ми и токсичными веществами; организовать свою познавательную деятельность (от постановки цели до получения результатов): переводить информацию из текста в таблицу, уметь развернуто обосновывать суждения, приводить доказательства; готовить компьютерные презентации по теме; пользоваться информацией из других источников для подготовки кратких сообщений | Текущий опрос, письм. работа по ДМ : А.М.Радецкий , стр. 13-15 | § 9 – 10, упр. 2,6-9, задача 4, с 43 | 7-ая неделя | |||
| 2 (8) | Правила ТБ. Получение этилена и изучение его свойств | 1 | УЗЗ | Получение этилена, изучение его свойств, способы собирания и распознавания (кач. реакции) | Практическая работа № 2. Оборудование и материалы для практической работы. Инструкции ТБ. | Практическ. работа №2 Оформление работы. | Индив. задание:под сообщение о каучуке. | 8-ая неделя | ||||
| 3 (9) | Понятие о диеновых углеводородах. Природный каучук. | 1 | КУ | Алкадиены. Строение, свойства, применение. Природный, синтетический каучуки, резина, эбонит. | Демонстрации: Разложение каучука при нагревании и испытание продуктов разложения. Коллекция: Знакомство с образцами каучуков | Текущий опрос | § 11-12, с 49 упр.8, задачи 1, 2 | 9-ая неделя | ||||
| 4 (10) | Алкины. Строение, гомологический ряд, изомерия, номенклатура, свойства и применение ацетилена. | 1 | КУ | Строение ацетилена. Гомологи и изомеры. Номенклатура. Физические и химические свойства. Применение | Демонстрации: Получение ацетилена карбидным способом. Взаимодействие ацетилена с раствором перманганата калия и бромной водой. Горение ацетилена. | Текущий опрос, письм. раб. по ДМ: А.М.Радецкий, стр. 15-16 | § 13, с 54-55, упр. 1,6,9, задачи 1, 3, стр.55-56 | 10-ая неделя | ||||
| Тема 4. Ароматические углеводороды (арены) - 2 часа. | ||||||||||||
| 1 (11) | Арены. Бензол и его гомологи | 1 | УИНЗ | Строение бензола. Изомерия и номенклатура. Физические и химические свойства бензола | Демонстрации: Бензол как растворитель, горение бензола. Отношение бензола к бромной воде и раствору перманганата калия. Окисление толуола. | Определять: принадлежность веществ к различным классам органических соединений; объяснять зависимость свойств веществ от их состава и строения; природу химической связи; характеризовать: общие химические свойства органических соединений; составлять уравнения реакций, отражающих взаимосвязь различных классов; уметь использовать приобретенные знания в практической деятельности и повседневной жизни; выдвигать гипотезы, доказывая их правильность; владеть различными формами устного публичного выступления; знать важнейшие вещества: бензол, толуол. | Текущий опрос, работа с ДМ: А.М.Радецкий, стр. 24-25, Оценка выступлений обучающихся | §14,15, упр. 4-6, с.66-67 | 11-ая неделя | |||
| 2 (12) | Генетическая связь ароматических углеводородов с другими классами углеводородов | 1 | УОИСЗ | Обобщить знания об углеводородах, показать родство изученных углеводородов и возможности их получения из неорганических веществ. Решение задач на нахождение молекулярной формулы газообразного углеводорода по продуктам сгорания. | Справочные таблицы | Текущий опрос, работа с ДМ: А.М.Радецкий, стр. 25-26 | Индивидуальные задания по решению цепочек превращений | 12-ая неделя | ||||
| Тема 5. Природные источники углеводородов -3 часа. | ||||||||||||
| 1 (13) | Природный и попутные нефтяные газы, их состав и применение | 1 | УИНЗ | Природные источники углеводородов, природный газ и попутный нефтяные газы не только топливо, но и источник сырья для химической промышленности | | Объяснять сущность химических явлений, происходящих в природе, быту и на производстве; оценки их последствий; экологически грамотного поведения в окружающей среде; оценки влияния хим.загрязнения окружающей среды на живые организмы; безопасного обраще- ния с горючими и токсичными в-ми; находить нужную информации по теме в источниках различного типа; использовать компьютерные технологий для обра-ботки, передачи, систематизации информации, оценивать объективно свои учебные достижений; уметь соотносить приложенные усилия с полученными результатами своей деятельности. | Оценка выступлений обучающихся | §16, упр. 4,7, с.78, стр.79, задачи1-3 | 13-ая неделя | |||
| 2 (14) | Нефть и нефтепродукты. Способы переработки нефти | 1 | УИНЗ | Состав и свойства нефти, физические и химические способы пере-работки нефти –перегонка и крекинг. | ЛО № 2. Ознакомление с образцами продуктов нефтепереработки (коллекция). | Оценка выступлений обучающихся, работа с учебником §17, упр. 10, с.78 | Подготов. к контрольной работе, задания в тетради. | 14-ая неделя | ||||
| 3 (15) | Контрольная работа № 1 по теме «Углеводороды» | 1 | УК | Выявление УУД, степени их усвоения, полученных при изучении данной темы | | Контрольн. работа № 1 | не задано | 15-ая неделя | ||||
| Раздел 3. Кислородосодержащие органические соединения (12 часов) Тема № 6. Спирты и фенолы - 4 часа. | ||||||||||||
| 1 (16) | Одноатомные предельные спирты. Строение, свойства, получение, применение | 1 | КУ | Одноатомные предельные спирты, Строение молекул, функц. группа. Водород-ная связь. Изомерия и номенклатура. Свойства метанола (этанола), получение и применение. Физиологическое действие спиртов на человека | | Уметь самостоя-тельно и мотивиро-ванно организовывать свою познавательную деятельность (от постановки цели до получения и оценки результата). знать важнейшие вещества: этанол, метанол, глицерин; определять принадлежность веществ к различным классам органических соединений; характеризовать общие химические свойства органических соединений; уметь объяснять зависимость свойств веществ от их состава и строения; использовать приобретенные знания и умения в практической деятельности и повседневной жизни составлять уравнения реакций, отражающих взаимосвязь различных классов; выдвигать гипотезы, выдвигать гипотезы доказывая их правильность; владеть различными формами устного публичного выступления; знать важнейшие вещества: метанол, этанол, глицерин, фенол; соблюдать ТБ, правильно обращаться с реактивами и лабораторным оборудованием. | Текущий опрос, работа с учебником, стр.88, упр.1, 5-7 | §20,21, упр.14, с.88, инд. Задания подготовить сообщения | 16-ая неделя | |||
| 2 (17) | Многоатомные спирты. Этиленгликоль, глицерин. Свойства, применение | 1 | КУ | Многоатомные спирты. Этиленгликоль, глицерин. Свойства. Применение | Демонстрации: ЛО № 3 Растворение глицерина в воде. Реакция глицерина с гидроксидом меди (II). | Текущий опрос, оценка выступлений обучающих., письм. работа по ДМ: А.М. Радецкий, стр. 29-30 | §22, упр. 4, с.92 | 17-ая неделя | ||||
| 3 (18) | Строение, свойства и применение фенола | 1 | КУ | Фенолы. Строение. Взаимное влияние атомов в молекуле на примере фенола | Демонстрации: ЛО № 4 Взаимодействие фенола с бромной водой и раствором гидроксида натрия. | Текущий опрос | §23, 24, упр. 3,4,6, с.98 | 18-ая неделя | ||||
| 4 (19) | Генетическая связь спиртов и фенола с углеводородами Решение задач по химическим уравнениям при условии, что одно из веществ взято в избытке | 1 | УОИСЗ | Генетическая связь спиртов и фенола с углеводородами. Решение расчетных задач по химическим уравнениям при условии, что одно из реагирующих веществ дано в избытке. | | Текущий опрос, работа с учебником стр.98, упр.7, с ДМ: А.М. Радецкий, стр. 31-32 | с.92, задача 1 | 19-ая неделя | ||||
| Тема 7. Альдегиды, кетоны, карбоновые кислоты - 4 часа | ||||||||||||
| 1 (20) | Карбонильные соединения – альдегиды и кетоны. Свойства и применение альдегидов. | 1 | УИНЗ | Альдегиды. Кетоны. Строение молекул. Функциональная группа. Изомерия и номенклатура. Формальдегид и ацетальдегид: свойства, получение, применение. Ацетон- представитель кетонов. Применение | Демонстрации: Растворение в ацетоне различных органических веществ ЛО №5 Получение этаналя окислением этанола. ЛО № 6 Взаимодействие метаналя (этаналя) с аммиачным раствором оксида серебра (I) и гидроксида меди (II). | Организовывать самостоятельно и мотивированно свою познавательную деятельность (от постановки цели до получения и оценки результата). определять принадлежность веществ к различным классам органических соединений; объяснять зависи-мость свойств в - в от их состава и строения, природу химической связи; составлять уравнения химических реакций; использовать элементы причинно-следственного и структурно-функционального анализа для определения сущностных характеристик изучаемого объекта; мультимедийных ресурсов и компьютерных технологий для обработки, передачи, систематизации информации, создания баз результатов познавательной и практической деятельности уметь использовать приобретенные знания и умения в практической деятельности и повседневной жизни совершенствовать умения выполнения химического эксперимента с соблюдением правил ТБ. переводить информацию из текста в таблицу; владеть различными формами устного публичного выступления; решать расчетные задачи; выдвигать гипотезы и доказывать правильность рассуждений. | Текущий опрос, работа с учебником стр.105, упр.1,3,4 | §25, 26, упр.10, задача 1, с.106, сообщения о карбоновых кислотах | 20-ая неделя | |||
| 2 (21) | Карбоновые кислоты. Получение, свойства и кислот | 1 | КУ | Одноосновные предельные карбоновые кислоты. Строение молекул. Функциональная группа. Изомерия и номенклатура. Свойства карбоновых кислот. Применение. Краткие сведения о непредельных карбоновых кислотах | | Текущий опрос, оценка выступл. обучающ, письм. работа по ДМ: А.М. Радецкий, стр. 29-30, работа с учебником, стр.117, упр.8 | §27, 28, упр.5,7,16, с.117 | 21-ая неделя | ||||
| 3 (22) | Правила ТБ. «Свойства карбоновых кислот» | 1 | УЗЗ | Исследовать свойства карбоновых кислот, обусловленные наличием иона водорода и карбоксильной группы. | Практическая работа № 3. Оборудование и материалы для практической работы. Инструкции ТБ. | Практическ. работа № 3 Оформление работы. | Задание в тетради | 22-ая неделя | ||||
| 4 (23) | Генетическая связь карбоновых кислот с другими классами органических соединений. Решение задач на определение массовой доли выхода продукта от теоретически возможного | 1 | УОИСЗ | Генетическая связь карбоновых кислот с другими классами органических соединений Решение задач на определение массовой доли выхода продукта от теоретически возможного | | Текущий опрос, работа с учебником упр.17а, с.1 работа по ДМ: А.М. Радецкий, стр. 37-38. | §27, 28, стр. 116 (схема), упр.17б, с.118 | 23-ая неделя | ||||
| Тема 8. Жиры. Углеводы - 4 часа. | ||||||||||||
| 1 (24) | Сложные эфиры. Жиры | 1 | УИНЗ | Сложные эфиры, Жиры. Нахождение в природе. Свойства. Применение. Химия в повседневной жизни. Моющие и чистящие средства. Правила ТБ со средствами бытовой химии. | Демонстрации: Знакомство с образцами моющих и чистящих средств. Изучение инструкций по их составу и применению ЛО№7. Растворимость жиров, док-во их непредельного характера, омыление жиров. ЛО № 8 Сравнение свойств мыла и синтетиче-ских моющих средств. | Организовывать самостоятельно и мотивированно свою познавательную деятельность (от постановки цели до получения и оценки результата). определять принадлежность веществ к различным классам органических соединений; объяснять зависи-мость свойств в - в от их состава и строения, природу химической связи; составлять уравнения химических реакций; использовать элементы причинно-следственного и структурно-функционального анализа для определения сущностных характеристик изучаемого объекта; передавать содержания информации адекватно поставленной цели (сжато, полно, выборочно). уметь использовать приобретенные знания и умения в практической деятельности и повседневной жизни совершенствовать умения выполнения химического эксперимента с соблюдением правил ТБ. переводить информацию из текста в таблицу; знать важнейшие вещества мыла, эфиры, глюкозу, сахарозу, крахмал, целлюлозу | Текущий опрос, оценка выступлений обучающих., работа с учебником стр.128, упр.3 | §30.31, упр.3,7, с.128 | 24-ая неделя | |||
| 2 (25) | Углеводы. Глюкоза. Олигосахариды. Сахароза | 1 | УИНЗ | Глюкоза. Строение молекулы. Свойства глюкозы. Применение. Сахароза. Свойства, применение | Демонстрации: ЛО №9 Взаимодействие глюкозы с гидроксидом меди(II), с аммиачным раствором оксида серебра(I). ЛО № 10 Взаимодействие сахарозы с гидроксидом кальция. | Текущий опрос, оценка выступлений обучающих., работа с учебником стр.146 упр.10,11 | §32,33, упр.6,8, с.146 | 25-ая неделя | ||||
| 3 (26) | Крахмал и целлюлоза | 1 | УИНЗ | Крахмал и целлюлоза – представители природных полимеров. Реакции поликонденсации. Физические и химические свойства. Нахождение в природе. Применение. Ацетатное волокно. | Демонстрации: ЛО № 11. Взаимодействие крахмала с йодом. Гидролиз крахмала. ЛО № 12. Коллекции. Ознакомление с образцами природных и искусственных волокон. | Текущий опрос, оценка выступлений обучающих., письм. работа по учебнику. | §33,34, упр.16, с.146 | 26-ая неделя | ||||
| 4 (27) | Правила ТБ. «Решение экспериментальных задач на получение и распознавание органических веществ» | 1 | УЗЗ | Идентификация органических соединений | Практическая работа № 4. Оборудование и материалы для практической работы. Инструкции ТБ. | Практическ. работа №4 Оформление работы. | | 27-ая неделя | ||||
| Раздел 4. Азотосодержащие органические соединения (4 часа) Тема 9. Амины и аминокислоты -2 часа. | ||||||||||||
| 1 (28) | Амины. Строение и свойства. Анилин — представитель ароматических аминов | 1 | УИНЗ | Амины. Строение молекул. Аминогруппа. Физические и химические свойства. Анилин. Свойства, применение. Ацетатное волокно | Демонстрации: Окраска ткани анилиновым красителем. | Определять принадлежность веществ к различным классам органических соединений знать химические свойства основных классов органических соединений; уметь использовать приобретенные знания и умения в практической деятельности и повседневной жизни | Текущий опрос, работа с учебником упр.5,9, с.157 | §36, упр.5,9, с.157 | 28-ая неделя | |||
| 2 (29) | Аминокислоты. Изомерия, номенклатура. Свойства и применение | 1 | КУ | Аминокислоты. Изомерия и номенклатура. Свойства. Аминокислоты как амфотер. органические соединения. Применение | Демонстрации: Доказательство наличия функциональных групп в растворах аминокислот. | Текущий опрос, работа по ДМ: А.М. Радецкий, стр.52 -53 | §37, упр.14, с.157, задача 1, стр.158 | 29-ая неделя | ||||
| Тема 10. Белки -2 часа | ||||||||||||
| 1 (30) | Белки — природные полимеры. Состав, структура, свойства белков | 1 | КУ | Белки – природные полимеры. Состав, структура, свойства. Успехи в получении и синтезе белков. | Демонстрации: ЛО№ 13 Цветные реакции на белки (биуретовая и ксантопротеиновая). | Знать важнейшие вещества белки; химические свойства основных классов органических соединений; объяснять зависимость свойств веществ от их состава и строения; уметь использовать приобретенные знания и умения в практической деятельности и повседневной жизни оценивать и корректировать свое поведение в окружающей среде, выполнять в практической деятельности и в повседневной жизни экологических требований | Текущий опрос | §38, упр.1-5, с.162 подготовить сообщения | 30-ая неделя | |||
| 2 (31) | Химия и здоровье человека. | 1 | УИНЗ | Химия и здоровье. Лекарства, ферменты, витамины, гормоны, минеральные воды. Проблемы, связанные с применением лекарственных препаратов. | Демонстрации: Образцы лекарственных препаратов и витаминов. Образцы средств гигиены и косметики. | Текущий опрос, оценка выступлений обучающих., | §41, подготовить сообщения по теме | 31-ая неделя | ||||
| Раздел 5. Высокомолекулярные соединения (3часа) Тема 11. Синтетические полимеры - 3часа | ||||||||||||
| 1 (32) | Понятие о высокомолекулярных соединениях. Пластмассы и волокна. | 1 | УИНЗ | Понятия о высокомолекулярных соединениях. Строение молекул. Полиэтилен. Полипропилен. Синтетические волокна. | Демонстрации: Образцы пластмасс, синтетических каучуков | Определять: принадлежность веществ к различным классам органических соединений; знать химические свойства основных классов органических соединений; уметь использовать приобретенные знания и умения в практической деятельности; оценивать свои учебные достижений, соотносить приложенные усилия с полученными результатами своей деятельности совершенствовать умения выполнения химического эксперимента с соблюдением правил ТБ. | Текущий опрос, оценка выступлений обучающих., | стр.185, практич. раб. | 32-ая неделя | |||
| 2 (33) | Итоговая контрольная № 2 работа по темам «Кислородсодержащие органич. соединения», «Азотсодержащие органические соединения» | 1 | УК | Урок контроля, оценки и коррекции знаний учащихся | | Контрольная работа № 2 | Задание в тетради | 33-ая неделя | ||||
| 3 (34) | Обобщение знаний по курсу органической химии. Органическая химия, человек и природа | 1 | КУ | | | | Не задано | 34ая неделя | ||||
Календарно-тематическое планирование в 11 классе, 34 часа (1 час в неделю), практических работ –3, контрольных работ - 3
| № п\п | Тема урока | Кол- во часов | Тип урока | Обязательные элементы содержания | Химический эксперимент (оборудование) | Характеристика основных видов деятельности ученика | Измерители (вид контроля) | Д/З | Дата проведения | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |||||||||
| Тема 1. Важнейшие химические понятия и законы -3 ч | ||||||||||||||||||
| 1 (1) | Атом. Химический элемент. Изотопы. Простые и сложные вещества | 1 | КУ | Атом. Изотоп. Химический элемент, простое вещество, оксиды, гидроксиды (основания и кислоты), соли | Демонстрации: ПС; плакат «Классификация веществ»; видеофильм «Химические элементы» | Использовать элементы причинно-следственного анализа для объяснения основных законов; знать основные теории химии; проводить самостоятельный поиск химической информации; использовать приобретенные знания для критической оценки достоверности химической информации, поступающей из разных источников; устанавливать простейшие формулы веществ по массовым долям элементов | Фронтальная беседа | § 1, упр. 1-3, с. 7; записи в тетради | 1 –ая неделя | |||||||||
| 2 (2) | Закон сохранения массы веществ, закон сохранения и превращения энергии при химических реакциях | 1 | КУ | Вещество. Химическая реакция | Демонстрации: Презентация | Текущий опрос, работа с учебником, стр.5-6 | § 2, стр.5-6, упр.4-6, стр.7 | 2 –ая неделя | ||||||||||
| 3 (3) | Закон постоянства состава веществ. Вещества молекулярного и немолекулярного строения | 1 | КУ | Закон постоянства состава, химическая формула, расчёты по формулам | Демонстрации: Презентация | Текущий опрос, работа с учебником письм. сам. с ДМ: А.М. Радецкий, стр. 9 | § 2, стр.6, упр.7, задачи 1,2, стр.7 | 3 –я неделя | ||||||||||
| Тема 2. Периодический закон и периодическая система химических элементов Д. И. Менделеева на основе учения о строении атомов - 4 ч | ||||||||||||||||||
| 1 (4) | Строение атома. Строение электронных оболочек атомов химических элементов | 1 | КУ | Атомные орбитали. Электронная классификация элементов Особенности строения электронных оболочек атомов. Электронная оболочка. Энергетический уровень. Орбитали. Распределение электронов по энергетическим уровням и орбиталям. Электронная конфигурация атома | Демонстрации: ПСХЭ ДИМ | Находить необходимую информацию в источниках разного типа; переводить информацию из одной знаковой системы в другую (из таблицы в текст). объяснять законы диалектики на примере на конкретных примерах ПС; знать основной закон химии - периодический закон; характеризовать элементы малых периодов по их положению в ПС; формулировать свои мировоззренческие взгляды; сравнивать элементы малых и больших периодов; | Текущий опрос, работа по учебнику, стр.22, упр.1-3 | Задание в тетради. | 4 –ая неделя | |||||||||
| 2 (5) | Строение электронных оболочек атомов химических элементов | 2 | КУ | Демонстрации: ПСХЭ ДИМ, таблицы «Электронные оболочки атомов» | Текущий опрос, письм. сам. раб. по ПС, работа по учебнику, стр.22, упр.4 Письм. работа по ДМ: А.М. Радецкий, стр.5-6 | § 3-4, стр.22, упр.5-7, задача 1. | 5,6 –ая неделя | |||||||||||
| 3 (6) | Валентность. Валентные возможности и размеры атомов химических элементов | 1 | КУ | Степень окисления и валентные возможности химических элементов, возбужденное состояние атома. | Демонстрации: ПСХЭ ДИМ таблицы «Электронные оболочки атомов», | Текущий опрос, письм. работа по ДМ: А.М. Радецкий, стр.6-8 | § 5, стр.22, упр.11-17, | 7 –ая неделя | ||||||||||
| 4 (7) | Периодический закон и Периодическая система химических элементов Д.И. Менделеева. Закономерности в изменении свойств химических элементов | 1 | КУ | ПЗ и ПС, структура ПСХЭ. Причина периодичности в изменении свойств хим. элементов. Периоды и группы. ПЗ и строение атома. Современное понятие о химическом элементе. Современная формулировка ПЗ. Причина периодичности в изменении свойств химических элементов. | Демонстрации: ПСХЭ ДИМ | Текущий опрос, работа по учебнику, стр.22, упр.1-3 | Задание в тетради. | 4 –ая неделя | ||||||||||
| Тема 3. Строение вещества - 5 ч | ||||||||||||||||||
| 1 (8) | Химическая связь. Ионная и ковалентная химические связи. | 1 | УК | Химическая связь. Виды химической связи. Ионная связь как особый случай ковалентной полярной связи Ковалентная связь, ее разновидности и механизмы образования. Обменный и донорно-акцепторный механизмы образо-вания ковалентной связи. Типы кристаллических решеток. Аморфное состояние в-ва. | Демонстрация: - таблицы «Химическая связь»; - транспаранты «Виды химической связи» - модели кристаллических решеток | Знать понятия «химическая связь» виды связей, типы кристаллических решеток, теорию химической связи; определять тип химической связи в соединениях; объяснять зависимость свойств веществ от их состава и строения; природу химической связи; использовать мультимедийные ресурсы и компьютерные технологии для обработки и систематизации информации, в практической находить необходимую информацию в источниках разного типа. отделять основную информацию от второстепенной. оценивать объективно свои учебные достижения, соотносить приложенные усилия с полученными результатами своей деятельности. применять полученные знания для решения задач различного уровня уметь использовать приобретенные знания и умения в практической деятельности | Текущий опрос, работа с ДМ. | § 6 (с.24-26), 8, упр. 1-4, (с. 41), задача 1 (с. 42) | 8 –ая неделя | |||||||||
| 2 (9) | Металлическая и водородная связи | 1 | УК | Водородная связь, её роль в формировании структур биополимеров. Водородная связь как особый случай межмолекулярного взаимодействия. Внутримолекулярная водородная связь и её роль в организации структур биополимеров Металлическая химическая связь. Общие физические свойства металлов Сплавы. Черные и цветные сплавы | Демонстрация: - таблицы «Химическая связь»; - транспаранты «Виды химической связи» - модели кристаллических решеток | Текущий опрос, работа с учебником (схема 1), стр.28 Оценка выступлений обучающихся | § 6, 8, упр. 8, задача 2 (с. 41-42) | 9 –ая неделя | ||||||||||
| 3 (10) | Типы кристаллических решеток и свойства вешеств | 1 | УК | Изотопия. Аллотропия. Изомерия. Гомология | | Текущий опрос | § 9, упр. 9, (с. 41), задача 3 (с. 42) | 10 –ая неделя | ||||||||||
| 4 (11) | Дисперсные системы. Обобщение знаний по темам 1-3 | 1 | УОИСЗ | Золи, гели, понятие о коллоидах. Понятие о дисперсной системе. Дисперсная фаза и дисперсионная среда. Классификация дисперсных систем. Коллоидные дисперсные системы. Золи и гели. Значение дисперсных систем в природе и жизни человека | Демонстрации: Образцы пищевых, косметических, биологических и медицинских золей и гелей. Эффект Тиндаля | Текущий контроль- тест, Оценка выступлений обучающихся | Задание в тетради. | 11 –ая неделя | ||||||||||
| 5 (12) | Контрольная работа № 1 по темам « Строение атома. Строение вещества». | 1 | КУ | Выявление УУД, степени их усвоения, полученных при изучении данной темы | | Контрольн. работа № 1 | Не задано | 12 –ая неделя | ||||||||||
| Тема 4. Химические реакции - 7 ч | ||||||||||||||||||
| 1 (13) | Анализ контрольной работы. Сущность и классификация химических реакций | 1 | УИНЗ | Классификация химических реакций в неорганической и органической химии по различным признакам. Особенности реакций в органической химии. Реакции присоединения, полимеризации, замещения и изомеризации в органической химии | Демонстрация: Различные типы химических реакций, видеоопыты по органической химии | Объяснять зависимость свойств веществ от их состава и строения; создавать самостоятельно алгоритмы познавательной деятельности для решения задач творческого и поискового характера; формулировать полученных результатов; оценивать объективно свои учебные достижения; применять полученные знания для решения задач различного уровня; определять характер среды в водных растворах неорганических веществ; использовать приобретенные знания и умения в практической деятельности и повседневной жизни для объяснения явлений, происходящих в природе, быту и на производстве выбирать критерии для сравнения, сопоставления, оценки и классификации объектов; давать определения, приводить доказательства; искать нужную информацию по заданной теме в источниках различного типа; осуществлять само- и взаимопроверку; совершенствовать навыки проведения химического эксперимента, с соблюдением правил ТБ. | Текущий опрос, работа с учебником, стр.45 (схема 4) | § 11, упр.3, 4,8 задача. 1,2, с. 48 | 13 –ая неделя | |||||||||
| 2 (14) | Скорость химических реакций. Факторы, влияющие на скорость химических реакций | 1 | КУ | Химическая кинетика. Гомогенная и гетерогенная среда. Энергия активации. Кинетическое уравнение реакции. Катализ, катализатор, ингибитор | Демонстрация:ЛО № 1 - влияние на скорость химической реакции: - концентрации; - поверхности соприкоснове-ния реагирую-щих веществ; - температуры; - катализатора | Текущий опрос, письм. раб. по ДМ: А.М. Радецкий, стр.14-15 | § 12, упр. 1, 4-6 задачи 1-2 (с.63) | 14 –ая неделя | ||||||||||
| 3 (15) | Химическое равновесие. Принцип Ле Шателье. Производство серной кислоты контактным способом | 1 | КУ | Химическое равновесие, обратимые и необратимые реакции, условия, влияющие на сме-щение химического равновесия (принцип Ле-Шателье), констан-та равновесия Кипящий слой, принцип противотока, принцип теплообмена | Демонстрация: - видеофильм «Основы молекулярно- кинетической теории» | | § 13-14, упр. 7-12, задачи 3, 4 (с. 63) | 15 –ая неделя | ||||||||||
| 4 (16) | Электролитическая диссоциация. Сильные и слабые электролиты. Водородный показатель (pH) раствора | 1 | КУ | Электролитическая диссоциация. Сильные и слабые электролиты. Водородный показатель (рН). Реакции ионного обмена | Демонстрация: Таблица растворимости, алгоритм составления реакций ионного обмена. | Текущий опрос, работа с учебником, с ДМ. | § 15-17, упр. 1-3, задача 1 (с. 74) | 16 –ая неделя | ||||||||||
| 5 (17) | Гидролиз органических и неорганических веществ | 1 | УИНЗ | Среда водных растворов: кислая, нейтральная, щелочная. Гидролиз неорганических и органических соединений. | Демонстрация:ЛО № 2,3 Определение характера среды с помощью универсального индикатора | Текущий опрос, работа с ДМ: А.М. Радецкий, стр.20-21 | § 18, упр. 4-11, | 17 –ая неделя | ||||||||||
| 6 (18) | Обобщение и систематизация знаний по теме «Химические реакции» | 1 | УОИСЗ | Применять УУД полученные при изучении тем, в ходе выполнения тренировочных заданий | | Текущий опрос, работа с ДМ. | Подготовит. к контр. работе, задание в тетради | 18 –ая неделя | ||||||||||
| 7 (19) | Контрольная работа № 2 по теме « Типы химических реакций | 1 | УК | Выявление УУД, степени их усвоения, полученных при изучении данных тем | | Контрольная работа № 2 | Не задано | 19 –ая неделя | ||||||||||
| Тема 5. Металлы - 6 ч | ||||||||||||||||||
| 1 (20) | Анализ контрольной работы. Положение металлов в периодической системе химических элементов Д. И. Менделеева. Общие свойства металлов. Понятие о коррозии металлов. Способы защиты от коррозии | 1 | КУ | Металлы, s-,p-,d- элементы, металлическая связь, металлическая кристаллическая решетка. Понятие о коррозии металлов. Способы защиты от коррозии. Коррозия металлов как окислительно-вос-становительный процесс | Демонстрация: Коллекция: «Металлы». | Характеризовать химические элементы металлы по положению в ПС и строению атомов, химичес-кие свойства металлов, записывать уравнения реак-ций в молекулярном и окислительно-восстановительном виде; владеть навыками организации и участие в коллективной деятельности, самооценка; знать общие способы получения металлов; проводить самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных); выполнять требования, предъявляемые к устному выступлению; объяснять изменение свойств простых веществ металлов, а также их соединений (оксидов, гидроксидов, гидридов) в пределах одного периода и главной подгруппы ПС, характеризовать химические свойства простых веществ металлов (главных подгрупп 1-3 групп), свойства их соединений (оксидов, гидроксидов), записывать уравнения реакций в молекулярном, ионном и ОВР | Текущий опрос | Металлы введение в тему (с. 77-79) упр. 1-4, (с. 89); § 28, задача 1 (с.89) подгот. сообщения | 20-ая неделя | |||||||||
| 2 (21) | Общие способы получения металлов. Сплавы | 1 | КУ | Общие способы получения металлов | Демонстрации: - образцы сплавов и изделий них; | Текущий опрос, ,оценка выступлений обучающихся письм. работа с Радецкий, ДМ: А.М. стр.31-32 | § 19, упр. 5-6, задачи на выход продукта реакции | 21-ая неделя | ||||||||||
| 3 (22) | Электролиз растворов и расплавов | 1 | УИНЗ | Электролиз растворов и расплавов. Практическое применение электролиза. Электролиз растворов и расплавов электролитов на примере хлорида натрия. Электролитическое получение алюминия. | Демонстрации: - электролиз раствора сульфата (хлорида) меди | | § 19, упр. 7-10, 7, 8 задачи 4-5 (с. 89), подгот. сообщения | 22-ая неделя | ||||||||||
| 4 (23) | Обзор металлов главных подгрупп (А-групп) периодической системы химических элементов | 1 | КУ | Металлы главных подгрупп, соединения металлов (оксиды, основания, соли), амфотерность алюминия и его соединений | Демонстрации: - образцы металлов, их оксидов, некоторых солей; - взаимодействие металлов с кислородом, кислотами, водой; - доказательство амфотерности алюминия и его гидроксида | Текущий опрос, | § 21, задания по карточкам,подгот. сообщен. | 23-ая неделя | ||||||||||
| 5 (24) | Обзор металлов побочных подгрупп (Б-групп) периодической системы химических элементов (медь, цинк, железо) | 1 | КУ | Металлы побочных подгрупп, d-элементы | Демонстрации: - образцы меди, железа, хрома, их соединений; - взаимодействие меди и железа с кислородом; - взаимодействие меди и железа с кислотами (серная, соляная); | Характеризовать физические и химические свойства металлов в сравнении с металлами главных подгрупп, записывать уравнения реакций в молекулярном и окислительно-восстановительном виде, прогнозировать химические свойства соединений металлов (железа, меди, хрома) по степени окисления и характеризовать на примере записи уравнений реакций в молекулярном и ионном | Текущий опрос, оценка выступлений обучающихся письм. работа с Радецкий, ДМ: А.М. стр.33-34 | § 22, 23, 26-27 упр. 1-4, 7-12, задачи 2, 4 (с. 118) | 24-ая неделя | |||||||||
| 6 (25) | Оксиды и гидроксиды металлов | 1 | КУ | Оксиды и гидроксиды металлов, их химический характер. | Демонстрации: -получение гидроксида меди, хрома, оксида меди; - взаимодействие оксидов и гидроксидов металлов с кислотами; - доказательство амфотерности соединений хрома (III), | Текущий опрос, письм. работа с Радецкий, ДМ: А.М. стр.37-38 | § 29, упр. 16-18, задача 3, (с. 118) | 25-ая неделя | ||||||||||
| Тема 6. Неметаллы - 9ч | ||||||||||||||||||
| 1 (26) | Обзор свойств неметаллов. Окислительно-восстановительные свойства типичных неметаллов | 1 | КУ | Неметаллы, характеристика элементов и простых веществ, ковалентная связь кристаллические решетки (атомная, молекулярная, физические и химические свойства простых веществ неметаллов | Демонстрации: - образцы неметаллов; -модели кристаллических решеток, алмаза, графита, получение аммиака и хлороводорода, растворение их в воде, доказательство кислотно-основных свойств этих веществ | Составлять формулы соединений неметаллов на основе строения их атомов и ЭО, определять вид химической связи, тип кристаллической решетки, характеризовать физические и химические свойства, записывать уравнения химических реакций в молекулярном, ионном и окислительно-восстановительном виде, характеризовать окислительные свойства азотной, концентрированной серной кислот, расставлять коэффициенты методом электронного баланса; владеть приемами исследовательской деятельности, элементарными умениями прогноза; создавать алгоритмы познавательной деятельности для решения задач творческого и поискового характера; формулировать полученные результаты; определять: принадлежность веществ к различным классам органических соединений; извлекать необходимую информации из источников, созданных в различных знаковых системах; применять полученные при изучении тем знания, умения и навыки при выполнении тренировочных заданий; называть изученные вещества по тривиальной и международной номенклатуре; определять принадлежность веществ к различным классам; объяснять зависимость свойств веществ от их состава и строения; выполнять химический эксперимент по распознаванию с соблюдением правил ТБ; знать правила выбора продуктов питания, правильное использование средств бытовой химии, лекарственных препаратов; использовать приобретенные знания и умения в практической деятельности и повседневной жизни | Текущий опрос, работа с учебником,стр.121, письм. работа с ДМ: А.М. Радецкий, стр.24-26 | § 30, упр. 1-4, задача 2, стр.138 | 26-ая неделя | |||||||||
| 2 (27) | Оксиды неметаллов и кислородсодержащие кислоты Водородные соединения неметаллов | 1 | КУ | Оксиды неметаллов: солеобра-зующие и несолеобразующие, кислотные; физичес-кие и химические свойства оксидов Кислородсодержащие кислоты, конц., разбавленная азотная и серная кислоты, окислительные свойства азотной и серной кислот Летучие водородные соединения, их кислотно-основные свойства | Демонстрации: - сжигание угля и серы в кислороде; - определение химических свойств продуктов сгорания -взаимодействие конц. серной, конц. и разбав-ленной азотной кислот с медью | Текущий опрос, письм. работа с ДМ: А.М. Радецкий,. стр.26-28 | § 31, упр. 5-10, 13 (а), задача 1 (с. 138), 32, упр. 11,13 (б, в), Подготовка к п/р № 3, стр.144 | 27-ая неделя | ||||||||||
| 3 (28) | Правила ТБ. Решение экспериментальных задач по неорганической химии | 1 | УЗЗ | Идентификация органических соединений, проведение качественных реакций. | Практическая работа № 1. Оборудование и материалы для практической работы. Инструкции ТБ. | Практическ. работа № 1 Оформление работы. | п/р № 4, стр.144 | 28-ая неделя | ||||||||||
| 4 (29) | Правила ТБ. Решение экспериментальных задач по органической химии | 1 | УЗЗ | Идентификация органических соединений, проведение качественных реакций на ионы. | Практическая работа № 2. Оборудование и материалы для практической работы. Инструкции ТБ. | Практическ. работа № 2 Оформление работы. | п/р № 6, стр.145 | 29-ая неделя | ||||||||||
| 5 (30) | Правила ТБ. Получение, собирание и распознавание газов | 1 | УЗЗ | Свойства кислот, расчеты по уравнению, получение газов, способы собирания и их идентификация | Практическая работа № 3. Оборудование и материалы для практической работы. Инструкции ТБ. | Практическ. работа № 3 Оформление работы. | Работа с цепочками превращений | 30-ая неделя | ||||||||||
| 6 (31) | Генетическая связь неорганических и органических веществ | 1 | КУ | Химические свойства основных классов неорганических соединений Классификация и номенклатура органических соединений | Справочные таблицы | Текущий опрос, работа с ДМ. | § 33, упр. (с. 143), работа с цепочками превращений | 31-ая неделя | ||||||||||
| 7 (32) | Обобщение и систематизация знаний по темам «Металлы» и «Неметаллы» | 1 | УОИСЗ | Применять УУД полученные при изучении тем, в ходе выполнения тренировочных заданий | Справочные таблицы | Текущий опрос, работа с ДМ: А.М. Радецкий, стр.41-44 | Задания к контр. работе в тетради | 32-ая неделя | ||||||||||
| 8 (33) | Контрольная работа № 3 по темам « Металлы», «Неметаллы» | 1 | УК | Выявление УУД, степени их усвоения, полученных при изучении данных тем : « Металлы», «Неметаллы» | | Контрольн. работа № 3 | Подготов. сообщен. | 33-ая неделя | ||||||||||
| 9 (34) | Анализ контрольной работы. Бытовая химическая грамотность | 1 | КУ | Химия в повседневной жизни. Моющие и чистящие средства. Правила безопасной работы со средствами бытовой химии. Бытовая химическая грамотность. | Демонстрация: - видеофильм «Химия вокруг нас» | Фронтальная беседа, оценка выступлений обучающих. | | 34-ая неделя | ||||||||||
Просмотр содержимого документа
«РП ХИМИЯ 8-9 класс»

ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Статус документа
Образовательная программа по химии для 8-9 классов составлена на основе примерной и соответствует образовательному стандарту.
Программа конкретизирует содержание стандарта, дает распределение учебных часов по разделам курса и рекомендуемую последовательность изучения тем и разделов с учетом межпредметных и внутрипредметных связей, логики учебного процесса, возрастных особенностей учащихся. В программе определен перечень демонстраций, лабораторных опытов, практических занятий и расчетных задач.
Программа выполняет две основные функции:
Информационно-методическая функция позволяет всем участникам образовательного процесса получить представление о целях, содержании, общей стратегии обучения, воспитания и развития учащихся средствами данного учебного предмета.
Организационно-планирующая функция предусматривает выделение этапов обучения, структурирование учебного материала, определение его количественных и качественных характеристик на каждом из этапов, в том числе для содержательного наполнения промежуточной аттестации учащихся.
Место предмета в учебном плане МБОУ «Сарагашская сош»
Учебный план МБОУ «Сарагашская сош» на 2016 - 2017 учебный год предусматривает 138 учебных часов для изучения учебного предмета «Химия» на этапе основного общего образования 8-9 классах по 70 и 68 часов, из расчета 2 учебных часа в неделю.
Цели
Изучение химии в основной школе направлено на достижение следующих целей:
освоение важнейших знаний об основных понятиях и законах химии, химической символике;
овладение умениями наблюдать химические явления, проводить химический эксперимент, производить расчеты на основе химических формул веществ и уравнений химических реакций;
развитие познавательных интересов и интеллектуальных способностей в процессе проведения химического эксперимента, самостоятельного приобретения знаний в соответствии с возникающими жизненными потребностями;
воспитание отношения к химии как к одному из фундаментальных компонентов естествознания и элементу общечеловеческой культуры;
применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
Особенности учебного предмета
Основными проблемами химии являются изучение состава и строения веществ, зависимости их свойств от строения, конструирование веществ с заданными свойствами, исследование закономерностей химических превращений и путей управления ими в целях получения веществ, материалов, энергии. Поэтому, как бы ни различались авторские программы и учебники по глубине трактовки изучаемых вопросов, их учебное содержание должно базироваться на содержании примерной программы, которое структурировано по шести блокам: Методы познания веществ и химических явлений. Экспериментальные основы химии; Вещество; Химическая реакция; Элементарные основы неорганической химии; Первоначальные представления об органических веществах; Химия и жизнь. Содержание этих учебных блоков в авторских программах может структурироваться по темам и детализироваться с учетом авторских концепций, но должно быть направлено на достижение целей химического образования.
Учебно-методическое обеспечение образовательного процесса
Рабочая программа ориентирована на использование учебника:
Химия. Неорганическая химия. 8 класс: учебник для общеобразовательных учреждений/ Г.Е. Рудзитис, Ф.Г. Фельдман - М.: «Просвещение», 2010г.
Химия. Неорганическая химия. 9 класс: учебник для общеобразовательных учреждений/ Г.Е. Рудзитис, Ф.Г. Фельдман - М.: «Просвещение», 2009г.
А также методических пособий для учителя:
Горковенко М.Ю. Поурочные разработки по химии: 8 класс. – М.: ВАКО, 2007.
Горковенко М.Ю. Поурочные разработки по химии: 9 класс. – М.: ВАКО, 2010.
Содержание программы 8 класс
Тема 1. Первоначальные химические понятия (18 час)
Химия – наука о веществах, их свойствах и превращениях. Понятие о химическом элементе и формах его существования. Превращения веществ. Чистые вещества и смеси. Способы очистки смесей. Отличие химических реакций от физических явлений. Роль химии в жизни человека.
Атомы и молекулы. Атомно - молекулярное учение. Простые и сложные вещества. Химический элемент. Закон постоянства состава вещества.
Химическая символика. Знаки химических элементов и происхождение их названий. Химические формулы. Индексы и коэффициенты. Относительная атомная и молекулярные массы. Расчёт массовой доли химического элемента по формуле вещества.
Понятие валентности. Составление химических формул по валентности. Закон сохранения массы веществ, его значение. Химические уравнения. Типы химических реакций
Моль - единица количества вещества. Молярная масса. Вычисления по химическим уравнениям.
Демонстрация
Моделей молекул и атомов. Коллекция самородных элементов (на примере серы). Горение свечи на весах с поглощением продуктов горения. Разложение малахита. Горение магния.
Лабораторные опыты
Рассмотрение веществ с различными физическими свойствами. Разделение смесей. Химические явления (прокаливание медной проволоки, взаимодействие мела с кислотой). Реакции, иллюстрирующие основные признаки характерных реакций. Знакомство с образцами простых и сложных веществ. Образцы типичных металлов и неметаллов.
Практикум
Правила техники безопасности при работе в химическом кабинете. Приёмы обращения с лабораторным штативом со спиртовкой, электронагревателем; изучение строения пламени
Очистка поваренной соли
Тема 2. Кислород. Оксиды, горение. (5 часов)
Кислород, его общая характеристика и нахождение в природе. Получение. Физические свойства кислорода. Химические свойства кислорода. Применение. Круговорот кислорода в природе.
Воздух и его состав. Защита атмосферного воздуха от загрязнения.
Горение и медленное окисление. Тепловой эффект химической реакции.
Демонстрация
Знакомство с образцами оксидов, нефти, каменного угля и продуктами их переработки. Взаимодействие растворов едкого натра с хлорным железом. Получение, собирание и распознавание кислорода.
Практикум Получение и свойства кислорода
Тема 3. Водород (3часа)
Водород, его общая характеристика и нахождение в природе. Получение водорода в лаборатории и его физические свойства кислорода. Химические свойства водорода. Применение водорода
Демонстрация
Получение, собирание и распознавание водорода. Восстановление металлов водородом из их оксидов.
Тема 4. Растворы. Вода. (8 часа)
Растворы. Вода - растворитель. Растворимость веществ в воде. Массовая доля растворенного вещества. Вода. Анализ и синтез воды. Вода в природе и способы ее очистки. Физические и химические свойства воды.
Демонстрация
Растворение веществ с различной растворимостью, растворение веществ в различных растворителях. Получение кристаллов солей. Растворение нитрата аммония. Взаимодействие натрия и кальция с водой.
Практикум. Приготовление растворов солей с определенной массовой долей растворенного вещества
Тема 5: Основные классы неорганических соединений. (9часов)
Оксиды: классификация, номенклатура, свойства, получение, применение.
Основания: классификация, номенклатура, свойства, получение, применение. Физические и химические свойства оснований. Реакция нейтрализации.
Кислоты: классификация, номенклатура, физические и химические свойства.
Соли: классификация, номенклатура, свойства, получение. Физические и химические свойства солей
Генетическая связь между основными классами неорганических соединений.
Демонстрация
Знакомство с образцами оксидов, оснований, кислот, солей. Реакция нейтрализации в присутствии индикатора. Генетическая связь между основными классами неорганических соединений.
Лабораторные опыты
Взаимодействие оксида магния с кислотами
Взаимодействие углекислого газа с известковой водой.
Получение осадков нерастворимых гидроксидов и изучение их свойств. Растворение железа и цинка в соляной кислоте.
Вытеснение одного металла другим из раствора соли.
Практикум. Решение экспериментальных задач по теме «важнейшие классы неорганических соединений
Тема 6: «Периодический закон и периодическая система химических элементов Д.И. Менделеева.Строение атома. (8 часов)
Классификация химических элементов. Амфотерные соединения. Периодический закон
Д.И.Менделеева. Периодическая таблица химических элементов. Строение атома. Изотопы. Строение электронных оболочек атомов. Состояние электронов в атоме Значение периодического закона. Жизнь и деятельность Д.И.Менделеева.
Демонстрация Коллекция самородных элементов. Различные варианты периодической системы. Модель строения атома
Тема 7. Химическая связь. Строение вещества. Закон Авогадро. Молярный объем газов. (11 часов)
Электроотрицательность химических элементов. Ковалентная связь. Полярная и неполярная ковалентная связь. Ионная связь. Кристаллические решетки. Валентность и степень окисления. Правила вычисления степени окисления элементов. Окислительно-восстановительные реакции. Закон Авогадро. Молярный объем газов. Относительная плотность газов. Объемные отношения газов при химических реакциях
Демонстрация
Образование нерастворимых, газообразных и малоионозирующих веществ. Модели кристаллических решеток ковалентных и ионных соединений. Коллекция соединений железа с различными степенями окисления. Горение фосфора.
Тема 8. Галогены. ( 6 часов)
Положение галогенов в периодической таблице и строение их атомов. Хлор: физические и химические свойства, получение и применение. Хлороводород: получение и физические свойства. Соляная кислота и ее соли. Сравнительная характеристика галогенов.
Демонстрация
Распознавание соединений галогенов. Получение хлороводорода и его растворение в воде. Возгонка йода.
Лабораторные опыты. Знакомство с образцами природных соединений неметаллов-хлоридами
Требования к уровню подготовки учеников
В результате обучения в 8 классе ученик будет:
знать / понимать
химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций;
важнейшие химические понятия: химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, химическая связь, вещество, классификация веществ, моль, молярная масса, молярный объем, химическая реакция, классификация реакций, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление;
основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
уметь
называть: химические элементы, соединения изученных классов;
объяснять: физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым элемент принадлежит в периодической системе Д.И. Менделеева; закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп; сущность реакций ионного обмена;
характеризовать: химические элементы (от водорода до кальция) на основе их положения в периодической системе Д.И.Менделеева и особенностей строения их атомов; связь между составом, строением и свойствами веществ; химические свойства основных классов неорганических веществ;
определять: состав веществ по их формулам, принадлежность веществ к определенному классу соединений, типы химических реакций, валентность и степень окисления элемента в соединениях, тип химической связи в соединениях, возможность протекания реакций ионного обмена;
составлять: формулы неорганических соединений изученных классов; схемы строения атомов первых 20 элементов периодической системы Д.И.Менделеева; уравнения химических реакций;
обращаться с химической посудой и лабораторным оборудованием;
распознавать опытным путем: кислород, водород, углекислый газ, аммиак; растворы кислот и щелочей, хлорид-, сульфат-, карбонат-ионы;
вычислять: массовую долю химического элемента по формуле соединения; массовую долю вещества в растворе; количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции; использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
безопасного обращения с веществами и материалами;
экологически грамотного поведения в окружающей среде;
оценки влияния химического загрязнения окружающей среды на организм человека;
критической оценки информации о веществах, используемых в быту;
приготовления растворов заданной концентрации.
Учебно-тематическое планирование 8 класс
| № п/п | Наименование разделов и тем | Количество часов (всего) | Из них(количество часов) |
| ||
| Контрольные работы | Лабораторные и практические работы |
| ||||
| 1 | Тема 1. Первоначальные химические понятия | 18 | 1 | 2 |
| |
| 2 | Тема 2. Кислород. Оксиды, горение. | 5 |
| 1 |
| |
| 3 | Тема 3. Водород | 3 | |
|
| |
| 4 | Тема 4. Растворы. Вода. | 8 | | 1 |
| |
| 5 | Тема 5: «Основные классы неорганических соединений. | 9 | 1 | 1 |
| |
| 6 | Тема 6: «Периодический закон и периодическая система химических элементов Д.И. Менделеева. Строение атома. | 8 | 1 | |
| |
| 7 | Тема 7. Химическая связь. Строение вещества. Закон Авогадро. Молярный объем газов. | 11 | 1 | |
| |
| 8 | Тема 9 Галогены. | 6 | 1 | 1 |
| |
| 9 | Повторение, обобщение | 2 | | |
| |
| В нижней части таблицы часы суммируются |
| |||||
| | Итого: | 70 | 5 | 6 | ||
. Содержание учебной дисциплины
9 класс
68 ч/год (2 ч/нед.)
Повторение основных вопросов 8 класса (4 часа)
Периодический закон и Периодическая система Химических элементов Д.И. Менделеева в свете теории строения атома.
Химическая связь. Строение вещества. Типы кристаллических решеток.
Химические свойства основных классов неорганических веществ. Расчеты по
химическим уравнениям.
Демонстрации. \
Таблица «Виды связей»
Таблица «Типы кристаллических решеток»
Тема 1. Электролитическая диссоциация (14 часов)
Электролиты и неэлектролиты. Электролитическая диссоциация веществ в водных растворах. Ионы. Катионы и анионы.
Электролитическая диссоциация кислот, щелочей и солей. Слабые и сильные электролиты. Степень диссоциации.
Реакции ионного обмена. Окислительно-восстановительные реакции. Окислитель, восстановитель. Гидролиз солей. Демонстрации.
Испытание растворов веществ на электрическую проводимость. Движение ионов в электрическом поле.
Таблица «Электролиты»
Таблица «Количественные отношения в химии».
Таблицы «ОВР», «Многообразие ОВР».
Некоторые химические свойства кислот, солей, оснований.
6. Таблица «Гидролиз водных растворов солей»
Лабораторные опыты.
Реакции обмена между растворами электролитов.
Качественные реакции на ионы. Практическая работа.
1. Решение экспериментальных задач по теме «Электролитическая
диссоциация».
ПОВТОРЕНИЕ ОСНОВНЫХ ВОПРОСОВ 8 КЛАССА (5 часов)
Периодический закон и Периодическая система химических элементов Д. И. Менделеева в свете теории строения атома.
Химическая связь. Строение вещества. Типы кристаллических решеток.
Химические свойства оксидов, кислот, оснований, солей. Расчёты по химическим уравнениям.
Те м а I. ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (14 часов)
Электролиты и неэлектролиты. Электролитическая диссоциация веществ с ионной и ковалентной полярной связью: кислот, щелочей, солей (тепловые явления при растворении).
Степень электролитической диссоциации (сильные и слабые электролиты).
Реакции ионного обмена. Окислительно-восстановительные реакции.
Химические свойства оснований, кислот и солей в свете представлений об электролитической диссоциации и об окислительно-восстановительных процессах.
Расчеты по уравнениям химических реакций для случаев, когда одно из реагирующих веществ дано в избытке.
Демонстрации:
Испытание веществ и их растворов на электрическую проводимость.
Сравнение электрической проводимости концентрированных и разбавленных растворов уксусной кислоты.
Видеофильм «Химия. 9 кл. Электролитическая диссоциация».
Плакат «Количественные величины в химии».
Транспаранты «Процессы окисления-восстановления».
Лабораторные опыты:
Реакции обмена между растворами электролитов.
Качественная реакция на хлорид-ион.
Практическое занятие: «Решение экспериментальных задач по теме «ТЭД».
Расчетные задачи: расчеты по уравнениям химических реакций, если одно из реагирующих веществ дано в избытке.
Т е м а 2. ПОДГРУППА КИСЛОРОДА (5 часов)
Общая характеристика элементов подгруппы кислорода.
Понятие аллотропии на примере кислорода и серы.
Сера. Строение молекул, физические и химические свойства, применение.
Серная кислота. Строение, свойства, применение. Качественная реакция на сульфат-ион.
Молярный объём газов. Закон Авогадро. Относительная плотность газов. Объёмные отношения газов при химических реакциях.
Демонстрации:
Получение озона. Взаимодействие серы с металлами, водородом и кислородом.
Плакат «Количественные величины в химии».
Плакат «Взаимосвязь между физическими величинами».
Лабораторные опыты:
Ознакомление с образцами серы и ее природных соединении.
Распознавание сульфат-иона в растворе.
Расчетные задачи:
Расчеты с использованием понятия «молярный объём газа» по формуле и по уравнению.
Расчеты по уравнению с использованием закона объёмных отношений.
Т е м а 3. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ РЕАКЦИЙ (б часов),
Тепловой эффект химической реакции. Термохимические уравнения, расчеты по ним.
Скорость химических реакций. Зависимость скорости химических реакций от различных условий: от природы реагирующих веществ, площади поверхности соприкосновения, концентрации реагирующих веществ, температуры и катализатора. Химическое равновесие J условия его смещения. Решение задач.
Демонстрации:
Опыты, выясняющие зависимость скорости химической реакции от природы реагирующих веществ (взаимодействие цинка с соляной и уксусной кислотами), от площади поверхности соприкосновения (взаимодействие различных по размеру кусочков мела с кислотой), от концентрации и температуры (взаимодействие цинка с соляной кислотой разной концентрации и взаимодействие оксида меди (II) с серной кислотой при разных температурах).
Видеофильм «Основы молекулярно-кинетической теории».
Компакт-диск «Химия. 9 класс».
Расчетные задачи: расчеты по термохимическим уравнениям.
Те м а 4. ПОДГРУППА АЗОТА (13 часов).
Общая характеристика элементов подгруппы азота.
Азот, строение-молекулы, физические свойства. Химические свойства азота: взаимо-действие с металлами, водородом, .кислородом.
Аммиак, строение молекулы, физические свойства. Химические свойства аммиака: взаимодействие с кислородом, кислотами, водой, оксидами металлов.
Образование иона аммония. Соли аммония, состав, строение, физические и химические свойства: взаимодействие со щелочами, качественные реакции на ион аммония.
Применение аммиака.
Производство аммиака.
Азотная кислота, строение молекулы, физические и химические свойства, применение.
Производство азотной кислоты, круговорот азота.
Фосфор и его соединения (краткая характеристика).
Минеральные удобрения. Расчётные задачи на определение массовой (объёмной) доли выхода продукта реакции от теоретически возможного.
Демонстрации:
Растворение аммиака в воде.
Получение аммиака и его обнаружение.
Качественные реакции на сухие соли аммония и нитраты, растворы аммиака.
Модель установки для получения аммиака.
Видеофильм «Неорганическая химия. Азот и фосфор».
Плакат «Количественные величины в химии».
Лабораторные опыты:
Качественная реакция на растворы солей аммония (взаимодействие их с растворами щелочей при нагревании).
Ознакомление с азотными, фосфорными и калийными удобрениями.
Практическое занятие: решение экспериментальных задач по теме «Подгруппа азота» (1 час).
Расчетные задачи: решение задач на определение массовой (объемной) доли выхода продукта реакции от теоретически возможного.
Тема 5. ПОДГРУППА УГЛЕРОДА (5 часов)
Общая характеристика подгруппы углерода. Сравнительная характеристика углерода и кремния как химических элементов и как простых веществ. Аллотропия углерода и кремния.
Явление адсорбции.
Оксиды углерода (II) и (IV) и оксид кремния: строение молекул (тип связи, тип кристаллической решетки), физические и химические свойства (в сравнении). Применение оксидов.
Угольная и кремниевая кислоты, их соли. Строение, свойства. Качественная реакция на карбонат-ион.
Круговорот углерода в природе. Силикатная промышленность. Расчётные задачи на вычисление массы или объёма продукта реакции по известной массе или объёму исходно-
го вещества, содержащего примеси.
Демонстрации:
Поглощение углем растворенных веществ и газов.
Получение оксида углерода (IV) и взаимодействие его с водой и раствором щелочи.
Получение кремниевой кислоты.
Коллекция «Стекло и изделия из стекла».
Плакат «Количественные величины в химии».
Видеофильм «Неорганическая химия. Углерод и кремний».
Лабораторные опыты:
Качественная реакция на карбонат-ион.
Ознакомление с образцами природных силикатов.
Расчетные задачи: вычисление массы или объема продукта реакции по известной массе или объему исходного вещества, содержащего примеси.
Т е м а 6. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ (3 часа)
Общая характеристика металлов. Физические и химические свойства металлов. Металлическая связь. Металлическая кристаллическая решетка. Понятие о коррозии металлов и способах защиты от неё (обзорно).
Демонстрации:
Образцы металлов. Изучение их электропроводности. Модели кристаллических решеток металлов. ,
Взаимодействие металлов с неметаллами, водой, другими веществами.
Опыты по коррозии металлов и защите их от коррозии.
Видеофильм «Неорганическая химия. Общие свойства металлов».
Лабораторный опыт: рассмотрение образцов металлов.
Тема 7. МЕТАЛЛЫ ГЛАВНЫХ ПОДГРУПП I-Ш ГРУПП ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА (5 часов)
Общая характеристика металлов главных подгрупп I—III групп Периодической системы* химических элементов Д. И. Менделеева (в сравнении). Натрий и кальций. Строение и свойства. Соединения натрия и кальция. Их свойства. Жёсткость воды и способы её устранения.
Алюминий. Характеристика алюминия и его соединений. Амфотерность оксида и гидроксида алюминия. Применение алюминия и его сплавов.
Демонстрации:
Взаимодействие кальция и натрия с водой.
Качественная реакция на ионы кальция и бария.
Устранение жёсткости воды.
Взаимодействие алюминия с водой, кислотами, щелочью, солями.
Механическая прочность оксидной пленки алюминия.
Видеофильм «Металлы главных подгрупп».
Лабораторные опыты:
Ознакомление с важнейшими соединениями - солями натрия, калия, кальция.
Ознакомление с образцами алюминия и его соединений.
Тема 8. ЖЕЛЕЗО - ЭЛЕМЕНТ ПОБОЧНОЙ ПОДГРУППЫ VHI ГРУППЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
(3 часа)
Железо: строение, свойства. Характеристика соединений железа (II) и (III): оксиды,
гидроксиды, соли.
Природные соединения железа.
Демонстрации: природные соединения железа, получение гидроксидов железа (II)
и (Ш), их свойства.
Практическое занятие: металлы, соединения металлов (2 часа).
Тема 9. ПРОМЫШЛЕННЫЕ СПОСОБЫ ПОЛУЧЕНИЯ МЕТАЛЛОВ (2 часа)
Понятие о металлургии. Металлы в современной технике. Основные способы промышленного получения металлов. Электролиз (обзорно).
Демонстрация: электролиз водного раствора хлорида меди (П).
Т е м а 10. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ (б часов)
Понятие об органических веществах и органической химии. Многообразие органических веществ.
Основные идеи теории строения органических соединений по А. М. Бутлерову.
Понятие изомерии.
Предельные углеводороды: состав, строение, свойства (горение, реакция замещения). Применение предельных углеводородов. Понятие о гомологах и гомологических рядах.
Непредельные углеводороды: состав, строение, свойства (горение, реакция присоединения). Применение непредельных углеводородов.
Понятие о циклических углеводородах.
Природные источники углеводородов. Виды топлива.
Кислородсодержащие органические вещества: спирты, карбоновые кислоты, сложные эфиры, жиры, углеводы (общие сведения).
Общие понятия об аминокислотах и белках.
Демонстрации:
Некоторые свойства непредельных углеводородов (горение, реакция присоединения).
Модели молекул некоторых органических веществ, схемы, таблицы.
Коллекция «Нефть и продукты ее переработки».
Компакт-диск «Углерод и его соединения. Углеводороды».
Видеофильм «Органическая химия. Ч. 1».
Компакт-диск «Сложные органические соединения в повседневной жизни».
Требования к уровню подготовки учащихся:
В результате изучения химии ученик должен знать / понимать:
химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций;
важнейшие химические понятия: химический элемент, атом, молекула, относительная атомная и молекулярная массы, химическая связь, вещество, классификация веществ, моль, молярная масса, молярный объем, химическая реакция;
основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
уметь:
называть: химические элементы и соединения изученных классов;
объяснять: физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым элемент принадлежит в периодической системе Д.И. Менделеева, закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп;
характеризовать: химические свойства основных классов неорганических веществ;
определять: состав веществ по их формулам, принадлежность веществ к определенному классу соединений, валентность и степени окисления элемента в соединениях;
составлять: формулы неорганических соединений изученных классов; уравнения химических реакций;
обращаться с химической посудой и оборудованием;
распознавать опытным путем: кислород, водород, углекислый газ; растворы кислот и щелочей; хлорид-ионы;
вычислять: массовую долю химического элемента по формуле соединения; массовую долю вещества в растворе; количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции;
использовать приобретенные знания и умения в практической жизни для:
безопасного обращения с веществами и материалами;
экологически грамотного поведения в окружающей среде;
оценки влияния химического загрязнения окружающей среды на организм человека;
критической оценки информации о веществах, используемых в быту;
приготовления растворов заданной концентрации.
Учебно – тематическое планирование 9 класс
■ ■
| №п/п | Тема | Кол-во часов | В том числе |
| |
|
|
|
| Практические работы | Контрольные работы | |
| 1 | Повторение вопросов за курс 8 класса | 5 | | | |
| 2 | Электролитическая диссоциация | 13 | | | |
| 3 | Кислород и сера | 5 | | | |
| 4 | Закономерности химических реакций | 6 | | | |
| 5 | Азот и фосфор | 13 | | | |
| 6 | Углерод и кремний | 5 | | | |
| 7 | Общие свойства металлов | 4 | | | |
| 8 | Металлы II и III группы ПС | 7 | | | |
| 9 | Железо | 2 | | | |
| 10 | Промышленные способы получения металлов | 2 | | | |
| 11 | Органические соединения | 6 | | | |
| | | | | | |
| Итого | 68 | 6 | 4 | ||
ТРЕБОВАНИЯ К УРОВНЮ ПОДГОТОВКИ ВЫПУСКНИКОВ
В результате изучения химии ученик должен
знать / понимать
•химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций;
важнейшие химические понятия: химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, химическая связь, вещество, классификация веществ, моль, молярная масса, молярный объем, химическая реакция, классификация реакций, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление;
основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
уметь
называть: химические элементы, соединения изученных классов;
объяснять: физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым элемент принадлежит в периодической системе Д.И. Менделеева; закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп; сущность реакций ионного обмена;
характеризовать: химические элементы (от водорода до кальция) на основе их положения в периодической системе Д.И.Менделеева и особенностей строения их атомов; связь между составом, строением и свойствами веществ; химические свойства основных классов неорганических веществ;
определять: состав веществ по их формулам, принадлежность веществ к определенному классу соединений, типы химических реакций, валентность и степень окисления.
Критерии оценивания:
Результаты обучения оцениваются по пятибалльной системе. При оценки учитываются следующие качественные показатели ответов: глубина, осознанность, полнота.
Оценка теоретических знаний
Отметка «5»:
· ответ полный и правильный на основании изученных теорий,
· материал изложен в определенной логической последовательности, литературным языком,
· ответ самостоятельный.
Отметка «4»:
· ответ полный и правильный на основании изученных теорий,
· материал изложен в определенной последовательности,
· допущены 2-3 несущественные ошибки, исправленные по требованию учителя, или дан неполный и нечеткий ответ.
Отметка «3»:
· ответ полный, но при этом допущена существенная ошибка
или ответ неполный, построен несвязно.
Отметка «2»:
· при ответе обнаружено непонимание основного содержания учебного материла,
· допущены существенные ошибки, которые уч-ся не может исправить при наводящих вопросах учителя.
Оценка умений решать расчетные задачи
Отметка «5»:
· в логическом рассуждении и решении нет ошибок,
· задача решена рациональным способом.
Отметка «4»:
· в логическом рассуждении и решении нет существенных ошибок, при этом задача решена, но не рациональным способом,
· допущено не более двух несущественных ошибок.
Отметка «3»:
· в логическом рассуждении нет существенных ошибок,
· допускается существенная ошибка в математических расчетах.
Отметка «2»:
· имеются существенные ошибки в логическом рассуждении и решении.
Оценка экспериментальных умений (в процессе выполнения практических работ по инструкции)
Оценку ставится на основании наблюдения за учащимся и письменного отчета за работу.
Отметка «5»:
· работа выполнена полностью. Сделаны правильные наблюдения и выводы,
· эксперимент осуществлен по плану, с учетом техники безопасности и правил работы с веществами и приборами,
· проявлены организационно-трудовые умения (поддерживается чистота рабочего места , порядок на столе, экономно используются реактивы).
Отметка «4»:
· работа выполнена, сделаны правильные наблюдения и выводы: эксперимент выполнен неполно или наблюдаются несущественные ошибки в работе с веществами и приборами.
Отметка «3»:
· ответ неполный, работа выполнена правильно не менее чем наполовину допущена существенная ошибка (в ходе эксперимента, в объяснении, в оформлении работы, по ТБ при работе с веществами и приборами), которую учащийся исправляет по требованию учителя.
Отметка «2»:
· допущены две или более существенные ошибки в ходе эксперимента, в объяснении, в оформлении работы, по ТБ при работе с веществами и приборами), которые учащийся не может исправить.
Оценка умений решать экспериментальные задачи
При оценке этого умения следует учитывать наблюдения учителя и предъявляемые учащимся результаты выполнения опытов.
Отметка «5»:
· План решения задачи составлен правильно, осуществлен подбор химических реактивов и оборудования, дано полное объяснение и сделаны выводы.
Отметка «4»:
· план решения составлен правильно,
· осуществлен подбор химических реактивов и оборудования.
· допущено не более двух несущественных ошибок (в объяснении и выводах).
Отметка «3»:
· план решения составлен правильно,
· осуществлен подбор химических реактивов и оборудования.
· допущена существенная ошибка в объяснении и выводах.
Отметка «2»:
· допущены две и более ошибки (в плане решения, в подборе химических, реактивов и оборудования, в объяснении и выводах).
Оценка письменных контрольных работ
При оценивании ответа учащегося необходимо читывать качество выполнения работы по заданиям. Контрольная работа оценивается в целом.
Отметка «5»:
· дан полный ответ на основе изученных теорий, возможна несущественная ошибка.
Отметка «4»:
· допустима некоторая неполнота ответа, может быть не более двух несущественных ошибок.
Отметка «3»:
· работа выполнена неполно (но не менее чем наполовину), имеется не более одной существенной ошибки и при этом 2-3 несущественные.
Отметка «2»:
· работа выполнена меньше чем наполовину,
· имеется несколько существенных ошибок.
При оценке выполнения письменной контрольной работы необходимо учитывать требования единого орфографического режима.
Отметка за итоговую контрольную работу корректирует предшествующие при выставлении отметки за четверть, полугодие, год.
Просмотр содержимого документа
«Элективный курс Подготовка к ЕГЭ по биологии»

Пояснительная записка
Рабочая программа составлена в соответствии с
Приказ МО и Н РФ от 05.03.2004 г. №1089 «Об утверждении федерального компонента государственных образовательных стандартов начального общего, основного общего и среднего (полного) общего образования»;
Федеральный компонент государственного стандарта общего образования по биологии (приказ Министерства образования и науки Российской Федерации от 05.03.2004 № 1089)
Письмо МО и Н РФ от 7.07.2005г. №03-1263 «О Примерных программах по учебным предметам федерального базисного учебного плана»
Приказ МО и Н РФ от 09.03.2004г. №1312 «Перечень Примерных программах по учебным предметам федерального базисного учебного плана»
Примерные программы основного общего и среднего (полного) общего образования по по биологии , рекомендованные письмом Департамента государственной политики в образовании МО и Н РФ от 07.06.2005г. № 03-1263
Авторская программа среднего (полного) общего образования под редакцией В.В.Пасечника М. Дрофа 2011г, рекомендованной МО и Н РФ
Приказ Министерства образования и науки РФ от 27.12.2011 года № 2885 «Об утверждении федеральных перечней учебников, рекомендованных (допущенных) к использованию в образовательных учреждениях, реализующих образовательные программы общего образования на 2012/2013 учебный год»
СанПиН 2.4.2. 2821 – 10 «Санитарно-эпидемиологические требования к условиям и организации обучения в общеобразовательных учреждениях» (утверждены постановлением Главного государственного санитарного врача Российской Федерации от 29 декабря 2010 г. № 189, зарегистрированы в Министерстве юстиции России 3 марта 2011 г., регистрационный номер 19993
Программа элективного курса «Подготовка к ЕГЭ по биологии» предназначена для учащихся 11 классов, желающих поступить в учебные заведения, в которых «Биология» является профилирующим вступительным экзаменом (например, специальности медицина, психология).
Рабочая программа составлена для учащихся естественно-математической подгруппы 11 классов (универсальное обучение) и рассчитана на 1 год (количество часов – 34).
Содержание предлагаемой программы включает в себя сведения о строении и принципах функционирования основных регуляторных систем организма человека и животных. В курсе освящены вопросы организации живой материи от молекулярного до биосферного, законы генетики и их цитологические основы, основные этапы и направления эволюции органического мира, происхождение человека, биохимические процессы, протекающие в клетке и организме. Изучение элективного курса базируется на знаниях полученных учащимися при изучении биологии в основной школе. Преподавание курса предусматривает использование различных методов и методических приемов, содействующих эффективному развитию творческого потенциала учащихся, что способствует лучшей подготовке к итоговой аттестации учащихся.
Использование знаний, приобретенных учащимися при изучении других предметов естественно-научного цикла (химии, физики, математики) и общественных дисциплин (географии, обществознания, права), способствует сознательному усвоению, обобщению, систематизации, а также углублению знаний, учебного материала по биологии.
При изучении курса осуществляются межпредметные связи:
применяются знания из курса химии: органические соединения, катализаторы, виды химической связи и типы химических реакций при изучении те «Химический состав клетки», «Строение и функции белков», «Фотосинтез и хемосинтез», «Биосинтез белка», «Энергетический обмен».
понятие диффузии (курс физики) применяется при изучении дыхания организмов и питание клетки.
агрегатное состояние веществ (физика, химия) связано с темой неорганические соединения.
взаимосвязь социальных и природных факторов в эволюции человека, критика расизма (обществознание и история) рассматриваются при изучении темы «Антропогенез».
Понятия: биосфера, гидросфера, литосфера, атмосфера, ареал, абиотические факторы (география) применяется при изучении тем «Биосфера», «Экология».
Основные требования к знаниям и умениям.
Учащиеся должны знать:
принципы работы основных систем человека и животных.
Виды иммунитета и механизм его формирования.
Основные виды наследственности и изменчивости.
Основные стадии антропогенеза, систематическое положение человека и человеческие расы.
Основные этапы и направления эволюции органического мира.
Способы деления клеток и размножение организмов.
Химический состав клетки.
Строение и значение грибов.
Особенности строения и размножения низших, высших споровых и семенных растений.
Особенности строения и многообразия животных.
Приобрести и отработать умения:
Решать генетические задачи.
Изготовлять микропрепараты и работать с микроскопом.
Работая над содержанием курса, составлять планы, схемы, конспекты и таблицы.
Использовать ресурсы сети Интернет, работать с учебной и научно-популярной литературой.
Работать с тестами.
Владеть биологическими терминами и понятиями.
Формулировать собственную позицию и отстаивать ее в дискуссии использую различные сведения для ее аргументации.
Цель:
Подготовка учащихся к сдаче ЕГЭ по биологии. Систематизация знаний и умений выпускников по курсу биологии.
Формирование практических навыков при решении задач и работы со схемами и рисунками.
Психологическая подготовка учащихся к сдаче ЕГЭ по биологии.
Задачи элективного курса:
Совершенствование и развитие познавательной активности, творческого отношения к работе.
Ликвидация пробелов в умениях применять биологические знания для решения задач по цитологии, генетике, обоснования здорового образа жизни.
Формировать умение сравнивать, устанавливать причинно-следственные связи.
Отработка навыка работы с КИМами по биологии.
Структура рабочей программы
Курс «Подготовка к ЕГЭ по биологии» состоит из 4 разделов:
1. Вирусы. Грибы и царство растений (6 ч.)
2. Царство животных (6 Ч.)
3. Анатомия и физиология человека (8 ч.)
4.Общая биология (14 ч.)
Изучения курса построено в направлении усложнения органического мира. В первом разделе изучается строение и многообразие вирусов, бактерий, грибов и растений. Уделяется внимание формированию знаний о различных отделах растительного царства и особенностях их строения, размножения высших споровых растений, о строении вегетативных и генеративных органов цветкового растения, видоизменения корней и побега.
В разделе «Царство животных» учащиеся знакомятся с типами питания и тканями животных. Рассматривается вопрос о влиянии паразитарных одноклеточных и многоклеточных организмов на жизнедеятельность человека и животных, об особенностях строения беспозвоночных и позвоночных животных, эволюции основных систем животных.
Раздел «Анатомия и физиология человека» знакомит учащихся с действием гормонов на организм человека, механизмом иммунитета, влиянием условий окружающей среды на сердечно-сосудистой и дыхательной систем. Рассматривается механизм действия ВИЧ на организм. Уделяется внимание профилактике ВИЧ инфекции. Тема включает региональный компонент: статистические данные о СПИДе по городу и области. В этом же разделе учащиеся изучают процессы кровообращения, дыхания, выделения, пищеварения и виды регуляции. А также вопросы о влиянии вредных привычек на здоровье подростка, о профилактике заболеваний, связанных с недостатком йода.
В последнем разделе включены сведения об органических и минеральных веществах клетки и основных процессах протекающих в ней. Уделяется внимание способам деления клетки и последствиям возникающим при нарушении деления. В этом же разделе рассматриваются факторы, направления и результат эволюции.
Изучение курса заканчивается знакомством экологических проблем и состоянием биосферы. Последние занятия направлены на решение задач и работу по схемам и КИМам.
Литература:
Учебно-тренировочные материалы для подготовки к ЕГЭ 2012 г. Министерство образования РФ.
Журнал «Биология в школе» 2008-2012 г.
.Тесты по биологии для поступающих в ВУЗы. Шалапенок Е. , Камлюк Л.
Биология Реальные варианты ЕГЭ. Федеральный институт педагогических измерений. Москва. 2012
ЕГЭ Биология 2012-Москва «Просвещение» 2012г.
Сборник задач по генетике с решениями. Саратов «Лицей»
Широкий выбор электронных пособий представлен в единой коллекции цифровых образовательных ресурсов: http://school-collection.edu.ru/.
1.Лабораторный практикум Биология 6-11 класс (учебное электронное издание), Республиканский мультимедиа центр Москва. Республиканский мультимедиа центр 2004г
2.Электронная библиотека. Просвещение. Мультимедийное учебное пособие М Просвещение МЕДИА 2003г
3.Эйдос-центр дистанционного образования WWW. Km. ru /education
4. Большая энциклопедия Кирилла и Мефодия (электронное учебное издание),2009
-Тренинг курс ЕГЭ (электронное учебное издание),2009
5. Адреса сайтов в Интернете
http://edu.1c.ru
www.som.sio.ru
единая коллекция цифровых образовательных ресурсов: http://school-collection.edu.ru/.
www.bio.1 september. ru – Газета «Биология» «Первое сентября»;
www.nature.ru - научные новости биологии;
www.herba.msu.ru - ботанический сервер МГУ;
www.zooland.ru - фотографии и доступные сведения о животных на сайте «Кирилл и Мефодий. Животный мир»;
www.protein.bio.msu.ru - кафедра молекулярной биологии МГУ;
www.zin.ru/animalia/coleoptera/rus - самый лучший сайт о жуках;
www.georgetown.edu/cball/animals - сайт с голосами животных, информация об интерпретировании разными народами песен животных;
www.mnr.gov.ru - сайт с государственной информацией Министерства природных ресурсов РФ;
www.zoo.ru/moscow - сайт московского зоопарка;
www.nature.ok.ru - «Редкие и исчезающие животные России» - проект экологического центра МГУ им. М.В. Ломоносова. Содержит профессионально подготовленную информацию обо всех редких и исчезающих животных России для организации их защиты и защиты среды обитания. Имеется библиотека, фотоальбом, видеосюжеты, голоса животных. Приведены различные типы классификаций, в том числе по биотопам;
www.zooclub.ru - самая разнообразная иллюстрированная информация как о жизни диких животных, так и о домашних любимцах. Возможно получение бесплатной консультации по их содержанию и ветеринарии. Открыто большое количество тематических форумов;
www.entomology.narod.ru - информационно–поисковый сайт по энтомологии. Большое количество качественных ссылок на русскоязычные сайты, посвященные всем сторонам жизни различных групп членистоногих, а больше всего – насекомых. Есть уникальное фото и текстовые материалы о пауках;
www.res.krasu.ru - очень разная информация, связанная с птицами, в том числе список видов (со статьями и голосами), библиотека, определитель, фотогалерея, фото от СОПР, Книга рекордов Гиннеса, коллекция ссылок на другие тематические сайты о животных;
www.darwin.museum.ru - сайт позволяет знакомиться с экспозицией государственного Дарвиновского музея, расписанием его работы, содержанием работы выставок;
www.darwin.museum.ru/ expos / dino/ - представляется возможность совершить виртуальную познавательно-увлекательную экскурсию по теме: «Мезозой - эпоха динозавров»;
www.center.fio.ru/method - сетевое объединение учителей-методистов Московского центра Федерации Интернет образования содержит нормативные документы, программы, сетевые ресурсы, учительские находки и разработки уроков;
В материалах содержится все разделы по биологии за 6-11класс.
Календарно-тематический план элективного курса «Подготовка к ЕГЭ по биологии» 10-11 класс
| № п/п дата | Раздел тема урока |
| Компетенции, ЗУН | Учебный материал | Практическая часть | НРК | Формы контроля
| |
| Тема № 1 Вирусы. Грибы и царство растений (7 часов)
| ||||||||
|
| ||||||||
| 1
| Биология как наука Методы познания Вирусы, бактерии. Особенности строения прокариот. | . П1.1, 1.2; Т 1.4,2.1.1,2.6.1 1
| Вирусы – переходная форма между живой и неживой материи. Особенности строения бактерий. | Сапрофиты, паразиты, симбиоз. Болезнетворные бактерии. Виды бактерий: кишечная палочка, стрептококки. |
|
| Сообщение «Микробиологический метод борьбы с насекомыми-вредителями». Конспект. | |
| 2
| Грибы. Общая характеристика. Растения. Особенности растительного организма. Лишайники. Водоросли. | 1
| Особенности строения грибов. Формирование знаний о представителях различных отделах растительного царства и особенностях их строениях. Особенности строения и размножения одноклеточных и многоклеточных водорослей. | Хитин, мицелий, микориза, микоз, конидии, гликоген. Низшие и высшие растения. Хроматофор. Ризоиды. Фотосинтетики, спирогира и коньюгация. | П.р. «Работа с гербариями злаковых культур пораженных головней и спорыньей, с муляжами грибов» | Лишайники Челябинской области | Сообщение «Значение грибов в биосфере и народном хозяйстве». Опорный конспект. Логически опорный конспект. Сообщение «Лишайники- индикаторы воздуха». Вопросы для самоконтроля.
| |
| 3 | Высшие споровые растения. Семенные растения. Особенности строения и жизнедеятельности | 1
| Строение и приспособление растений к различным средам обитания Процессы жизнедеятельности растений. Взаимосвязь органов и организмов | Спорофит, спорангии, гаметофит, заросток. Фотосинтез |
Л. Р. «Общее знакомство с цветковыми растениями» | Видовой состав папоротни-ков, хвощей и плаунов Южного Урала | Промежуточный контроль. Тест по ранее изученным темам. Опорный конспект. | |
| 4 | Цветок и его функции. Соцветие и биологическое значение. Ткани высших растений. | 1
| Строение цветка. Основные типы соцветий. Приспособление к опылению. Оплодотворение цветковых растений. Понятия об основных видах тканей. | Околоцветник: простой, двойной. Тычиночная нить. Пыльник. Рыльце. Завязь. Семязачаток. Антеридии, архегонии. Флоэма, ксилема, меристема, основная ткань | П. р. «Изучение внешнего и внутреннего строения цветка на примере муляжей цветков капусты и пшеницы |
| Сообщение «Опыление цветковых растений». Конспект. Составление таблицы «Ткани растений». | |
| 5 | Вегетативные органы цветковых растений. Корень. Видоизменение корней. | 1 | Сформировать понятия о зонах корня и его функциями. | Стержневая и мочковатая корневые системы. Главный, боковые и придаточные корни. Зоны корня: деление, растяжения, всасывания, проведения, корневой чехлик. Дыхательные, воздушные корни. Корни-прицепки, корневые клубни. | Л.р. «Видоизменение корней». Л.р. «Типы корневых систем». |
| Работа по карточкам. | |
| 6 | Побег-стебель и лист. Видоизменение побега. Характеристика семейств однодольных и двудольных растений. | 1
| Внешнее и внутреннее строение листьев и стебля. Жилкование листьев. Виды и слои стебля. Типы листорасположения. Основные признаки растений относящихся к различным семействам классов однодольных и двудольных растений. | Листовая пластинка и черешок. Листья простые и сложные. Флоэма, ксилема, пробка, камбий, сердцевина, кожица. Жилкование листьев. Тип корневой системы. Строение семян. Плод. | Л.р. «Строение побега и почек, расположение почек на побеге», Л.р. «Подземные побеги». Распознавание растений. Определение жилкования листьев, типа корневой системы. |
| Составление таблицы «Подземные и надземные побеги». Итоговый тест по разделу. | |
| Тема № 2 Царство животных (8 часов) | ||||||||
| 1
| Общая характеристика царства животных Общая характеристика простейших, их многообразие и значение. | 1
| Отличия растительной клетки от животной. Тип питания и ткани животных. Многообразие, среда обитания. Систематические группы. Образ жизни и поведение. | Гетеротрофы. Миксотрофы. Экзодерма. Мезодерма. Энтодерма. Нервная, соединительная, мышечная, эпителиальная. Микронуклеус, макронуклеус, циста, анаэробное и аэробное дыхание, стигма, пелликула, кокцидиоз. Паразиты: трипаносома, лейшмания, малярийный плазмодий, дизентерийная амеба. |
Л.р. «Рассматривание под микроскопом препаратов простейщих». |
| Опорный конспект. | |
| Таблица «Характеристика классов простейших», сообщение «Простейшие-возбудители болезней». | ||||||||
| 2 | Тип кишечнополостные. Плоские черви. Тип Круглые черви. Тип Кольчатые черви. | 1
| Многообразие, среда обитания, образ жизни. Приспособления к паразитическому образу жизни. Многообразие, среда обитания. Особенности строения, многообразие и среда обитания. Приспособления к паразитическому образу жизни. Многообразие, среда обитания и образ жизни. | Кишечная полость. Эктодерма, энтодерма. Планула. Половое и бесполое размножение. Трехслойные. Гермафродиты. Паренхима, протонефридии, ацеломические, билатеральная симметрия, лестничный тип н.с.. Первичная полость. Кутикула. Половой диморфизм. Сегментация, вторичная полость тела, параподии, метанефридии. | . |
| Таблица «Сравнительная характеристика кишечнополостных и губок». Работа с тестами по изученным типам. Таблица «Комплекс приспособлений к паразитизму у червей» Логически опорный конспект. | |
| 3 | Тип Членистоногие. Общая характеристика. Основные отряды насекомых. | 1
| Многообразие. Биологические особенности. Среда обитания и образ жизни. Развитие с полным превращением. Особенности строения насекомых в связи с паразитическим образом жизни. | Хитин, миксоцель, гетеромная сегментация, гемолимфа, мальпигиевы сосуды Грызущие, сосущие и колюще-сосущие ротовые аппараты. Развитие с полным и неполным превращением. | П.р. «Внешнее строение насекомого». | Охраняемые насекомые Челябинской области. | Таблица «Основные признаки классов членистоногих». Сообщение «Насекомые - процветающая группа животных». Конспект. | |
| 4 | Тип Моллюски. Тип Хордовые. Общие характеристики. | 1
| Многообразие. Биологические и экологические особенности. Классы моллюсков. Характерные особенности животных, относящихся к этому типу. | Мантия. Вторичнополостные. Брюхоногие и двустворчатые. Фильтраты. Нефридии, асиметричные и двустороннесиммеиричные
Хорда. Нервная трубка. Жаберное отверстие. |
| Моллюски Южного Урала. | Работа с тестами. Логически опорный конспект. | |
| 5 | Класс Земноводные Класс Рыб. | 1
| Многообразие. Особенности строения. Общая характеристика. Особенности хрящевых и костных рыб. | Трехкамерное сердце. Два круга кровообращения. Легкие. Пятипалые конечности. Метаморфоз. Жабры, плавники, плавательный пузырь. Аккомодация. | Л.р. «Внешнее строение рыб и особенности передвижения». | Много-образие и охрана земновод-ных Ю.Урала Охраняе-мые рыбы Челябинс-кой области. |
Письменная работа с карточками. Вопросы для самоконтроля. Опорный конспект. | |
| 6 | Класс Пресмыкающиеся. | 1 | Многообразие. Биологические и экологические способности. | Внутреннее оплодотворение. Зародышевые оболочки. Роговые образования. Грудная клетка. |
| Многообразие и охрана пресмыкающихся Ю.Урала | Работа с тестами. | |
| 7 | Класс Птиц. | 1 | Многообразие. Особенности внешнего и внутреннего строения. | Воздушные мешки. Двойное дыхание. Четырехкамерное сердце. | П.р. «Изучение внешнего строения птицы». | Птицы парков и садов г. Магнито-горска. | Логически опорный конспект. | |
| 8 | Класс Млекопитающие. | 1 | Важнейшие представители отряда млекопитающие. Биологические и экологические способности. | Живорождение. Волосяной покров. Диафрагма. |
| Млекопитающие Челябинс-кой области занесенные в Красную книгу. | Опорный конспект. Вопросы для самоконтроля. | |
| Тема № 3 Анатомия и физиология человека (8 часов) | ||||||||
| 1
| Ткани. Строение функций опорно-двигательной системы. | 1
| Взаимосвязь строения и функции, типы тканей. Типы костей, химический состав их. Соединение костей. | Эпителиальная ткань, соединительная, мышечная и нервная. Остеон. Губчатое вещество. Компактное вещество. Плоские, трубчатые и губчатые кости. Подвижное, неподвижное и полуподвижное соединение. | Работа по схемам. Работа по схемам. | Причины детского травматиз-ма и правила оказания первой мед. помощи. | Таблица «Ткани человеческого организма». Сообщение «Особенности развития опорно-двигательной системы подростка». Конспект. | |
| 2 | Внутренняя среда организма. Иммунитет. | 1 | Виды иммунитета. Компоненты внутренней среды. | Лимфа. Тканевая жидкость. Кровь. Естественный и искусственный иммунитет. |
| СПИД. Данные по области и городу. | Сообщение «Меры профилактики СПИДа». Таблица «Виды иммунитета». | |
| 3 | Строение и функции системы органов кровообращения. Строение и функции дыхательной системы. | 1
| Виды кровеносных сосудов. Строение и работа сердца. Воздухоносные пути. Газообмен в легких и тканей. Регуляция дыхания. | Аорта. Вены, капилляры. Клапаны. Автоматизм сердца. Трахея, бронхи, альвеолы. | Л.р. Рассматривание под микроскопом готовых микропрепаратов клеток крови лягушки и человека». Работа по схемам. | Влияние окружаю-щей среды Магнито-горска на органы дыхания. | Сообщение «Эволюция кровеносной системы животных», опорный конспект. Сообщение «Эволюция дыхательной системы животных», работа по карточкам. | |
| 4 | Строение и функции пищеварительной системы. Обмен веществ в организме. | 1
| Механизм всасывания веществ, деятельность ферментов. Виды обмена веществ. Этапы обмена. | Ферменты, пищеварение. Метаболизм, катаболизм, анаболизм. | Л.р. «Действие желудочного сока на белки и действие слюны на крахмал». | Причины и источники пищевых отравлений у жителей города. | Сообщение «Эволюция пищеварительной системы животных», работа с тестами. Схема «Обмен веществ», биологический диктант. | |
| 5 | Строение и функции выделительной системы. | 1 | Строение нефрона. Строение функций органов выделения. | Нефрон. Почечная лоханка. Корковый и мозговой слой. | Работа по схемам. |
| Сообщение «Эволюция выделительной системы животных», опорный конспект. | |
| 6 | Строение и функции головного мозга. Строение и функции спинного мозга. В.Н.Д. Анализаторы. Отделы периферической нервной системы. | 1
| Отделы и доли головного мозга. Их функции. Изучение функций и строение спинного мозга. Строение рефлекторной дуги. Строение анализаторов. Виды и особенности рефлексов. . | Нейрон. Продолговатый, средний, промежуточный мозг. Большие полушария. Восходящие и нисходящие пути. Серое и белое вещество. Рефлекс. 1-ая и 2-ая сигнальные системы. Наружное ухо. Внутреннее и среднее ухо. Роговица. Сосудистая и радужная оболочка. Хрусталик. | П.р. « Изучение строения головного мозга по моделям». Работа по схеме. Работа по схемам. |
| Сообщение «Эволюция нервной системы животных», работа по карточкам Логически опорный конспект, вопросы для самоконтроля
Сообщение «Эволюция органов чувств животных», работа с тестами | |
| 7 | Кожа. Эндокринная система. | 1
| Строение и функции. Единство нервной и гуморальной регуляции. Гормоны, вырабатываемые железами и их роль. | Эпидермис. Собственно кожа. Подкожная жировая клетчатка. Гормон, гипофункция и гиперфункция желез. | Работа по схемам.
| Профилактика заболеваний, связанных с недостатком йода в организме. | Сообщение «Эволюция покровов тела у животных», опорный конспект Таблица «Железы внутренней секреции, выделяемые ими гормоны и их физиологический эффект», письменный опрос по карточкам
| |
| 8 | Строение и функции половой системы. | 1 | Особенности системы. | Гаметы. Яичники. Овуляция. Семенники. |
| Влияние вредных привычек на репродуктивное здоровье подростков
| Итоговый тест по теме №3. | |
| Тема №4 Общая биология (15 часов) | ||||||||
| 1 | Основные свойства и уровни организации живой материи. Химический состав клетки. Неорганические вещества. | 1 | Биологическая система, уровни организации и основные свойства живой материи. Роль воды и солей в клетке. | Клеточный, молекулярный, субклеточный, органо-тканевый, дискретность, метаболизм. Гомеостаз, буферность, гидрофобные, гидрофильные.3 |
|
| Опорный конспект, таблица «Важнейшие химические элементы». Сообщение «Биологическая роль воды», вопросы для самоконтроля. | |
| 2
| Органические вещества. Углеводы, липиды. Белки, их строение и функции. | 1
| Строение, свойства и роль углеводов и липидов. Состав, строение, свойства белков и их роль. | Полимер, мономер, полисахариды, олигосахариды. Насыщенные и ненасыщенные жирные кислоты. Ферменты, полипептид, репарация | Л.р «Растворимость аминокислот». |
| Тест по теме «Химический состав клетки», таблица «Классификация углеводов». Логически опорный конспект, сообщение «Многообразие ферментов, их роль в жизнедеятельности клеток и организмов» | |
| 3 | Нуклеиновые кислоты. | 1 | Виды нуклеиновых кислот, строение, функция. | Комплементарность, нуклеотид, аденин, гуанин, цитозин, тимин, урацил. |
|
| Сообщение «Нуклеиновые кислоты- хранители наследственных свойств», таблица «Сравнительная характеристика ДНК и РНК». | |
| 4
| Клеточная теория Фотосинтез и хемосинтез. Энергетический обмен. Биосинтез белка | 1
| Основные положения клеточной теории. Строение клетки. Сравнительная характеристика процессов. Фазы фотосинтеза. Этапы энергетического обмена. Механизм синтеза белка. | Фотолиз. Хемосинтез. Гликолиз. Ген, генетический код, кодон, полисомы. |
|
| Логически опорный конспект, схема «Роль фотосинтеза». Сообщение по теме «Работы С.Н. Виноградского по изучению хемосинтеза». Опорный конспект. Схема «Биосинтез белка». | |
| 5 | Митоз Мейоз, размножение в органическом мире. | 1
| Механизм деления клетки. Его биологическая роль. Мейоз, его механизм и биологическая роль. Формы и значения размножения. Отличия яйцеклетки от сперматозоида. | Жизненный цикл, редупликация, интерфаза. Сперматогенез, овогенез, партеногенез. |
|
| Тест по теме «Биосинтез белка», сообщение «Биологическая роль митоза». Вопросы для самоконтроля. | |
| 6 | Онтогенез. | 1 | Этапы онтогенеза, сущность биогенетического закона. Отличия зиготы от гамет. | Онтогенез, филогенез. Органогенез, бластомеры, прямое и непрямое развитие. |
| Воздейст-вие условий окружающей среды г. Магнитогорска на онтогенез человека. | Письменные ответы на вопросы, сообщение на тему «Влияние окружающей среды на онтогенез человека» | |
| 7 | Законы Г. Менделя и их цитологические основы. Хромосомная теория наследственности. | 1
| Закономерности наследования. 1, 2,3 законы Менделя. Закон Моргана. | Доминантный, гетерозиготный, гомозиготный, рецессивный, аллель Локус. Кроссинговер. Решения задач. Конъюгация. | Решения задач. |
| Биологический диктант, решение задач Решение задач, сообщение «Наследствен-ные заболевания человека», «Заболевания сцепленные с полом» | |
| 8 | Изменчивость, ее виды и биологическое значение. | 1 | Виды мутаций. Их причины и значение. Модификационная, коррелятивная, комбинативная, мутационная изменчивость.. | Фенотип, генотип, норма реакции, геномная, соматическая, генная мутации. |
| Районированные породы животных и сорта растений Ю.Урала | Опорный конспект, сообщение «Достижения современной селекции» | |
| 9 | Дарвин о причинах эволюции. Доказательства эволюции. | 1 | Основные положения учения Ч. Дарвина. Движущие силы эволюции. Формы отбора. | Изменчивость, наследственность. Популяционные волны. Методический, бессознательный, искусственный и естественный отборы. Мимикрия.
| П.р. «Приспособленность организмов к среде обитания». |
| Работа по карточкам, вопросы для самоконтроля. | |
| 10 | Вид его критерии и структура. | 1 | Критерии вида, происхождение видов. Популяции – единица эволюции. | Биохимический, морфологический, генетический. | Л.р. «Изучение морфологического критерия вида». | Л.р. на примере гербарий растений данной местности. | Логически -опорный конспект. | |
| 11 | Основные направления эволюции. Основные этапы эволюции растительного и животного мира. | 1
| Ароморфоз, дивергенция, дегенерация, биологический регресс и прогресс. Происхождение и развитие жизни на земле. | Гомологичные, аналогичные органы. Конвергенция, дивергенция. Псилофиты, риниофиты. |
|
| Тест по темам №14-17, логически-опорный конспект. Таблица «Основные особенности эволюции растительного мира». | |
| 12 | Антропогенез. Расы. Экологические факторы, их влияние на организм .Формы взаимоотношений между организмами
| 1
| Доказательство происхождения человека от животных. Этапы эволюции человека. Классификация факторов. | Рудименты, атавизмы, дриопитеки, питекантроп, синантроп, кроманьонцы. Биотические, абиотические, антропогенные и ограничивающие факторы. Фототропизм, фототаксис. Хищничество, квартиранство, симбиоз
| Л.р. «Влияние антропогенных загрязнителей на содержание витамина «С» в листьях лука» | Стоянки древних людей на Ю.Урале. | Таблица «Факторы антропогенеза», сообщение «Расизм и современность». Опорный конспект, письменные ответы на карточки. | |
| 13 | Биогеоценоз. Агроценоз. Биосфера. | 1
| Состав и структура сообщества. Среды жизни. Круговорот веществ в биосфере. | Консументы, продуценты, редуценты, пищевая цепь. Биогенные вещества, макро и микротрофные вещества. | Составление пищевых цепей. | Характеристика местных биогеоце-нозов, структура цепей питания на примере биотопов Челябинс-кой области. Антропогенное воздействие на природную среду в Магнито-горске. | Вопросы для самоконтроля, конспект. Сообщение «Круговорот серы и фосфора в биосфере», опорный конспект. | |
|
| ИТОГО | 34 |
|
| Л.р. – 12 ч П.р. -5 ч. | Р.К. – 21 ч. |
| |
Темы рефератов
«Вода – колыбель жизни».
«Материальное единство живой и неживой природы на атомарном уровне».
«Функции моно-и полисахоридов в клетках и организмов».
«Денатурация и ренатурация, ее практическое значение».
«Функции белков – основа жизнедеятельности каждого организма на земле».
«Нуклеиновые кислоты – хранители наследственных свойств».
«Бактерии как примитивные формы жизни».
«Особенности строения и функционирования клеток грибов как представителей особого царства живой природы».
«Жизненный цикл в живой природе».
«Мейоз – особый вид деления специализированных клеток».
«Размножение организмов – эстафета жизни в будущие века».
«Мутагены, их влияние на организм».
«Профилактика наследственных заболеваний человека».
«Особенности естественного отбора у растений смешанного леса».
«Эволюционная роль видообразования».
«Биотехнология – новое направление селекции».
«Этические проблемы генетического клонирования животных».
«Происхождение, расселение и особенности рас на земле».
«История экологии, современные экологические проблемы».
«История проблемы о происхождении жизни на земле».
«Филогенетические связи между простейшими».
«Черты пиявок как кровососов».
«Насекомые – прогрессивная ветвь эволюции трахейных животных».
«Типы жизненных циклов у плоских червей».
«Черты специализации малощетинковых червей к плавающему, роющему, сидящему образу жизни».
«Прогрессивные черты организации головоногих как активноплавающих морских хищников».
Материально - техническое оснащение курса
1. Таблицы: «Строение растительной клетки», «Строение животной клетки», «Бактерии», «Деление клетки», «Строение белков клетки», «Строение костей и типы их соединения», «Органы выделения», «Головной мозг человека», «Спинной мозг и схема коленного рефлекса», «Внутреннее строение человека и животных», «Система органов кровообращения человека», «Зрительный анализатор», «Слуховой анализатор», «Кожа», «Опыление», «Вирусы», «Биогеоценоз пресного водоема», «Лист. Побег.».
2. Портреты ученых, внесших вклад в развитие биологии.
3. Схемы: «Строение ДНК, фазы метоза», «Энергетический обмен углеводов», «Строение нервной системы», «Схема кровообращения», «Строение органов пищеварения», «Функции белков», «Функции углеводов».
4. Тестовые задания.
5.
6. Реактивы:
1. П.р. «Работа с гербариями злаковых культур, пораженных головней и спорыньей, с муляжами грибов» (муляжи грибов, гербарий злаковых культур).
2 Л.р. «Общее знакомство с цветковыми растениями» (гербарии цветковых растений).
3. П.р. «Изучение внешнего и внутреннего строения цветка на примере муляжей цветков капусты и пшеницы» (муляжи цветков капусты и пшеницы).
4. Л.р. «Типы корневых систем» (гербарные образцы редьки дикой, одуванчика лекарственного, тимофеевки луговой).
5. Л.р. «Видоизменение корней» (корнеплоды моркови, свеклы, репы, гербарии люпина и чистяка весеннего).
6. Л.р. «Подземные побеги» (клубень картофеля, луковица репчатого лука, гербарий корневищного растения пырея ползучего, раствор люголя, пипетка).
7. Л.р. «Строение побега и почек, расположение почек на побеге» (многолетние побеги и гербарные образцы годичных побегов сирени, липы, клена, препаравальные иглы, скальпель, лупа).
8. Л.р. «Рассматривание под микроскопом препаратов простейших» (микропрепараты: амебы, малярийный плазмодий, вольвокс, эвглена).
9. П.р. «Внешнее строение насекомого» (коллекция насекомых, колорадский, майский жук, бабочка капустница).
10. Л.р. «Внешнее строение рыб, особенности передвижения» (аквариумные рыбы, чешуя карпа, микроскоп).
11. П.р. «Изучение внешнего строения птицы» (чучело голубя)
12. Л.р. «Рассматривание под микроскопом готовых микропрепаратов клеток крови лягушки и человека» (микропрепараты клеток крови лягушки и человека).
13. Л.р. «Действие желудочного сока на белки и действие слюны на крахмал» (накрахмаленный бинт, вата, спички, вода, аптечный йод 5%)
14. П.р. «Изучение головного мозга по моделям» (муляжи головного мозга).
15. Л.р. «Растворимость аминокислот» (глицин, глутаминовая кислота, вода, стеклянные палочки, лакмусовая бумага, пробирки, шпатель).
16. Л.р. «Расщепление перекись водорода с помощью ферментов, содержащихся в живых клетках» (сырой и вареный картофель, перекись водорода).
17. Л.р. «Изучение морфологического критерия вида» (гербарии растений).
18. Л.р. «Влияние антропогенных загрязнителей на содержание витамина «С» в листьях лука» (песок промытый, 2 % раствор соляной кислоты, 0,5 % раствор крахмала, 1 % раствор иодида калия, 0,0001 H раствор иодата).
Литература:
Учебно-тренировочные материалы для подготовки к ЕГЭ 2012 г. Министерство образования РФ.
Журнал «Биология в школе» 2008-2012 г.
.Тесты по биологии для поступающих в ВУЗы. Шалапенок Е. , Камлюк Л.
Биология Реальные варианты ЕГЭ. Федеральный институт педагогических измерений. Москва. 2012
ЕГЭ Биология 2012-Москва «Просвещение» 2012г.
Сборник задач по генетике с решениями. Саратов «Лицей»
Широкий выбор электронных пособий представлен в единой коллекции цифровых образовательных ресурсов: http://school-collection.edu.ru/.
1.Лабораторный практикум Биология 6-11 класс (учебное электронное издание), Республиканский мультимедиа центр Москва. Республиканский мультимедиа центр 2004г
2.Электронная библиотека. Просвещение. Мультимедийное учебное пособие М Просвещение МЕДИА 2003г
3.Эйдос-центр дистанционного образования WWW. Km. ru /education
4. Большая энциклопедия Кирилла и Мефодия (электронное учебное издание),2009
-Тренинг курс ЕГЭ (электронное учебное издание),2009
5. Адреса сайтов в Интернете
http://edu.1c.ru
www.som.sio.ru
единая коллекция цифровых образовательных ресурсов: http://school-collection.edu.ru/.
www.bio.1 september. ru – Газета «Биология» «Первое сентября»;
www.nature.ru - научные новости биологии;
www.herba.msu.ru - ботанический сервер МГУ;
www.zooland.ru - фотографии и доступные сведения о животных на сайте «Кирилл и Мефодий. Животный мир»;
www.protein.bio.msu.ru - кафедра молекулярной биологии МГУ;
www.zin.ru/animalia/coleoptera/rus - самый лучший сайт о жуках;
www.georgetown.edu/cball/animals - сайт с голосами животных, информация об интерпретировании разными народами песен животных;
www.mnr.gov.ru - сайт с государственной информацией Министерства природных ресурсов РФ;
www.zoo.ru/moscow - сайт московского зоопарка;
www.nature.ok.ru - «Редкие и исчезающие животные России» - проект экологического центра МГУ им. М.В. Ломоносова. Содержит профессионально подготовленную информацию обо всех редких и исчезающих животных России для организации их защиты и защиты среды обитания. Имеется библиотека, фотоальбом, видеосюжеты, голоса животных. Приведены различные типы классификаций, в том числе по биотопам;
www.zooclub.ru - самая разнообразная иллюстрированная информация как о жизни диких животных, так и о домашних любимцах. Возможно получение бесплатной консультации по их содержанию и ветеринарии. Открыто большое количество тематических форумов;
www.entomology.narod.ru - информационно–поисковый сайт по энтомологии. Большое количество качественных ссылок на русскоязычные сайты, посвященные всем сторонам жизни различных групп членистоногих, а больше всего – насекомых. Есть уникальное фото и текстовые материалы о пауках;
www.res.krasu.ru - очень разная информация, связанная с птицами, в том числе список видов (со статьями и голосами), библиотека, определитель, фотогалерея, фото от СОПР, Книга рекордов Гиннеса, коллекция ссылок на другие тематические сайты о животных;
www.darwin.museum.ru - сайт позволяет знакомиться с экспозицией государственного Дарвиновского музея, расписанием его работы, содержанием работы выставок;
www.darwin.museum.ru/ expos / dino/ - представляется возможность совершить виртуальную познавательно-увлекательную экскурсию по теме: «Мезозой - эпоха динозавров»;
www.center.fio.ru/method - сетевое объединение учителей-методистов Московского центра Федерации Интернет образования содержит нормативные документы, программы, сетевые ресурсы, учительские находки и разработки уроков;
В материалах содержится все разделы по биологии за 6-11класс.
Просмотр содержимого документа
«Элективный курс подготовки к ЕГЭ по химии»

Содержание
| Название раздела
| Стр. |
| Пояснительная записка
| 3-4 |
| Этапы подготовки учащихся к ЕГЭ по химии
| 4-6 |
| План подготовки к ЕГЭ по химии
| 6-7 |
| Тематический план элективного курса
| 8 |
| Методическое содержание тем элективного курса:
Тема №1. «Электролиз» Тема №2. «Растворы» Тема №3. «Генетическая связь между классами соединений» Тема №4. «Вывод химических формул» Тема №5. «Окислительно-восстановительные реакции» | 9-18 18-32 32-36 36-44 44-54
|
| Заключение
| 55 |
| Список литературы
| 56 |
Пояснительная записка
ЕГЭ по химии в современных условиях совмещает в себе две функции: итоговую аттестацию выпускников за курс средней общеобразовательной школы и представление им возможности продолжить образование по избранной специальности в высшей школе. Анализ результатов экзамена, проводимого в рамках эксперимента в разных регионах России, свидетельствует о том, что его успешная задача зависит от степени владения учащимся теоретическими знаниями за курс средней школы и умениями их использовать в нестандартных ситуациях.
Опыт проведения ЕГЭ свидетельствует о том, что выпускники не достаточно успешно справляются с такой формой проведения экзамена. Для повышения эффективности результатов необходимо осуществлять так же и дополнительную подготовку учащихся к экзамену.
Поверхностное изучение химии не облегчает, а затрудняет ее усвоение. К тому же не все темы, усвоение которых необходимо для успешной сдачи экзамена достаточно и полно рассматриваются в рамках школьной программы. Особенно это касается заданий части С. В связи с этим, элективный курс, предназначенный для учащихся 11 классов, подается на более глубоком уровне и направлен, прежде всего, на расширение, обобщение и пополнение знаний школьников по химии.
Данный элективный курс предназначен для учащихся 11-ых классов и рассчитан на 34 часа (1 час в неделю). Элективный курс может быть реализован за счёт часов школьного компонента учебного плана и может быть использован с целью подготовки учащихся к Единому Государственному экзамену по химии.
Цель: разработка элективного курса для дополнительной подготовки выпускников к выполнению заданий ЕГЭ по химии (преимущественно заданий части С).
Задачи: 1. Подготовить выпускников к единому государственному экзамену по химии;
2. Развить умения самостоятельно работать с литературой, систематически заниматься решением задач, работать с тестами различных типов.
3. Выявить основные затруднения и ошибки при выполнении заданий ЕГЭ по химии.
4. Подобрать задания, преимущественно части С, вызывающие наибольшие затруднения у учащихся при сдаче ЕГЭ по химии, включая задания, недостаточно изучаемых в рамках школьной программы.
5. Проводить информационную работу с учащимися и их родителями.
Этапы подготовки учащихся к ЕГЭ по химии:
1. Особую роль имеет информационная беседа с учениками и их родителями в начале учебного года. В ходе этой беседы необходимо объяснить, что ЕГЭ по химии является, по сути, вступительным испытанием в ВУЗ на определенные специальности. Так как федеральный стандарт базового уровня не предусматривает своей целью подготовки учащихся к поступлению в ВУЗ по данному направлению, то ученик, выбирающий этот экзамен, должен планировать большой объем самостоятельной работы по предмету. Родителям и учащимся необходимо рекомендовать конкретные дополнительные пособия для такой работы.
2. Индивидуальный подход на уроках позволяет частично реализовать задачи подготовка к ЕГЭ небольшой группы учащихся (профильная группа в составе не более 5-7 человек). Для этих учеников задания подбираются более высокого уровня, чем для учащихся общеобразовательной группы в формате ЕГЭ. Эти задания особенно рекомендованы тем, кто готовится к ЕГЭ. В качестве дополнительного свободного домашнего задания предлагаются параграфы и номера заданий из пособий для абитуриентов, обращая внимание на их значимость для подготовки к ЕГЭ.
3. Самостоятельная работа учащихся заключается в более глубоком изучении курса органической химии и общей химии, большем объеме тренировке по применению и закреплению получаемых знаний. Успешность такой работы проверяется подборками тестов и задач, и короткими собеседованиями с учителем. Такие занятия имеются в пособиях для подготовке к ЕГЭ по химии.
Часть тестов для самостоятельной работы дается ученикам с готовыми ответами. Выполняя такие тесты, ученик сверяет свои ответы с «ключом», отмечает допущенные ошибки. Затем он должен проанализировать их. Особым значком отмечаются ошибки, допущенные по невнимательности, особым – те, которые удалось исправить с помощью пособия, особым – те, которые ученик не смог понять. Результаты этого разбора ученик показывает учителю на собеседованиях-консультациях или в любое удобное время.
4. Использование тестов на уроках. Для успешной работы при сдаче ЕГЭ и на других видах контроля в аналогичном формате, учащиеся ознакомлены и знают основные виды тестовых заданий, ориентируются в их структуре, понимают, в какой форме нужно давать ответ в разных частях работы (А,B,C). Этим обусловлена необходимость использования тестовых заданий на уроках химии, начиная с основной школы.
При ответе на часть А используется метод «Ответ с комментариями». Ученик, устно или письменно выполняя задание теста, не просто указывает правильный ответ, но и комментирует его, дает мотивировку своего выбора. При устной фронтальной работе, каждый ученик комментирует свое задание.
5. Дополнительная подготовка к ЕГЭ по химии, которая, в дополнение к базовому курсу, посвящена более глубокому изучению курса общей химии. Она проходит в форме элективного курса и предполагает, прежде всего, успешное решение заданий части С. Именно задания этой части слабо изучаются в рамках школьной программы, вызывают затруднения у учащихся и требуют дополнительные объяснения со стороны учителя.
Наличие элективного курса не исключает необходимости самостоятельной работы учащихся, делая ее более регулярной и организованной. Тесты и задания, выполненные в ходе самостоятельной работы, вопросы, возникшие при этом, также обсуждаются на занятиях элективного курса, в том числе и при работе в парах сменного состава.
Подготовка к ЕГЭ не сводиться только к работе с тестами. Рассмотрение теоретического материала, свойств отдельных элементов и их соединений проводятся при помощи опорных схем, презентаций, лекций. Чтобы за формулами и уравнениями школьники не потеряли связь с реальными веществами и их свойствами, используется демонстрационный эксперимент, видеозаписи опытов, интерактивные динамические модели.
Во фронтальной работе с классом используются компьютерные тренажеры, интерактивные тесты-презентации и т.п. Большую помощь в самостоятельной работе учеников оказывают электронные пособия и ресурсы Интернета.
План подготовки к ЕГЭ по химии
1. Объяснение учащимся целей ЕГЭ:
2. Оценить знания учащихся по предмету за курс полной средней школы;
3. Определить рейтинг среди абитуриентов, которые будут участвовать в конкурсных экзаменах в одинаковые вузы (сентябрь).
Объяснение нормативной базы ЕГЭ по химии, структуры тестов и типы проверочных заданий (сентябрь).
Более глубокое изучение курса химии в рамках элективного курса.
Включает задания, вызывающие наибольшие трудности у учащихся (преимущественно части С), составлены с учетом анализа ошибок, допускаемых учащимися.
Включает темы:
- «Электролиз»,
- «Растворы»,
- «Генетическая связь между классами неорганических и органических соединений»,
- «Вывод химических формул»
- «ОВР»
(сентябрь-апрель).
6. Использование интернет-технологий и предоставление возможности выпускникам работать с образовательными сайтами: mioo.ru, ege.edu.ru, rustest.ru, ed.gov.ru. Работа с демонстрационными версиями ЕГЭ, кодификаторами и спецификацией тестов по химии. Заполнение бланков
(в течение года).
Проведение диагностических контрольных работ в формате ЕГЭ в системе СтатГрад (апрель, май) и анализ ошибок каждого учащегося.
Тематический план элективного курса
«Подготовка учащихся к ЕГЭ по химии»
| № п\п | Тема занятия | кол-во часов |
|
Тема №1. «Электролиз» | ||
| 1.1. | Выполнение упражнений по теме «Электролиз» (инертные электроды) | 2 |
| 1.2. | Решение задач по теме «Электролиз» | 3 |
|
Тема №2. «Растворы» | ||
| 2.1. | Определение концентрации растворенного вещества в растворе с определенной концентрацией | 1 |
| 2.2. | Приготовление раствора определенной концентрации | 2 |
| 2.3. | Разбавление (концентрирование) растворов. | 2 |
| 2.4. | Смешивание растворов одного и того же вещества. | 2 |
| 2.5. | Смешивание растворов различных веществ, приводящее к протеканию химической реакции | 2 |
| 2.6. | Вычисления, связанные с понятием «растворимость вещества» | 2 |
| Тема №3. Генетическая связь между классами соединений. | ||
| 3.1. | Генетическая связь между классами неорганических соединений. | 3 |
| 3.2. | Генетическая связь между классами органических соединений | 3 |
| Тема №4. Вывод химических формул | ||
| 4.1. | Нахождение простейшей химической формулы вещества по массовым долям элементов | 1 |
| 4.2. | Нахождение молекулярной формулы газообразного вещества по массовым долям и относительной плотности его по другому газу | 2 |
| 4.3. | Установление молекулярной формулы газообразного вещества по продуктам сгорания | 2 |
| Тема №5. Окислительно-восстановительные реакции | ||
| 5.1. | Определение степени окисления в химических соединениях | 1 |
| 5.2. | Составление уравнений химических реакций методом электронного баланса | 3 |
| 5.3. | Составление уравнений химических реакций методом полуреакции | 3 |
| ИТОГО: 34 часа | ||
Приложение
Методическое содержание тем элективного курса
Тема №1. «Электролиз»
Электролиз – окислительно-восстановительные реакции, протекающие под действием электрического тока.
Анод – положительно заряженный электрод. В процессе электролиза около анода накапливаются отрицательно заряженные ионы (анионы). На аноде проходят процессы окисления (переход электронов на анод).
Катод – отрицательно заряженный электрод. В процессе электролиза около катода накапливаются положительно заряженные ионы (катионы). На катоде происходят процессы восстановления (переход электронов с катода).
Электролиз позволяет проводить самопроизвольно протекающие реакции в обратном направлении без повышения температуры, однако одной из основных электрохимических задач является увеличение скорости электролиза и уменьшение энергетических затрат.
Электролиз впервые был изучен Фарадеем, который установил два закона электролиза.
1. Закон. Масса вещества выделяющаяся на электроде прямо пропорциональна количеству электричества проходящего через электролит.
m – Q m=I*t, Q (Кл, А*с, А*ч).
Где, m – количество электричества,
I – сила тока,
t - время.
2. Закон. Одно и то же количество электричества выделяет у электродов различные вещества в массах прямо пропорционально их химическим эквивалентам.
m=Эт*Q или m=Эт*I*t
При прохождении через раствор 1 Кулона (А*с) электричества из раствора выделяется 1 химический эквивалент вещества.
При прохождении через раствор количества электричества равного 96500 Кл или 26,8 (А*ч) на электроде выделяется масса вещества равная эквивалентной массе вещества.
Выход по току (n*m) – это процентное отношение полученного вещества к теоретически определенной массе по закону Фарадея.
n = (m практ) 100 %
(m теорет)
При электролизе расплавов электролитов в процессе принимают участие ионы, на которые распадается электролит в процессе электролитической диссоциации. При высокой температуре расплавы солей и щелочей хорошо диссоциируют на ионы, такие ионы более подвижны чем гитратированные, поэтому сопротивление расплавов мало. Активность продуктов электролиза расплавов велика. Они могут взаимодействовать с газами воздуха, с электролитом, с материалом электрохимической ванны, поэтому продукты электролиза расплавов должны быть полностью разделены и все используемые вещества не должны содержать примеси. С целью понижения температуры в электролит добавляют специальные вещества.
При электролизе растворов электролитов в процессе могут принимать участие ионы электролита, молекулы воды, материал анода.
Растворимый (активный) анод – это анод, который способен растворяться (отдавать электроны) в процессе электролиза.
Растворимый анод металлический.
2+ 2-
Cu SO4 Cu + SO4
2+ - 0
Kt(-) Cu + 2e Cu
0 0 - 2+
An(+) An(Cu) Cu – 2e Cu
Нерастворимый (инертный) анод не способен растворяться в процессе электролиза. Он изготовлен из платины, золота, угля, различных органических полимерных материалов.
Электролиз растворов электролитов.
n+ n-
MX M + X
n+ n-
(M – ион металла или водорода; X – анион кислотного остатка).
n-
Анод (А): накапливаются анионы X и молекулы воды.
Электродные процессы:
m+
1. Растворение анода / если анод растворим) A – me A
2. Если анод нерастворим, а анионы остатки безкислородных кислот или
- -
групп OH (кроме F), то идет процесс окисления анионов электролита.
n- - 0
X - ne X
- -
4OH – 4e O2 + 2H2O
3. Если анод нерастворим, а анион – остаток кислородосодержащей кислоты
+
или F , то идет процесс окисления молекул воды:
- +
2H2O – 4e O2 + 4H
m+
Катод (К): накапливаются катионы M и молекул воды.
Электродные процессы:
1. Восстановление катиона металла или иона водорода, (если металл в ряду напряжений стоит после олова):
n+ - 0
M – ne M
+ -
2H – 2e H2
2. Восстановление молекул воды, (если металл в ряду напряжений стоит до алюминия):
- -
2H2O + 2e H2 + 2HOH
Если металл в ряду активностей стоит между оловом и алюминием, то процесс 1 и 2 идут одновременно.
Упражнения по электролизу
Задание №1
Напишите уравнение реакций, протекающих на аноде и катоде и общее уравнение электролиза расплава хлорида магния.
Mg Cl2 – расплав
2+ -
Mg Cl2 → Mg + 2Cl
K(-) A(+)
2+ -
Mg 2Cl
2+ - 0
Mg + 2e → Mg
- 0
2Cl - 2e → Cl2
элек-з
Mg Cl → Mg + Cl2
Задание №2
Напишите уравнение реакций, протекающих на аноде и катоде и общее уравнение электролиза расплава бромида натрия.
Na Br – расплав
+ -
2Na Br → 2Na + 2Br
K(-) A(+)
+ -
2Na 2Br
+ - 0
2Na + 2e → 2Na
- - 0
2Br – 2e → Br2
Эл-з
2Na Br → 2Na + Br2
Задание №3
Напишите уравнение реакций, протекающих на аноде и катоде и общее уравнение электролиза расплава хлорида натрия.
Na Cl – расплав
- +
2Na Cl → 2Na + 2Cl
K(-) A(+)
+ -
2Na 2Cl
+ - 0
2Na + 2e → 2Na
- - 0
2Cl – 2e → Cl2
Эл-з 0 0
2Na Cl 2Na + Cl2
Задание №4
Напишите уравнение реакций, протекающих на аноде и катоде, и общее уравнение электролиза расплава бромида калия.
K Br – расплав
+ -
2K Br→2K + 2Br
K(-) A(+)
+ -
2K 2Br
+ - 0
2K + 2e → 2K
- - 0
2Br – 2e → Br2
Эл-з 0 0
2K Br→ 2K + Br2
Задание №5
Напишите уравнение реакций, протекающих на аноде и катоде, и общее уравнение электролиза расплава хлорида бария.
Ba Cl2 – расплав
2+ -
Ba Cl2 Ba + 2Cl
K(-) A(+)
2+ -
Ba 2Cl
2+ - 0
Ba + 2e → Ba
- - 0
2Cl – 2e→ Cl2
Эл-з 0 0
Ba Cl2 → Ba + Cl2
Задание №6
Напишите уравнение реакций, протекающих на аноде и катоде, и общее уравнение электролиза водного раствора бромида лития на инертных электродах.
2Li Br – раствор
+ -
2Li Br→ 2Li + 2Br
- -
на катоде: 2H2O + 2e→ H2 + 2OH
- - 0
на аноде: 2Br – 2e → Br2
Эл-з
общее уравнение электролиза: 2Li Br + 2H2O→ 2Li OH + Br2 + H2
Задание №7
Напишите уравнение реакций, протекающих на аноде и катоде, и общее уравнение электролиза водного раствора нитрата серебра на инертных электродах.
Ag NO3 – раствор
+ -
4Ag NO3→ 4Ag + 4NO3
+ - 0
на катоде: 4Ag + 4e→ 4Ag
- +
на аноде: 2H2O – 4e → O2 + 4H
Эл-з
Общее уравнение электролиза: 4Ag NO3 + 2H2O → 4NO3 + 4Ag + O2
Задание №8
Напишите уравнение реакций, протекающих на аноде и катоде, и общее уравнение электролиза водного раствора бромида алюминия на инертных электродах.
Al Br3 – раствор
3+ -
2Al Br3 → 2Al + 6Br
на катоде:
- - 0
на аноде: 6Br – 6e → 3Br2
Эл-з
общее уравнение электролиза: 2Al Br3 + 6H2O → 2Al(OH)3 + 3Br2 + 3H2
Задание №9
Напишите уравнение реакций, протекающих на аноде и катоде, и общее уравнение электролиза водного раствора нитрата кальция на инертных электродах.
Ca(NO3)2 – раствор
2+ -
2Ca(NO3)2 → 2Ca + 4NO3
- - - -
На катоде: 2H2O + 2e → H2 + 2OH / 2H2O + 4e → 2H2 + 4OH
- +
На аноде: 2H2O – 4e → O2 + 4H
Эл-з - +
Общее уравнение электролиза: 6H2O → 2H2 + 4OH + O2 + 4H
Эл-з
2H2O → 2H2 + O2
Задание №10
Напишите уравнение реакций, протекающих на аноде и катоде, и общее уравнение электролиза водного раствора ортофосфата натрия на инертных электродах.
Na3 PO4 – раствор
+ 3-
4Na3 PO4 → 2Na + 4PO4
- - - -
На катоде: 2H2O + 2e → H2 + 2OH / 4H2O + 4e → 2H2 + 4OH
- +
На аноде: 2H2O – 4e → 4H + O2
Эл-з + -
Общее уравнение электролиза: 6H2O → 2H2 + O2 + 4H + 4OH
Эл-з
2H2O → 2H2 + O2
Задание №11
Напишите уравнение реакций, протекающих на аноде и катоде, и общее уравнение электролиза водного раствора бромида натрия на инертных электродах.
Задание №12
Напишите уравнение реакций, протекающих на аноде и катоде, и общее уравнение электролиза водного раствора бромида бария на инертных электродах.
Задание №13
Напишите уравнение реакций, протекающих на аноде и катоде, и общее уравнение электролиза водного раствора сульфата меди на инертных электродах.
Задание №14
Напишите уравнение реакций, протекающих на аноде и катоде, и общее уравнение электролиза водного раствора сульфата никеля на инертных электродах.
Задание №15
Напишите уравнение реакций, протекающих на аноде и катоде, и общее уравнение электролиза водного раствора ортофосфата калия на инертных электродах.
Задачи по электролизу
Задача №1
В результате электролиза 1000 грамм 5% раствора сульфата натрия на аноде выделилось 112 л кислорода, измеренного при н.у. Как изменится процентная концентрация раствора после электролиза?
Дано: Решение:
+ 2-
mр-ра (Na2SO4)=1000г 2Na2SO4 → 4Na + 2SO4
w = 5% K(-) A(+)
+ 2-
V(O2)=112л (н.у.) 4Na 2SO4
- - - -
w - ? 2H2O+2e → H2+2OH / 4H2O+4e → 2H2+4OH
- +
2H2O – 4e → O2 + 4H
Эл-з + -
6H2O → 2H2 + O2 + 4H + 4OH
Эл-з 112л
2H2O → 2H2 + O2
22,4
v(O2) = 112л . = 5моль
22,4 л/моль
v(H2O) = 2vO2 = 10моль
m(H2O) = 18г/моль * 10моль = 180г
mр-ра Na2SO4 = 1000 – 180 = 820(г)
m(Na2SO4) = (1000 * 5%) / 100% = 50г
w = 50г / 820г * 100% = 6,09%
масса w(Na2SO4), т.е. концентрация увеличилась.
Ответ: w = 6,09%
Задача №2
При электролизе 1000г 5% раствора нитрата натрия на аноде выделилось 80 литров кислорода, измеренного при 25 0С и давлении p=1,24*105 Па. Рассчитайте массовую долю нитрата натрия в растворе после проведения электролиза.
Дано: Решение:
mр-ра (NaNO3) = 1000г NaNO3 – раствор
w = 5% 4NaNO3+ → 4Na + 4NO3-
V(O2) = 80л K(-) A(+)
t = 25 0C = 298K 4Na+ 4NO3-
p = 1,24*105 Па 2H2O+2e- → H2 +2OH- / 4H2O+4e- → 2H2 +4OH-
w - ? 2H2O – 4e- → O2 + 4H+
6H2O Эл-з 2H2 + O2 + 4OH- + 4H+
2H2OЭл-з 2H2 + O2
pV = vRT
v = pV / RT
v = (1,24*105 Па * 80л) / (8,31*103 Па/моль*К 298К) = 4моль
v(H2O) = 2vO2 = 8моль
m(H2O) = 8моль * 18 г/моль = 144г
m0 р-ра (NaNO3) = 1000 – 144 = 856г
m (NaNO3) = (1000*5%) / 100% = 50г
w = (50 / 856) * 100% = 5,84%
Ответ: w = 5,84%
Задача №3
На заводе подвергли электролизу раствор, содержащий 468 кг NaCl. Полученные газы были использованы для синтеза НС1, которые растворили в 78л воды. Рассчитайте массовую долю (%) хлороводорода в полученной соляной кислоте.
Дано: Решение:
m (NaCl) = 468кг NaCl – раствор
V(H2O) = 708л 2NaCl+ → 2Na + 2Cl-
w(HCl) - ? K(-) A(+)
2Na+ 2Cl-
2H2O + 2e- → H2 + 2OH-
2Cl- – 2e- → Cl20
468кг Эл-з
2NaCl + 2H2O → H2 + Cl + 2NaOH
58 кг/к моль
v(NaCl) = 468кг / 58 кг/к моль = 8моль
v(H2) = v(Cl2) = ½ v(NaCl) = 4моль
H2 + Cl2 2HCl
v(HCl) = 8 моль
m(HCl) = 8моль * 36б5 кг/к моль = 292кг
m(H2O) = V p = 708 * 1 = 708 (кг)
m(р-ра) = 1000кг
w(HCl) = (292 * 100) / 1000 = 29,2%
Ответ: w(HCl) = 29,2%
Задача №4
При электролизе 472г 16,95% раствора KNO3 на катоде выделилось количество водорода оказавшееся достаточным для получения 256г меди при восстановлении ее из оксида меди (II). Вычислить процентное содержание KNO3 после проведения электролиза.
Дано: Решение:
mр-ра (KNO3) = 472г KNO3 – раствор
w = 16,95% 4KNO3 → 4K+ + 4NO3-
m(Cu) = 256г K(-) A(+)
w - ? 2H2O + 2e- →H2 + 2OH- / 4H2O + 4e- → 2H2 + 4OH-
2H2O – 4e- → O2 + 4H+
6H2O → 2H2 + O2 + 4H+ + 4OH-
2H2O → 2H2 + O2 (I)
256г
CuO + H2 → Cu + H2O (II)
64 г/моль
v(Cu) = 256г / 64 г/моль = 4моль
v(Cu) = v(H2) = 4моль (из II)
v(H2) = v(H2O) = 4моль (из I)
m (р-ра KNO3) = 472 – 72 = 400г
m (KNO3) = (472 * 16,95%) / 100% = 80г
w = (80 / 400) * 100% = 20%
Ответ: w = 20%
Задание №5
При пропускании постоянного тока силой 6,4А в течение 30 минут через расплав соли трехвалентного металла на катоде выделилось 1,07г металла, а на аноде 1,344г газа, имеющего плотность по гелию 17,75. определите состав соли, которую подвергли электролизу.
Дано: Решение:
I = 6,4A D(Hl) = Mr(г) / Mr(Hl) = Mr / 4
t = 30м = 1800с Mr(г) = 4*D(Hl) = 4*17,75 = 71, Это Cl2
m(на Me Kt) = 1,07г MeCl3 – расплав
V(An) = 1,344г 2MeCl3 → 2Me2+ + 6Cl-
D(He) = 17,75 K(-) A(+)
Формула соли -? 2Me+ 6Cl-
2Me3+ + 6e- → 2Me0
6Cl- – 6e- → 3Cl20
Эл-з
2MeCl3 → 2Me + 3Cl2
m = (Э*I*t) / F F = 96500Кл
9 = (m*I) / (I*t) = (1,07г*96500) / (6,4А*1800с) = 8,963 = 9
Ar(Me) = Э*В Ar = 9*3 = 27
Простейшая формула AlCl3
v(Al) = 1,07 / 27 = 0,04 (моль)
v(Cl2) = 1,334 / 22,4 = 0,06 (моль)
v(Al) : v(Cl) = 0,04 : 0,12 = 1 : 3
Истинная формула AlCl3
Задача №6
После полного электролитического разложения хлорида кальция 27,75г полученный металл растворили в воде. При добавлении к этому раствору оксида фосфора (V) из него выпал осадок, который при дальнейшем прибавлении оксида фосфора (V) вновь растворяется. Найти массу оксида, необходимого для осуществления перечисленных процессов.
Ответ: m(P2O5) = 35,5г
Тема №2 «Растворы»
Растворы – однородные системы переменного состава, состоят из растворителя и растворенного вещества. Если вещество имеет ограниченную растворимость в растворителе, оно образует насыщенные, ненасыщенные и пересыщенные растворы.
Ненасыщенный раствор – раствор, в котором концентрация растворенного вещества меньше, чем в насыщенном растворе в котором при данных условиях можно растворить еще некоторое его количество.
Насыщенный раствор – раствор, содержащий максимально возможное количество растворенного вещества при данных условиях.
Такие растворы применяют сравнительно редко. В большинстве случаев пользуются ненасыщенными растворами, содержащие меньше растворенного вещества, чем его содержит при данной температуре ненасыщенный раствор.
Состав раствора может выражаться разными способами – как с помощью безразмерных единиц, так и через размерные величины – концентрации.
В химической практике наиболее употребительны следующие величины, выражающие содержание растворенного вещества в растворе.
1. Массовая доля – отношение массы растворенного вещества к массе раствора.
2. Молярная доля – отношение количества растворенного вещества (или растворителя) к сумме количеств всех веществ, составляющих раствор.
В случае раствора одного вещества в другом, молярная доля растворенного вещества (N2) равна:
N2 = n2(n1 + n2),
а молярная доля растворителя (N1):
N1 = n1 / (n1 + n2),
где n1 и n2 – соответственно количество вещества растворителя и растворенного вещества.
3. Молярная концентрация или моляльность – это отношение количества растворенного вещества к массе растворителя. Обычно моляльность обозначается буквой m. Моляльность раствора в отличие от его молярности не изменяется при изменении температуры.
4. Молярная концентрация или молярность – отношение количества растворенного вещества к объему раствора.
Обозначается См или М.
5. Эквивалентная, или нормальная концентрация – отношение числа эквивалентов растворенного вещества к объему раствора. Обозначается Сн или буквой Н.
Объемы растворов, реагирующих веществ обратно пропорциональны их нормальностям.
Пересыщенный раствор – раствор, содержащий при данных условиях больше растворенного вещества, чем в насыщенном растворе, избыток вещества легко выпадает в осадок.
Характеристика ненасыщенных растворов – концентрация (определяет соотношение растворенного вещества и растворителя).
Концентрированный раствор – раствор хорошо растворимого вещества, содержащий растворенного вещества в количестве близком к насыщению.
Способы выражения концентрации веществ.
Массовая доля (процентная концентрация)
w = m(вещества) / m(раствора) * 100%
Массовая доля определяет массу вещества, растворенного в 100г раствора.
Молярная концентрация
См или С = m(вещества) / (m(вещества) * V(раствора))
Молярная концентрация определяет количество вещества растворенного в 1л раствора (Объем выражается в литрах).
Характеристика насыщенных растворов – растворимость определяет максимально возможную концентрацию вещества при данной температуре.
Задачи на растворы
2.1. Определение концентрации растворенного вещества в растворе с определенной концентрацией
Задача №1
25г хлороводорода растворили в 75г воды. Определите массовую долю хлороводорода в полученном растворе.
Дано: Решение:
m(HCl) = 25г w(HCl) = m(HCl) / m(раствора) * 100%
m(H2O) = 75г m(раствора) = m(HCl) + m(H2O) = 75+25=100г
w(HCl) - ? w(HCl) = (25*100) / 100 = 25%
Ответ: w(HCl) = 25%
Задача №2
В 200мл раствора содержится 3,6г хлороводорода. Определите молярную концентрацию полученного раствора.
Дано: Решение:
V(раствора) = 200мл=0,2л См(HCl) = m(HCl) / (M(HCl) * V(раствора))
M(HCl) = 3,6г Cм(HCl) = 3,6 / (3,6 * 0,2) = 0,5(моль/л)
См(HCl) = ? Ответ: 0,5(моль/л)
Задача №3
Какая масса уксусной кислоты содержится в 200мл 0,2М раствора?
Дано: Решение:
См(CH3COOH) = 0,2M См(CH3COOH) = m(CH3COOH) .
V(раствора) = 200мл=0,2л M(CH3COOH) * V(рас-ра)
m(CH3COOH) - ? М(CH3COOH) = 604 г/моль
m(CH3COOH) = См * М(CH3COOH) *V(рас-ра)=
= 0,2М * 0,2л * 604 г/моль = 2,4г
Ответ: 2,4г
Задача №4
В 150г раствора содержится 15г карбоната натрия. Определите массовую долю карбоната натрия в растворе. (Ответ: 10%)
Задача №5
Какая масса нитрата калия содержится в 25г 15% раствора?
(Ответ:3,75г)
Задача №6
Какая масса азотной кислоты содержится в 10г 30% раствора?
(Ответ: 3г)
Задача №7
Какая масса сульфата натрия содержится в 550г 15% раствора?
(Ответ: 82,5г)
Задача №8
Из 2,65г карбоната натрия приготовили 250мл раствора. Определите его молярную концентрацию раствора. (Ответ: 0,1 моль/л)
2.2. Приготовление раствора определенной концентрации
При экспериментальном приготовлении растворов с определенной массовой долей взвешивают на весах рассчитанное количество вещества, отмеряют необходимое количество воды (плотность воды равна 1 г/см3, значит, 1г воды имеет объем 1мл) и смешивают компоненты в химической склянке или стакане.
При приготовлении растворов определенной молярной концентрации взвешивают на весах рассчитанное количество вещества, растворяют его в небольшом количестве воды, а затем переносят в мерную посуду (цилиндр, мерный стакан, мерную колбу) и осторожно прибавляют воду до требуемого объема.
Задача №1
Сколько хлорида бария и воды надо взять для приготовления 150г 20% раствора?
Дано: Решение:
w(BaCl2) = 20% w(BaCl2) = m(BaCl2) / m(раствора) * 100%
m(раствора) = 150г m(BaCl2) = (w(BaCl2) * m(раствора) / 100%=
m(BaCl2) - ? = 20 * 150 / 100 = 30г
m(H2O) - ? m(раствора) = m(BaCl2) + m(H2O)
m(H2O) = m(раствора) - m(BaCl2) = 150 – 30 = 120(г)
Ответ: m(BaCl2) = 30г, m(H2O) = 120г
Задача №2
Какую массу нитрата натрия и воды надо взять для приготовления 2кг 10% раствора?
Дано: Решение:
m(раствора) = 2кг=2000г w(NaNO3) = m(NaNO3) / m(раствора) * 100%
w(NaNO3) = 10% m(NaNO3) = w(NaNO3) * m(раствора) / 100%=
m(NaNO3) - ? = 10 * 2000 / 100 = 200г
m(H2O) - ? m(раствора) = m(NaNO3) + m(H2O)
m(H2O) = m(раствора) - m(NaNO3) = 2000 – 200 = 1800г
Ответ: m(NaNO3) = 200г, m(H2O) = 1800г
Задача №3
Какую массу нитрата аммония NH4NO3 надо взять для приготовления 5л 2М раствора?
Дано: Решение:
См = 2М См = m(вещества) / (М (вещества) * V(раствора))
V(раствора) = 5л См = m (NH4NO3) / (M(NH4NO3) * V(раствора))
m(NH4NO3) - ? m(NH4NO3) = См * М(NH4NO3) * V(раствора) =
= 2 * 80 * 5 = 800г
М(NH4NO3) = 80 г/моль
Ответ: m(NH4NO3) = 800г
Задача №4
Какую массу кристаллогидрата CaCl2 * 6H2O и какую массу воды надо взять для приготовления 300г 15% раствора CaCl2 ?
Дано: Решение:
m(раствора) = 300г w(CaCl2) = m(CaCl2) / m(раствора) * 100%
w(CaCl2) = 15% m(CaCl2) = w(CaCl2) * m(раствора) / 100%=
m(CaCl2 * 6H2O) - ? = 15 * 300 / 100 = 45г
m(H2O) - ? М(CaCl2) = М(Ca) + 2M(Cl) = 40 + 2*35 = 110 г/моль
М(CaCl2 * 6H2O) = 110 + 18*6 = 218 г/моль
Xг 45г
СаСl2 * 6H2O CaCl2
1 моль 1 моль
218 г/моль 110 г/моль
X / 218 = 45 / 110
X = 218 * 45 / 110 = 89,2 (г)
Следовательно для приготовления раствора нужно взять 89,2г CaCl2 * 6H2O
m(раствора) = m(CaCl2 * 6H2O) + m(H2O)
m(H2O) = m(раствора) - m(CaCl2 * 6H2O) = 300 – 89,2 = 210,8 (г)
Ответ: m(CaCl2 * 6H2O) = 89,2г ; m(H2O) = 210,8г
Задача №5
Сколько кристаллогидрата Na2SO4*10H2O и сколько воды надо взять для приготовления 500г 10% раствора NaSO4 ?
Дано: Решение:
m(раствора) = 500г w (Na2SO4) = m(Na2SO4) / m(раствора) * 100%
w(Na2SO4) = 10% m(Na2SO4) = w(Na2SO4) * m(раствора) * 100%=
m(H2O) - ? = 500*10 / 100 = 50г
m(Na2SO4*10H2O) - ? M(Na2SO4) = 142 г/моль
М (Na2SO4*10H2O) = 142 + 10*18 = 322 г/моль
Xг 50г
Na2SO4*10H2O Na2SO4
1 моль 1 моль
322 г/моль 142 г/моль
X / 322 = 50 / 142
X = 322*50 / 142 = 113,4 (г)
Следовательно для приготовления раствора надо взять 113,4г Na2SO4*10H2O
m (раствора) = m(H2O) + m(Na2SO4*10H2O)
m(H2O) = m(раствора) – m(Na2SO4*10H2O) = 500 – 113,4 = 386,6г
Ответ: m(Na2SO4*10H2O) = 113,4г ; m(H2O) = 386,6г
Задача №6
Какую массу хлорида хрома (III) и воды надо взять для приготовления 600г 30% раствора?
(Ответ: 180г CrCl3 и 420г H2O)
Задача №7
Какую массу сульфата натрия надо взять для приготовления 200мл 0,01 М раствора?
(Ответ: 0,284г)
Задача №8
Сколько кристаллогидрата щавелевой кислоты H2C2O4*2H2O надо взять для приготовления 200мл 0,1 М раствора H2C2O4 ?
(Ответ: 2,52г)
Задача №9
Сколько кристаллогидрата ZnCl2*6H2O и сколько воды надо взять для приготовления 2кг 20% раствора ZnCl2 ?
(Ответ: 690,4г ZnCl2*6H2O и 1309,6г H2O)
Задача №10
Какую массу фосфорной кислоты надо взять для приготовления 450мл 0,02 М раствора ?
(Ответ: 0,882г)
2.3. Разбавление (концентрирование) растворов
При добавлении к раствору воды (разбавлении) или упаривании раствора (концентрировании) изменяется общее количество раствора (масса, объем), а количество растворенного вещества остается неизменным.
Задача №1
К 200г 15% раствора хлорида натрия прилили 50г воды. Определите концентрацию полученного раствора.
Дано: Решение:
m(раствора) = 200г w(NaCl) = m(NaCl) / m(раствора) * 100%
w(NaCl) – 15% m(NaCl) до разбавления:
m(H2O) = 50г m(NaCl) = w(NaCl) * m(раствора) / 100%
w2(NaCl) - ? m(NaCl) = 15 * 200г / 100 = 30г
m(NaCl) после разбавления:
m2(раствора) = m1(раствора) + m(H2O) = 200 + 50 = 250 (г)
w2(NaCl) после разбавления:
w2(NaCl) = m(NaCl) / m2(раствора) * 100% = 30*100 / 250 = 12%
Ответ: w2(NaCl) = 12%
Задача №2
500мл 2% раствора сульфата цинка упарили до объема 200мл. Определите молярную концентрацию раствора.
Дано: Решение:
V1(раствора)=500мл=0,5л n(ZnSO4) = m(ZnSO4) / M(ZnSO4)
C1M(ZnSO4) = 2M CM(ZnSO4)=m(ZnSO4) / M(ZnSO4)*V(раствора)=
V2(раствора) =200мл=0,2л = n(ZnSO4) / V(раствора)
С2М(ZnSO4) - ? n(ZnSO4) = C1M(ZnSO4) * V1(раствора) =
= 2*0,5=1(моль)
СM2(ZnSO4) = n(ZnSO4) / V2(раствора) = 1 / 0,2 = 5 (моль/л)
Ответ: С2М(ZnSO4) = 5 моль/л
Задача №3
К 350г 25% раствора соленой кислоты добавили 150г воды. Найти массовую долю соляной кислоты в полученном растворе.
Дано: Решение:
m(раствора) = 350г w(HCl) = m(HCl) / m1(раствора)
m(H2O) = 150г m(HCl) = w(HCl)*m(раствора) / 100% =
w1(HCl) = 25% = 25*350 / 100 = 85,5г
w2(HCl) - ? m2(раствора) = m1(раствора)+m(H2O) = 350+150=500г
w2(HCl) = m(HCl) / m2(раствора) * 100% =
= 85,5*100 / 500 = 17,5%
Ответ: w2(HCl) = 17,5%
Задача №4
Из 500г 17% раствора серной кислоты упариванием удали 300г воды. Найдите массовую долю серной кислоты в полученном растворе.
Дано: Решение:
m(раствора) = 500г w(H2SO4) = m(H2SO4) / m(раствора) * 100%
m(H2O) = 300г m(H2SO4) = w(H2SO4)*m(раствора) / 100% =
w1(H2SO4) = 17% = 17*500 / 100 = 85г
w2(H2SO4) - ? m2(раствора) = m1(раствора) – m(воды) =
= 500 – 300 = 200г
w2(H2SO4) = 85 / 200 * 100% = 42,5%
Ответ: w2(H2SO4) = 42,5%
Задача №5
200мл 1,5М раствора хлорида бария разбавили до объема 300мл. Определите молярную концентрацию полученного раствора.
Дано: Решение:
V1(раствора) = 200мл = 0,2л n(BaCl2) = m(BaCl2) / M(BaCl2)
C1M(BaCl2) = 1,5M CM(BaCl2)=m(BaCl2) / M(BaCl2)*V(раствора)=
V2(раствора) = 300мл=0,3л = n(BaCl2) / V(раствора)
C2M(BaCl2) - ? n(BaCl2) = C1M(BaCl2)*V1(раствора) =
= 1,5М * 0,2л = 0,3 моль
С2M(BaCl2) = n(BaCl2) / V2(раствора) = 0,3 / 0,3 = 1 (моль/л)
Ответ: С2М(BaCl2) = 1 (моль/л)
Задача №6
К 2г 25% раствора гидроксида натрия добавили 500г воды. Найдите массовую долю гидроксида натрия в полученном растворе.
(Ответ: 200%)
Задача №7
Из 170г 30% раствора нитрата меди упариванием удалили 30г воды. Найдите массовую долю нитрата меди в полученном растворе.
(Ответ: 36,4%)
Задача №8
500мл 3М раствора гидроксида калия разбавили до объема 2л. Определите молярную концентрацию полученного раствора.
(Ответ: 0,75М)
Задача №9
0,5л 0,2М раствора сульфата натрия упарили до объема 200мл. Определите молярную концентрацию полученного раствора.
(Ответ: 0,5М)
2.4. Смешивание растворов одного и того же вещества
При смешивании раствора одного вещества разной концентрации изменяется не только общая масса раствора, но и масса растворимого вещества. Масса вещества после смешивания растворов вычисляется как сумма масс вещества в растворах с различной концентрацией. Правило «креста» для смешивания растворов с известной массовой долей.
Для приготовления 23% раствора за счет смешивания 20% и 30% растворов надо взять:
w1 20% 7 7 частей 20% раствора (по массе)
23%
w2 30% w3 3 3 части 30% раствора (по массе)
w1 и w2 – концентрации (массовые доли) растворов, взятые для смешивания.
w3 – концентрация после смешивания растворов.
7 частей 20% раствора и 3 части 30% раствора – массовые части исходных растворов, которые надо взять для получения растворов нужной концентрации (получены путем вычитания вдоль проведенных диагоналей).
Задача №1
Смешали 200г 15% раствора NaCl и 300г 10% раствора этого же вещества. Определите концентрацию полученного раствора.
Дано: Решение:
Раствор NaCl w(NaCl) = m(NaCl) / m(раствора) * 100%
m1(раствора) = 200г m1(NaCl) = w1(NaCl)*m1(раствора) / 100% =
w1 = 15% = 15*200 / 100 = 30г
m2(раствора) = 300г m2(NaCl) = w2(NaCl)*m1(раствора) / 100% =
w2 = 10% = 10*300 / 100 = 30г
w3 - ?
После смешивания двух растворов изменилась не только общая масса раствора, но и масса растворенного вещества.
Найдем массу NaCl в растворе после смешивания:
m3(NaCl) = m1(NaCl) + m2(NaCl) = 30 + 30 = 60 (г)
Найдем массу раствора после смешивания:
m3(раствора) = m1 + m2 = 200 + 300 = 500г
Найдем массовую долю NaCl в растворе после смешивания:
w3(NaCl) = m3(NaCl) / m3(раствора) * 100% = 60*100 / 500 = 12%
Ответ: w3(NaCl) = 12%
Задача №2
Смешали 15г 5% раствора серной кислоты и 35г 86% раствора этого же вещества. Определите массовую долю полученного раствора.
Дано: Решение:
Раствор H2SO4 w1(H2SO4) = m(H2SO4) / m(раствора) * 100%
m1(раствора) = 15г m1(H2SO4) = w1(H2SO4) * m(раствора) / 100% =
w1 = 5% = 15*5 / 100 = 0,75г
m2(раствора) = 35г m2(H2SO4) = w2(H2SO4) * m2(раствора) / 100% =
w2 = 86% = 86*35 / 100 = 30,1г
w3 - ? m3(H2SO4) = m1(H2SO4)+m2(H2SO4) = 0,75+30,1=30,85г
m3(раствора) = m1(раствора)+m2(раствора) = 15+35 = 50г
w3 = m3(H2SO4) / m3(раствора) * 100% = 30,85*100 / 50 = 61,7%
Ответ: w3 = 61,7%
Задача №3
В лаборатории имеются растворы с массовой долей хлорида натрия 10% и 20%. Какую массу каждого раствора надо взять для получения 300г раствора с массовой долей хлорида натрия 12%?
Дано: Решение:
w1(NaCl) = 10% 20 2 части 20% раствора (NaCl)
w2(NaCl) = 20% 12
w3(NaCl) = 12% 10 8 частей 10% раствора (NaCl)
m3(раствора) = 300г Всего надо взять 8 + 2 = 10 частей растворов
m1(раствора) - ? Определим массу раствора (w1(NaCl) = 10%
m2(раствора) - ? 10 частей – 300г
8 частей – xг
10 / 8 = 300 / x ; x = 8*300 / 10 = 240г
Определим массу раствора w2(NaCl) = 20%
m2(раствора) = 300 – m1(раствора) = 300 – 240 = 60г
Ответ: 240г 10% раствора и 60г 20% раствора
Задача №4
В каком соотношении (по массе) надо смешать 15% и 30% растворы хлорида натрия для получения 18% раствора?
(Ответ: 12 частей 15% раствора и 3 части 30% раствора).
Задача № 5
В каком соотношении (по массе) надо смешать безводную (100%) серную кислоту и ее 10% раствор для получения 48% раствора серной кислоты?
(Ответ: 38 частей безводной кислоты и 52 части 10% раствора).
Задача №6
Сколько 12% и 15% растворов нитрата магния (по массе) надо взять для того, чтобы приготовить 300г 14% раствора?
(Ответ: 100г 12% раствора; 200г 15% раствора).
Задача №7
Сколько 60% и 40% растворов азотной кислоты (по массе) надо взять для того, чтобы приготовить 1кг 55% раствора?
(Ответ: 750г 60% раствора; 250г 40% раствора).
Задача №8
Смешали 5л 0,1М раствора гидроксида бария и 3л 0,02М раствора этого же вещества. Определите молярную концентрацию полученного раствора.
(Ответ: 0,07М).
Задача №9
Смешали 2кг 35% раствора гидроксида натрия и 1кг 10% раствора этого же вещества. Определите массовую долю полученного раствора.
(Ответ: 26,7%).
Задача №10
Смешали 300г 17% раствора фосфорной кислоты и 500г 20% раствора этого же вещества. Определите массовую долю полученного раствора.
(Ответ: 18,9%).
2.5. Смешивание растворов разных веществ, приводящее к протеканию химической реакции.
Задачи данного типа связаны концентрацией растворов и различными расчетами по химическим уравнениям.
Если в условии задачи даны массы раствора и его массовая доля или объем раствора и его молярная концентрация, начните решение задачи с определения массы вещества, вступающего в реакцию.
Задача №1
Какая масса осадка образуется при взаимодействии 20г 15% раствора хлорида натрия с избытком раствора нитрата серебра?
Дано: Решение:
m(раствора)(NaCl) = 20г w(NaCl) = m(NaCl) / m(раствора) * 100%
w(NaCl) = 15% m(NaCl) = w(NaCl) * m(раствора) / 100% =
AgNO3 = 15 * 20 / 100 = 3 (г)
m(осадка) - ? M(NaCl) = 58 (г/моль)
М(AgNO3) = 143 (г/моль)
3г xг
NaCl + AgNO3 → AgCl + NaNO3
1 моль 1 моль
58 г/моль 143 г/моль
3 / 58 = x / 143 ; x = 3*143 / 58 = 7,4 (г)
Ответ: m(AgCl) = 7,4 (г)
Задача №2
Какой объем 0,2М раствора сульфата меди требуется для реакции с 10,35г хлорида бария?
Дано: Решение:
См(CuSO4) = 0,2M CuSO4 + BaCl2 → BaSO4 + CuCl2
M(BaCl2) = 10,35г М(СuSO4) = 160 г/моль
V(раствора)(СuSO4) - ? М(BaCl2) = 207 г/моль
Xг 10,35г
СuSO4 + BaCl → BaSO4 + CuCl2
1 моль 1 моль
160 г/моль 207 г/моль
x / 160 = 10,35 / 207; x = 160*10,35 / 207 = 8 (г)
См(СuSO4) = m(CuSO4) / M(CuSO4) * V(раствора)
V(раствора) = m(CuSO4) / M(CuSO4) * См(CuSO4) =
= 8 / 160*0,2 = 0,25 (л)
Ответ: V(раствора) = 0,25л
Задача №3
Какая масса 15% раствора карбоната натрия требуется для реакции с 200г 10% раствора хлорида кальция?
Дано: Решение:
w(Na2CO3) = 15% w(CaCl2) = m(CaCl2) / m(раствора) * 100%
m(раствора)(СaCl2) = 200г m(CaCl2) = w(CaCl2)*m(раствора) / 100% =
w(CaCl2) = 10% = 10*200 / 100 = 20 (г)
m(раствора)(Na2CO3) - ? М(CaCl2) = 110 (г/моль)
M(Na2CO3) = 106 (г/моль)
Xг 20г
Na2Co3 + CaCl2 → CaCO3 + 2NaCl
1 моль 1 моль
106 г/моль 110 г/моль
x / 106 = 20 / 110; x = 106*20 / 110 = 19,3 (г)
w(Na2CO3) = m(Na2CO3) / m(раствора) * 100%
m(раствора) = m(Na2CO3)*100% / w(Na2CO3) = 19,3*100 / 15 = 128,5 (г)
Ответ: m(Na2CO3) = 128,5г
Задача №4
Смешали 300г 15% NaOH и 200г 20% раствора серной кислоты. Вычислите массу образовавшейся соли.
Дано: Решение:
m(раствора)(NaOH) = 300г w(NaOH)=m(NaOH) / m(раствора)(NaOH)*100%
w(NaOH) = 15% m(NaOH)=w(NaOH)*m(раствора)(NaOH) / 100%=
m(раствора)(H2SO4)=200г = 15*300 / 100 = 45 (г)
w(H2SO4) = 20% m(H2SO4)=w(H2SO4)*m(раствора)(H2SO4) /100% =
m(соли) - ? = 20*200 /100 = 40 (г)
45г 40г Xг
2NaOH + H2SO4 → Na2SO4 + 2H2O
2 моль 1 моль
2*40 г/моль 98 г/моль
М(H2SO4) = 98 г/моль
М(NaOH) = 40 г/моль
45 / 2*40 = X / 98; X = 45*98 / 2*40 = 55,125г
Для реакции с 45г NaOH требуется 55,125г H2SO4 , по условию дано только 40г H2SO4, следовательно, NaOH – в избытке. Все расчеты ведутся по массе вещества, находящегося в недостатке (H2SO4).
Определим массу соли (Na2SO3), используя массу H2SO4 , находящейся в недостатке:
М(Na2SO4) = 142 г/моль
40г Xг
2NaOH + H2SO4 → Na2SO4 + 2H2O
1 моль 1моль
98 г/моль 142 г/моль
40 / 98 = X / 142; X = 40*142 / 98 = 57,96 (г)
Ответ: m(соли) = 57,96 (г)
Задача №5
Какая масса воды образуется при взаимодействии 150г 12% раствора фосфорной кислоты с избытком раствора гидроксида натрия?
(Ответ: 9,9г)
Задача№6
Какой объем (н.у.) газа выделится при взаимодействии цинка с 20г 12% раствора соляной кислоты?
(Ответ: 0,75л)
Задача№7
Какая масса 3% раствора уксусной кислоты требуется для реакции с 10г 15% раствора карбоната натрия?
(Ответ: 56,6г)
Задача №8
Какая масса 10% раствора нитрата серебра требуется для реакции с 25г 4% раствора соляной кислоты?
(Ответ: 47,2г)
Задача №9
Смешали 300мл 2М раствора уксусной кислоты и 120г 15% раствора гидроксида калия. Вычислите массу образовавшейся соли.
(Ответ: 31,5г)
Задача №10
Смешали 20г 15% раствора сульфата меди и 30г 10% раствора гидроксида калия. Вычислите массу образовавшегося осадка.
(Ответ: 1,8г)
2.6. Вычисления, связанные с понятием «растворимость вещества»
Коэффициент растворимости (растворимость) – масса растворенного вещества, приходящаяся на 100г воды в насыщенном при данной температуре растворе.
Задача №1
Массовая доля хлорида меди(II) в насыщенном растворе равна 42,7%. Определите коэффициент растворимости этой соли.
Дано: Решение:
w(CuCl2) = 42,7% Пусть m(раствора) = 100г, тогда
k - ? m(CuCl2) = 42,7г и m(воды) = 100 – 42,7 = 57,3 (г)
57,3г H2O – 42,7г CuCl2
100г H2O – Xг CuCl2
57,3 / 100 = 42,7 / X ; X = 42,7*100 / 57,3 = 74,5г
Ответ: k = 74,5г
Задача №2
Коэффициент растворимости соли при температуре 800С равен 50г, а при 200С – 20г. Определите массу осадка, полученного из 700г насыщенного при 800С раствора при его охлаждении до 200С.
Дано: Решение:
k1 = 50г на 100г воды Определим массы соли и воды
k2 = 20г на 100г воды в 700г раствора при 800С:
m(раствора) = 700г 100г H2O – 50г соли – 150г раствора
m(соли) - ? xг H2O – yг соли – 700г раствора
100 / x = 150 / 700; x = 100*700 / 150 = 466,7 (г) воды
50 / y = 150 / 700; y = 50*700 / 150 = 233,3 (г) соли
При охлаждении раствора от 800С до 200С выпал осадок соли, при этом массы раствора и соли в растворе уменьшаются, но масса воды остается неизменной. Определим массу соли в растворе при 200С, зная ее коэффициент растворимости при этой температуре (k2 = 20г на 100г воды):
В 100г H2O – 20г соли
В 466,7 H2O – xг соли
100 / 466,7 = 20 / x ; x = 466,7*20 / 100 = 93,3 (г) соли
При температуре 800С в 466,7г воды может раствориться 233,3г соли, а при температуре 200С – только 93,3г соли. При охлаждении избыток соли выпадает в осадок.
Находим массу осадка:
m(соли) = 233,3 – 93,3 = 140 (г)
Ответ: m(соли) = 140г
Задача №3
Растворимость сероводорода при температуре 00С равна 4,62мл на 1мл воды. Найдите массовую долю и молярную концентрацию вещества. (p (раствора) = 1 г/моль)
Дано: Решение:
k(H2S) = 4,62мл/1мл H2O Согласно закону Авогадро
t = 00C 1 моль H2S (34г) занимает при (н.у.) объем 22,4л
р(раствора) = 1 г/моль 34г H2S – 22400мл
См(H2S) - ? w(H2S) - ? xг – 4,62мл
34 / x = 22400 / 4,62 ; x = 34*4,62 / 22400 = 0,007г
то есть 1мл или 1г воды растворяет (н.у.) 0,007г H2S.
Масса раствора равна сумме масс растворителя и растворенного вещества:
m(раствора) = 1 + 0,007 = 1,007 (г)
w(H2S) = m(H2S) / m(раствора) * 100% = 0,007*100 / 1,007 = 0,69 (%)
Так как плотность раствора равна 1 г/моль, то можно сказать, что 1,007мл раствора содержит 0,007г H2S.
Cм раствора рассчитываем:
См(H2S) = m(H2S) / M(H2S)*V(раствора) = 0,007 / 34*0,001007 = 0,2 (моль/л)
Ответ: См(H2S) = 0,2M ; w(H2S) = 0,69%
Задача №4
При температуре 200С в 50г воды растворяется 18,1г сульфата магния. Вычислите коэффициент растворимости соли.
(Ответ: 36,2)
Задача №5
Растворимость в воде хлорида бария при температуре 600С равна 46,5г на 100г воды. Какая масса BaCl2*2H2O может быть растворена в 400г воды?
(Ответ: 185,6г)
Задача №6
Коэффициент растворимости K2Cr2O7 при температуре 200С равен 11,1г. Какая масса соли выпадет в осадок при охлаждении до 200С 1кг раствора K2Cr2O7 (w K2Cr2O7 = 40%)?
(Ответ: 333,3г)
Задача №7
Коэффициент растворимости соли при температуре 500С равен 40г, а при температуре 100С – 15г. Определите массу осадка, полученного из 70г насыщенного при 500С раствора при его охлаждении до 100С.
(Ответ: 12,5г)
Задача №8
При нормальных условиях растворимость сероводорода в спирте составляет 10мл H2S в 1мл спирта (р = 0,8 г/мл). Вычислите массовую долю сероводорода а растворе.
(Ответ: 1,84%)
Тема 3. «Генетическая связь между классами соединений»
3.1. Генетическая связь между классами неорганических соединений
Составление цепочек химических превращений веществ (как органических, так и неорганических) требует знаний химических свойств основных классов неорганических и органических соединений, а также специфических свойств отдельных химических соединений и их способов получения.
1. Осуществите следующие превращения:
Na→ NaOH→ NaHCO3 → NaCO3→ NaSO4 → NaCl → Na
Решение:
1. Натрий взаимодействует с образованием гидроксида натрия:
2Na + 2H2O→ 2NaOH + H2
2. При пропускании избытка оксида углерода (IV) через раствор гидроксида натрия можно получить гидрокарбонат натрия:
NaOH + CO2 → NaHCO3
3. Карбонат натрия получается при нагревании гидрокарбоната натрия:
2NaHCO3 → NaCO3 + CO2 + H2O
4. Сульфат натрия можно получить действуя сильной серной кислотой на соль слабой угольной кислоты (сильная кислота вытесняет слабую из ее солей):
Na2CO3 + H2SO4 → Na2SO3 + CO2 + H2O
5. Приливая раствор хлорида бария к раствору сульфата натрия, получим в растворе хлорид натрия:
Na2SO4 + BaCl2 →2NaCl + BaSO4
6. Более активный металл калий вытесняет натрий из его солей:
K + NaCl →Na + KCl (в расплаве)
Возможно также получить металлический натрий электролизом расплава NaCl:
2NaCl Электролиз 2Na + Cl2
2. Осуществите следующие превращения
Zn → K2[Zn(OH)4] → ZnCl2 → Zn(OH)2 ZnO Na2ZnO2
1. Цинк – металл, проявляющий амфотерные свойства, растворяется в щелочи с образованием гидроксосолей и водорода:
Zn + 2KOH + 2H2O K2[Zn(OH)4] + 2H2
2. Соли, образованные амфотерными металлами в форме аниона, разлагаются сильными кислотами:
K2[Zn(OH)4] + 4HCl 2KCl + ZnCl2 + 4H2O
3. Осадок Zn(OH)2 выдает при действии недостатка щелочи на его соли:
ZnCl2 + 2NaOH Zn(OH)2 + 2NaCl
4. Основания при нагревании разлагаются:
Zn(OH)2 t ZnO + H2O
5. Оксосоли амфотерных металлов при сплавлении их оксидов или оснований с оксидами или основаниями щелочных и щелочноземельных металлов:
ZnO + Na2O t Na2ZnO2 или
ZnO + 2NaOH t Na2ZnO2 + H2O
3. Осуществите следующие превращения
Cr HCl A NaOH(изб) B BrNaOH C
1. Хром – металл, стоящий в ряду напряжений до водорода, растворятся в кислотах с образованием соли и воды:
2Cr + 6HCl 2CrCl3 + 3H2 (A = CrCl)
2. Действие избытка NaOH на соли хрома в водном растворе приводит к образованию гидроксосоли:
CrCl3 + 6NaOH Na3[Cr(OH)6] + 3NaCl (B = Na3[Cr(OH)6]
3. При действии окислителей (Br2) степень окисления хрома (+3) переходит в степень окисления (+6). В щелочной среде образуются хроматы (окислительно–восстановительная реакция):
Na3[Cr(OH)6] + Br2 + NaOH Na2CrO4 + NaBr + H2O
(окислитель) Br20 + 2e- 2Br -1 (восстановление) / 3
(восстановитель) Cr+3 – 3e - Cr+6 (окисление) / 2
2Na3[Cr(OH)6] + 3Br2 + 4NaOH 2Na2CrO4 + 6NaBr + 8H2O (C = Na2CrO4)
4. Осуществите следующие превращения
Pb(NO3)2 PbO Pb(NO3)2 PbSO4
1. Pb(NO3)2 + H2SO4 PbSO4 + 2HNO3
2. 2Pb(NO3)2 t 2Pb + 4NO2 + O2
3. PbO + 2HCl PbCl + H2O
4. PbCl2 + 2NaOH 2NaCl + Pb(OH)2
5. PbO + 2HNO3 Pb(NO3)2 + H2O
Осуществите следующие превращения
CaO Ca(OH)2 CaCl2 Ca(OH)
CaCO3 Ca(HCO3)2
1. CaO + H2O Ca(OH)2
2. Ca(OH)2 + 2HCl CaCl2 + 2H2O
3. CaCl2 + 2NaOH Ca(OH)2 + 2NaCl
4. Ca(OH)2 + CO2 CaCO3 + H2O
5. CaCO3 + H2O + CO2 Ca(HCO3)2
6. Осуществите следующие превращения
CuO CuSO4 Cu(OH)2 CuO Cu
1. CuCl2 Cu(OH)2 CuSO4 Cu CuO
2. Fe FeSO4 Fe(OH)2 FeCl2
3. FeCl3 Fe(OH)2 Fe2O3 Fe
4. Fe(NO3)3 Fe2O3 FeCl3 Fe(OH)3 FeO3 Fe
5. MgCO3 MgO MgCl2 Mg(OH)2 Mg(NO3)2 MgCO3
6. Mg MgO Mg(OH)2 MgSO4 Mg(OH)2 MgO
3.2. Генетическая связь между классами органических соединений
1. Осуществите следующие превращения органических соединений:
СH4 C2H2 C2H4Br2 C2H4 C2H5Br CuH10
1. При высоких температурах крекинг метана идет с образованием ацетилена:
2CH4 1500 C C2H2 + 3H2
2. Непредельные соединения (ацетилен) вступают в реакции присоединения с галогенводородами (по тройной связи присоединяются две молекулы HBr);
C2H2 + 2HBr C2H4Br2
3. В спиртовых растворах щелочей идет отщепление галоинид-иона с образованием непредельных соединений;
C2H4Br2 + 2KOH C2H5OH C2H2 + 2KBr + 2H2O
4. Приготовление ацетилена проходит при повышенной температуре на никелевом катализаторе:
C2H2 + H2 Ni, t C2H4
5. присоединение галогеноводородов к непредельным соединениям:
C2H4 + HBr C2H5Br
6. Взаимодействие галогенпроизводных углеводородов с металлическим натрием приводит отщеплению галогенит-иона и удлинению углеродной цепи:
2C2H5Br + 2Na 2NaBr + C4H10
2. Осуществите следующие превращения
метан 1500 С A H2O, Hg B Ag2O, NH3 C Cl, свет D KOH, NH3 E HCl F
1. При нагревании метана получают ацетилен:
2CH4 1500 C C2H2 + 3H2 (A = C2H4)
2. Гитратацией ацетилена в присутствии солей ртути (II) получают искусный альдегид:
С2H2 + H2O HgSO4 CH3COH (B = CH3COH)
H2SO4
3. Уксусный альдегид окисляется аммиачным раствором оксида серебра до уксусной кислоты:
CH3CHO + Ag2O аммиачный раствор СH3COOH + 2Ag (C = CH3COOH)
4. Хлорирование уксусной кислоты на свету приводит к замещению монохлоруксусной кислоты:
CH3COOH + Cl2 свет ClCH2COOH + HCl (D = ClCH2COOH)
5. В присутствии аммиака в щелочной среде идет замещение атомов хлора на аминогруппу с образованием калиевой соли аминоуксусной кислоты (глицина):
СlCH2COOH + NH3 + 2KOH CH2 – COOK + KCl + H2O
NH2 (E=NH2-CH2COOK)
6. Глицерин проявляет амфотерные свойства. Он реагирует с соляной кислотой с образованием соли:
СH2 – COOK + 2HCl CH2 – COOH + KCl (F = CH2 – COOH)
NH2 NH3+ Cl- NH3+ Cl-
3. Осуществите следующие превращения
CH3COOK CH3COOH этилацетат ацетат натрия NaOH A этин
1. CH3COOK + H2SO4 t CH3COOH + KHSO4
2. CH3COOH + C2H5OH t, H2SO4 CH3COOC2H5 + H2O
3. CHCOOC2H5 + NaOH t CH3COONa + C2H5OH
4. CH3COONa + NaOH сплавление Na2CO3 + CH4
5. 2CH4 t C2H2 + 3H2
4. Осуществите следующие превращения
этин этанол KMnO4H X1 Cl, P X2 NH3 X3
1. C2H2 + H2O HgSO4, H2SO4 CH3COOH
2. 5CH3COOH + 2KMnO4 + 3H2SO4 5CH3COOH + K2SO4 + 2MnSO4 + 3H2O
(допустимы и другие окислители, например, K2Cr2O7, кроме аммиачного раствора Ag2O) (X1 = CH3COOH)
3. CH3COOH + Cl2 ClCH2COOH + HCl (X2 = ClCH2COOH)
4. ClCH2COOH + 2NH3 NH2CH2COOH + NH4Cl (X3 = NH2CH2COOH)
5. Осуществите следующие превращения
C2H4Br2 C2H2 CH3COH KMnO4, H CH3COOH X NH2CH2COOH
1. C2H4Br + 2KOH C2H5OH C2H2 + 2KBr + 2H2O
2. C2H2 + H2O Hg CH3COH
3. 5CH3COH + 2KMnO4 + 3H2SO4 5CH3COOH + K2SO4 + 2MnSO4 + 3H2O
4. CH3COOH + Cl2 свет ClH2COOH + HCl (X = ClH2COOH)
5. ClH2COOH + 2NH3 NH2CH2COOH + NHCl
6. Осуществите следующие превращения
C2H2 CH3COH KMnO4, H CH3COOH CH3COONa CH4 CO2
7. C2H4 C2H5Cl C2H5OH C2H5Cl C4H10 CH3COOH
8. этанол этан Cl2 A этиленгликоль динитрат этиленгликоля
9. пропанол-1 H2SO4(K) CH3 – CH=CH2 Br2 X1 KON, C2H5OH X2 H2Hg X3 H2, KON X4
10. бензол нитробензол анилин хлорид фени-аммония
11. C2H2 C, 600 C A H2, Hg B Ag2O, NH3 C CH3OH, H2SO4 D
Тема № 4. «Вывод химических формул»
Формулы веществ показывают, какие элементы и в каком количестве входят в состав вещества. При выводе формул исходят из положения атомно-молекулярного учения о неделимости атомов в химических реакциях. В состав молекулы может входить только целое число атомов каждого элемента.
Индексы, определяющие количество атомов элементов в молекуле, это небольшие целые числа.
Отношение индексов элементов в молекуле пропорционально отношению количества вещества каждого элемента. Простейшее соотношение индексов элементов в молекуле определяет простейшую формулу вещества.
Истинная (молекулярная) формула определяет число атомов каждого элемента, приходящееся на одну молекулу вещества.
М = x * M(прост)
М – молярная масса вещества;
М(прост) – молярная масса простейшей формулы;
X – число повторений простейший формулы вещества в молекуле.
Истинная молярная масса вещества определяются по закону Авогадро или с использованием относительных плотностей газов.
Для вывода простейшей формулы вещества достаточно знать его состав и относительные атомные массы образующих данное вещество элементов. Для нахождения молекулярной формулы надо знать еще и относительную молекулярную массу этого соединения.
Активизации познавательной деятельности учащихся при решении расчетных задач на нахождение молекулярной формулы способствует выбор рациональных приемов решения задач.
Учитывая, что решение задач на установление молекулярной формулы органического вещества, как правило, представляет трудности для учащихся, важно выделить этапы деятельности учащихся.
Первый этап. Анализ задачи. Внимательно прочитав условия задачи, установить ее части и вычленить все отношения, которыми они связаны, установить, что требуется в задаче.
Второй этап. План решения задачи.
Третий этап. Осуществление найденного плана. Необходимо убедиться, что получаемый результат правильный. Поэтому при решении задачи предусматривается ее проверка.
Четвертый этап. Анализ решения. Оно особо важно при обучении решению задачи, так как анализ позволяет выявить недостатки решения, найти рациональный способ решения, установить и закрепить в памяти приемы использованные при решении. Результат решения задач, требующих творческого, комплексного применения ранее полученных знаний, следует обсудить, сравнивая при этом различные способы решения, показать их правомерность и выделить наиболее оригинальные из них.
Трудности, возникающие в ходе решения, обусловлены неумением устанавливать связи между данными условия задачи. Для преодоления этих трудностей используются всевозможные схемы и чертежи.
Решение задач на нахождение молекулярной формулы связано с применением учащимися знаний о некоторых физических величинах: массе (m), объеме (V), количестве вещества (n), относительно молекулярной массе (Mr), молярной массе (M), плотности (р), относительной плотности по водороду (DH2), относительной плотности по воздуху (D возд), массовой доле химического элемента (w).
Задачи на вывод химических формул.
4.1. Нахождение простейшей химической формулы вещества по массовым долям элементов.
Задача №1
Вывести простейшую формулу соединения, содержащего (масс. доли, %) натрия – 42,1, фосфора – 18,9, кислорода – 39,0.
Дано: Решение:
Ar(NaO) = 2 Обозначим числа атомов натрия, фосфора,
Ar(P) = 18,9 кислорода в простейшей формуле соответственно
Ar(O) = 39,0 через x, y, z.
w(Na) = 42,1% Тогда формула будет иметь вид: NaxPyOz
w(P) = 18,9% На основе закона постоянства состава можно записать
w(O) = 39,0% 23x : 31y : 16z = 42,1 : 18,9 : 39,0
найти простейшую отсюда x : y : z = 42,1 / 23 : 18,9 / 31 : 39,0 / 16, или
формулу вещества x : y : z = 1,83 : 0,61 : 2,24
Полученные числа 1,83 : 0,61 : 2,24 выражают количественное отношение между атомами элементов. Но отношение между атомами могут быть целочисленными. Поэтому наименьшие из полученных чисел (0,61) принимаем за единицу и делим на него все остальные:
x : y : z = 1,83 / 0,61 : 0,61 / 0,61 : 2,44 / 0,16
x : y : z = 3 : 1 : 4
простейшая формула вещества Na3PO4
Ответ: Na3PO4
Задача №2
Соединение содержит водород (массовая доля – 6,33%), углерод (массовая доля – 15,19%), кислород (массовая доля – 60,76%) и еще один элемент, число атомов которого в молекуле равно числу атомов углерода. Определите, что это за соединение и к какому классу оно относится.
Дано: Решение:
w(H) = 6,33% 1. Обозначим неизвестный элемент буквой X,
w(C) = 15,19% а формулу вещества запишем HaCbOcXd
w(O) = 60,76% Массовая доля неизвестного элемента будет равна
вывести формулу w(X) = 100 – (6,33 + 15,19 + 60,76)% = 17,72%
вещества 2. Находим отношение числа атомов элементов:
а : b : c = 6,33 / 1 : 15,19 / 12 : 60,76 / 16 = 6,33 : 1,27 : 3,8
Меньшее число (1,27) принимаем за единицу и находим следующее отношение: а : b : c
3. Находим неизвестный элемент. По условию задачи число атомов элемента X равно числу атомов углерода, значит:
17,72 / Ar(X) = 15,19 / 12 , откуда Ar(X) = 14
Неизвестный элемент – азот.
Простейшая формула вещества запишется следующим образом:
NH5CO3, или NH4HCO3 – гидрокарбонат аммония (кислая соль).
Ответ: простейшая формула вещества NH4HCO3
(гидрокарбонат аммония, кислая соль)
Задача №3
Вещество содержит 75% углерода и 25% водорода. Определите простейшую формулу вещества.
Дано: Решение:
w(C) = 75% n(C) = w(C) / M(C) = 75 / 12 = 6,25 (моль);
w(H) = 25% n(H) = w(H) / M(H) = 25 / 1 = 25 (моль);
Простейшая Для получения целочисленных индексов разделим
формула - ? на наименьшее число – 6,25:
n(C) : n(H) = 6,25 / 6,25 : 25 / 6,25 = 1 : 4
Следовательно, атом углерода имеет индекс 1, а атом водорода – 4. Простейшая формула – CH4
Ответ: CH4
Задача№4
В состав химического соединения входят 34,6% натрия, 23,3% фосфора и 42,1% кислорода. Определите простейшую формулу вещества.
Дано: Решение:
w(Na) = 34,6% n(Na) = w(Na) / M(Na) = 36,4 / 23 = 1,5 (моль);
w(P) = 23,3% n(P) = w(P) / M(P) = 23,3 / 31 = 0,75 (моль);
w(O) = 42,1% n(O) = w(O) / M(O) = 42,1 / 16 = 7,63 (моль);
Простейшая Отношение количеств веществ:
формула - ? n(Na) : n(P) : n(O) = 1,5 : 0,75 : 2,63
Разделим на наименьшее – 0,75:
n(Na) : n(P) : n(O) = 2 : 1 : 3,5
Так как коэффициенты в формулах обычно целочисленные, умножим на 2 (возьмем удвоенные числа в отношении индексов):
n(Na) : n(P) : n(O) = 4:2:7
Следовательно, простейшая формула – Na4P2O7.
Ответ: Na4P2O7
Задача №5
Вещество содержит 17,56% натрия, 39,69% хрома и 42,75% кислорода. Определите простейшую формулу вещества.
Дано: Решение:
w(Na) = 17,56% n(Na) = w(Na) / M(Na) = 17,56 / 23 = 0,76 (моль);
w(Cr) = 39,69% n(Cr) = w(Cr) / M(Cr) = 39,69 / 52 = 0,76 (моль);
w(O) = 42,75% n(O) = w(O) / M(O) = 42,75 / 16 = 2,67 (моль);
простейшая Отношение количеств веществ:
формула - ? n(Na) : n(Cr) : n(O) = 0,76 : 0,76 : 2,67
Разделим на наименьшее – 0,76:
n(Na) : n(Cr) : n(O) = 1 :1 : 3,5
Так как коэффициенты в формулах обычно целочисленные, умножим на 2 (возьмем удвоенные числа в отношении индексов):
n(Na) : n(Cr) : n(O) = 2 : 2 : 7
Следовательно, простейшая формула – Na2Cr2O7
Ответ: Na2Cr2O7
Задача №6
Вещество содержит 53,8% Al и 46,2% О. Определите простейшую формулу вещества. (Ответ: Al2O3)
Задача №7
Вещество содержит 1% H, 35% Cl и 64% О. Определите простейшую формулу вещества. (Ответ: HClO4)
Задача №8
Вещество содержит 43,4% Na, 11,3% C и 45,3% О. Определите простейшую формулу вещества. (Ответ: Na2CO3)
Задача №9
Вещество содержит 36,8% Fe, 21,1% S и 42,1% O. Определите простейшую формулу вещества. (Ответ: FeSO4)
Задача №10
Вещество содержит 5,88% водорода и 94,12% серы. Определите простейшую формулу вещества. (Ответ: H2S)
4.2. Нахождение молекулярной формулы газообразного вещества по массовым долям элементов и относительной плотности его по другому газу
Задача №1
Вывести молекулярную формулу углеводорода по данным: массовая доля углерода – 65,7%, относительная плотность по воздуху Dвозд = 1,45.
Дано: Решение:
w(C) = 65,7% 1. Найдем массовую долю водорода в данном
Dвозд = 1,45 веществе CxHy;
Ar(C) = 12 w(H) = 100% - 85,7% = 14,3% (0,143)
Ar(H) = 1 2. Определим относительную молекулярную
Вывести молекулярную массу углеводорода, зная его относительную
формулу. плотность по воздуху;
Mr(CxHy) = 29 * Dвозд = 29 * 1,45 = 42
3. Рассчитаем число атомов (x) в молекуле. Для этого запишем выражение для нахождения массовой доли углерода в веществе:
w(C) = x*Ar(C) / Mr(CxHy) , отсюда получаем выражение для x:
x = w(C) * Mr(CxHy) / Ar(C); x = 0,857 * 42 / 12 = 3 (атома C).
4. Аналогично находим число атомов водорода (y):
y = w(H) * Mr(CxHy) / Ar(H); y = 0,143 * 42 / 1 = 6 (атомов H).
Ответ: молекулярная формула вещества C3H5
Задача №2
Вещество содержит 85,71% С и 14,29% Н. Относительная плотность паров вещества по водороду равна 14. Определите молекулярную формулу вещества.
Дано: Решение:
w(C) = 85,71% 1. Найдем простейшую формулу вещества.
w(H) = 14,29% n(C) = w(C) / M(C) = 85,71 / 12 = 6,25 (моль);
DH2 = 14 n(H) = w(H) / M(H) = 14,29 / 1 = 14,29 (моль);
Молекулярная n(C) : n(H) = 7,14 : 14,29 = 1 : 2
формула - ? Простейшая формула – CH2.
DH2 = M / M(H2); M = DH2 - M(H2) = 14*2 = 28 (г/моль)
2. найдем молярную массу простейшей формулы:
M(прост) = М(CH2) = M(C) + 2M(H) = 12 + 2*1 = 12 + 2 = 14 (г/моль)
3. Найдем число повторений простейшей формулы вещества в молекуле:
М = x * M(прост) = x * M(CH2)
28 = x * 14, x = 2
Истинная формула – (СH2)2 или С2H4
Ответ: С2H4
Задача №3
Вещество содержит 30,4% N и 69,6% О. Плотность паров этого вещества по азоту равна 3,285. Определите молекулярную формулу вещества.
Дано: Решение:
w(N) = 30,4% 1. Найдем простейшую формулу вещества:
w(O) = 69,6% n(N) = w(N) / M(N) = 30,4 / 14 = 2,17 (моль);
DN2 = 3,285 n(O) = w(O) / M(O) = 69,6 / 16 = 4,35 (моль);
Молекулярная n(N) : n(O) = 2,17 : 4,35 = 1 : 2
формула - ? Простейшая формула NO2
DN2 = M / M (N2); M = DN2 * M(N2) = 3,285 * 28 = 91,98 (г/моль)
2. Найдем молярную массу простейшей формулы:
М(прост) = M(NO2) = M(N) + 2M(O) = 14 + 2*16 = 46 (г/моль)
3. Найдем число повторений простейшей формулы вещества в молекуле.
М = x * M(прост) = x * M(NO2)
91,98 = x * 46; x = 2
Истинная формула – (NO2)2 или N2O4
Ответ: N2O4
4.3. Установление молекулярной формулы газообразного вещества по продуктам сгорания
Задача №1
При сгорании вещества массой 2,3г образовался оксид углерода (IV) массой 4,4г вода массой 2,7г. Относительная плотность паров этого вещества по воздуху Dв = 1,59. Из каких элементов состоит это соединение? Какова его молекулярная формула?
Дано: Решение:
m(вещества) = 2,3г Необходимо учесть состав продуктов сгорания -
m(CO2) = 4,4г оксида углерода (IV) и воды. В них углерод и m(H2O) = 2,7г водород могли перейти только из сгоревшего
Dв = 1,59 соединения. Кислород же мог войти как из этого
Молекулярная соединения, так и из воздуха. Первоначально формула - ? необходимо определить массы углерода в оксиде
Углерода (IV) и водорода в воде.
1. Определяют массу углерода. М(CO2) = 44 г/моль. M(CO2) = 44г.
В оксиде углерода (IV) массой 44г углерода 12г. При сгорании образовался CO2 массой 4,4г, что соответствует 0,1 моль. Следовательно, масса углерода 1,2г.
2. Аналогично вычисляют массу водорода. Масса воды равна 18г, а водорода 2г. В 2,7г воды находится:
2г * 2,7г / 18г = 0,3 (H).
3. Сумма масс углерода и водорода составляет (1,2 + 0,3) = 1,5г. Следовательно, если соединение сгорело 2,3г, то разность 2,3г – 1,5г = 0,8г показывает массу кислорода.
4. Формула соединения: CxHyOz.
Отношение числа атомов элементов:
x : y : z = 1,2 / 12 : 0,3 / 1 : 0,8 / 16 или x : y : z = 0,1 : 0,3 : 0,05
Приняв наименьшее число за единицу, находят что:
x : y : z = 0,1 / 0,05 : 0,3 / 0,05 : 0,05 / 0,05 = 2 : 6 : 1
Таким образом, простейшая формула соединения должна иметь вид C2H6O с относительной молекулярной массой, равной 46. Истинную относительную молекулярную массу определяют, зная, что относительная плотность соединения по воздуху Dв = 1,59, тогда Mr = 1,59 * 29 = 46,1.
5.Сравнение относительных молекулярных масс показывает, что простейшая молекулярная формулы здесь совпадают. Отсюда следует, что C2H6O представляет собой и молекулярную формулу вещества.
Ответ: C2H6O
Задача №2
При сжигании 112мл газа было получено 448мл углекислого газа и 0,45 воды. Относительная плотность газа по водороду составляет 29(н.у.). Найти молекулярную массу газа.
Дано: Решение:
V(газа) = 112мл = 0,112л 1. Определим относительную
V(CO2) = 448мл = 0,448л молекулярную массу газа:
m(H2O) = 0,45г Mr(газа) = 2DH2 * Mr(газа) = 2*29 = 58
DH2 (газа) = 29 2. Найдем массу 112мл (0,112л) газа:
Mr(H2O) = 18 58г газа при н.у. занимают объем 0,112л;
Vm = 22,4 л/моль xг газа при н.у. занимают объем 0,112л;
Найти молекулярную Составляем пропорцию:
формулу газа. 58г : xг = 22,4л : 0,112л;
x = 58г*0,112л / 22,4л = 0,29г (газа),
или используя формулу m = v*M = V / Vm * M, находим
m = 0,112л / 22,4 л/моль * 58 г/моль = 0,29г.
3. Вычитаем массы углерода и водорода, содержащихся в веществе:
xг 0,448л
C CO2 ;
12г 22,4л
22,4л CO2 содержат 12г углерода С;
0,448л CO2 содержат xг углерода С;
22,4л : 0,448л = 12г : xг;
x = 0,448*12г / 22,4л = 0,24г (С)
yг 0,45г
2Н Н2О
2г 18г
в 18г Н2О содержится 2г водорода (Н);
в 0,45г Н2О содержится yг водорода;
y = 0,45г*2г / 18г = 0,05г (Н).
4. Определим, входит ли в состав данного газа элемент кислород. Сумма масс углерода и водорода в сожженном газе составляет:
m(C) + m(H) = 0,24г + 0,05г = 0,29г
Значит, газ состоит только из углерода и водорода, CxHy.
5.Находим отношение числа атомов элементов в сгоревшем веществе:
x : y = m(C) / Ar(C) : m(H) / Ar(H) = 0,24 / 12 : 0,05 / 1
x : y = 0,02 : 0,05 = 2 : 5
Простейшая формула вещества C2H5 (Mr = 29).
6. Находим, во сколько раз истинная молекулярная масса вещества больше вычисленной по его простейшей формуле:
Mr(CxHy) / Mr(C2H5) = 58 / 29 = 2
Значит, число атомов в простейшей формуле увеличиваем в 2 раза:
(C2H5)2 = C4H10 – бутан.
Ответ: C4H10
Задача №3
При сгорании 1,45г органического вещества образовалось 2,2г оксида углерода (IV) и 0,9г воды. Плотность паров этого вещества по водороду равна 45. Определите молекулярную формулу вещества.
Дано: Решение:
m(в-ва) = 1,45г Составляем схему и определяем массу углерода
m(CO2) = 2,2г содержащегося в веществе:
mг 2,2г
m(H2O) = 0,9г С СО2
12г 44г
DH2 = 45 В 44г СО2 содержится 12г С;
Mr(CO2) = 44 В 2,2г СО2 содержится mг С;
Mr(H2O) = 18 m(C) = 2,2г*12г / 44г = 0,6г
Mr(H2) = 2 2. Образование воды в продуктах сгорания вещества
Найти молярную свидетельствует о наличии в нем атомов водорода:
mг 0,9г
формулу. 2Н Н2О m(H) = 2г*0,9г / 18г = 0,1г
2г 18г
3. Определим, входит ли в состав вещества кислород:
m(O) = m(в-ва) – [m(C) + m(H)],
m(O) = 1,45г – (0,6г + 0,1г) = 0,75г
4. Представим формулу вещества как CxHyOz
x : y : z = m(C) / Ar(C) : m(H) / Ar(H) : m(O) / Ar(O),
x : y : z = 0,6 / 12 : 0,1 / 1 : 0,75 / 16 = 0,05 : 0,1 : 0,05
x : y : z = 1 : 2 : 1
Простейшая формула вещества CH2O
5. Находим относительные молекулярные массы простейшей формулы и искомого вещества и сопоставляем их:
Mr(CH2O) = 30; Mr(CxHyOz) = 2 * DH2 = 2 * 45 = 90
Mr(CxHyOz) / Mr(CH2O) = 90 / 30 = 3
Значит, число атомов каждого элемента в простейшей формуле нужно увеличить в 3 раза:
(СH2O)3 = C3H6O3 – истинная формула.
Ответ: C3H6O3
Задача №4
При сгорании 1,96г вещества образовалось 1,743г СО2 и 0,712г Н2О. При обработке 0,06г этого вещества азотной кислотой и нитратом серебра образовалось 0,173г AgCl. Молярная масса вещества равна 99 г/моль. Определите его молекулярную формулу.
(Ответ: C2H4Cl2)
Задача №5
При полном сгорании 1,5г вещества получено 4,4г оксида углерода (IV) и 2,7г воды. Масса 1л (н.у) этого вещества в газообразном состоянии равна 1,34г. Определите молекулярную формулу вещества.
(Ответ: C2H6)
Тема №5. Окислительно-восстановительные реакции
Окислительно-восстановительными реакциями (ОВР) называют реакции, в ходе которых происходит изменение степеней окисления (с.о.) элементов, образующих реагирующие вещества.
Окислитель – вещество (элемент, в составе этого вещества), принимающее электроны. Само оно при этом восстанавливается.
Восстановитель - вещество (элемент, в составе этого вещества), отдающее электроны.
Следует помнить, что к ОВР относятся все реакции замещения (для неорганических веществ), а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество. Ориентиром для отнесения конкретной реакции к ОВР служит наличие формулы простого вещества в схеме или уравнении химической реакции.
Типичные окислители
|
| Группа окислителей | Химические элементы | Примеры веществ |
| 1 | Электрический ток на аноде |
|
|
| 2 | Галогены в высших положительных степенях окисления | Cl+7, Br+7, I+7 | HClO4, HBrO4, HIO4 |
| 3 | Галогены в промежуточных положительных степенях окисления | Cl+1, Cl+3, Cl+5, Br+5, I+5… | KClO3, HClO, NaBrO3 |
| 4 | Халькогены и другие неметаллы в положительных степенях окисления | S+6, S+4, N+5 | H2SO4, SO2, HNO3 |
| 5 | Неметаллы – простые вещества (нулевая степень окисления). | F, Cl, O, S, Br | F2, Cl2, O3, O2, S, Br2 |
| 6 | Неметаллы в промежуточных отрицательных степенях окисления. | O-1, N-2 | H2O2, BaO2, N2H4 |
| 7 | Металлы в высших положительных степенях окисления. | Mn+7, Cr+6, Sn+4 | KMnO4, K2CrO4, H2Cr2O7, SnCl4 |
| 8 | Металлы в промежуточных положительных степенях окисления. | Fe+2, Cu+1, Sn+2 | FeCl2, Cu2Cl2, SnSO4 |
| 9 | Органические нитросоединения | N+5 | CH(NO2)3, CH2ONO2-CH2ONO2 |
Типичные восстановители
|
| Группа восстановителей. | Химические элементы | Примеры веществ |
| 1 | Электрический ток на катоде |
|
|
| 2 | Металлы – простые вещества (нулевая степень окисления). | Na, Ca, Fe | Na, Ca, Fe |
| 3 | Неметаллы в низшей отрицательной степени окисления. | Cl-1, N-3, S-2 | HCl, NH3, ZnS |
| 4 | Металлы в промежуточной положительной степени окисления. | Fe+2, Cr+2, Cu+1 | FeSO4, CrCl2, Cu2Cl2 |
| 5 | Неметаллы в промежуточной отрицательной степени окисления. | O-1, N-2 | H2O2, N2H4 |
| 6 | Неметаллы – простые вещества | S, P, C, I | S, P4, C, I2 |
| 7 | Неметаллы в промежуточной положительной степени окисления. | P+3, S+4, C+2 | PCl3, SO2, CO |
| 8 | Углеводороды и многие другие органические вещества | С-4, С-2 и др. | CnH2n+2, CnH2n-6, спирты, углеводы |
Различают три основных типа окислительно-восстановительных реакций:
1) Реакции межмолекулярного окисления-восстановления (когда окислитель и восстановитель – разные вещества);
2) Реакции диспропорционирования (когда окислителем и восстановителем может служить одно и то же вещество);
3) Реакции внутримолекулярного окисления-восстановления (когда одна часть молекулы выступает в роли окислителя, а другая – в роли восстановителя).
Рассмотрим примеры реакций трех типов.
1. Реакциями межмолекулярного окисления-восстановления являются все уже рассмотренные нами в этом параграфе реакции.
Рассмотрим несколько более сложный случай, когда не весь окислитель может быть израсходован в реакции, поскольку часть его участвует в обычной – не окислительно-восстановительной реакции обмена:
| 0 |
| +5 |
| +2 |
| +2 |
|
|
| Cu | + | HNO3 | = | Cu(NO3)2 | + | NO | + | H2O |
Часть частиц NO3- участвует в реакции в качестве окислителя, давая оксид азота NO, а часть ионов NO3- в неизменном виде переходит в соединение меди Cu(NO3)2. Составим электронный баланс:
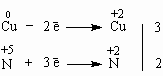
Поставим найденный для меди коэффициент 3 перед Cu и Cu(NO3)2. А вот коэффициент 2 следует поставить только перед NO, потому что весь имеющийся в нем азот участвовал в окислительно-восстановительной реакции. Было бы ошибкой поставить коэффициент 2 перед HNO3, потому что это вещество включает в себя и те атомы азота, которые не участвуют в окислении-восстановлении и входят в состав продукта Cu(NO3)2 (частицы NO3- здесь иногда называют “ионом-наблюдателем”).
Остальные коэффициенты подбираются без труда по уже найденным:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
2. Реакции диспропорционирования происходят тогда, когда молекулы одного и того же вещества способны окислять и восстанавливать друг друга. Это становится возможным, если вещество содержит в своем составе атомы какого-либо элемента в промежуточной степени окисления. Следовательно, степень окисления способна как понижаться, так и повышаться. Например:
| +3 |
| +5 |
| +2 |
|
|
| HNO2 | = | HNO3 | + | NO | + | H2O |
Эту реакцию можно представить как реакцию между HNO2 и HNO2 как окислителем и восстановителем и применить метод электронного баланса:
| +3 |
| +3 |
| +5 |
| +2 |
|
|
| HNO2 | + | HNO2 | = | HNO3 | + | NO | + | H2O |
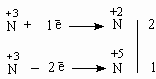
Получаем уравнение:
2HNO2 + 1HNO2 = 1HNO3 + 2NO + H2O
Или, складывая вместе моли HNO2:
3HNO2 = HNO3 + 2NO + H2O
3. Реакции внутримолекулярного окисления-восстановления происходят тогда, когда в молекуле соседствуют атомы-окислители и атомы-восстановители. Рассмотрим разложение бертолетовой соли KClO3 при нагревании:
| +5 |
| –1 |
| 0 |
| KClO3 | = | KCl | + | O2 |
Это уравнение также подчиняется требованию электронного баланса:
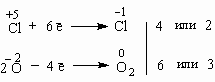
Здесь возникает сложность – какой из двух найденных коэффициентов поставить перед KClO3 – ведь эта молекула содержит и окислитель и восстановитель? В таких случаях найденные коэффициенты ставятся перед продуктами:
KClO3 = 2KCl + 3O2
Теперь ясно, что перед KClO3 надо поставить коэффициент 2.
2KClO3 = 2KCl + 3O2
Внутримолекулярная реакция разложения бертолетовой соли при нагревании используется при получении кислорода в лаборатории.
Мы рассмотрели важнейшие типы окислительно-восстановительных реакций и метод электронного баланса, но пока не касались вопроса составления уравнений таких реакций. Распространенное заблуждение заключается в том, что вы можете сразу предсказать продукт (или продукты) окислительно-восстановительной реакции. Это не так. Лишь по мере накопления опыта, особенно в лаборатории, вы сможете делать все больше и больше правильных предсказаний. А пока следует научиться уравнивать реакции, реагенты и продукты которых заранее известны.
Определение степени окисления в химических соединениях.
Степень окисления – это условный заряд атома в молекуле или кристалле. Его определяют, условно считая все полярные связи полностью ионнымии.
Степень окисления выражают числом частично или полностью смещенных электронов от одного атома к другому в их соединении.
Если атом отдал электроны, его степени окисления приписывается знак “+”, а если атом принял электроны, то знак “-”. Возможна и нулевая степень окисления атома в молекуле, если электроны никуда не смещались или число отданных и принятых электронов одинаково.
Степень окисления - очень важная величина, относящаяся к основным понятиям химии. Фактически, степень окисления описывает состояние атома в соединении.
Есть несколько полезных правил, которые касаются степеней окисления:
1) Степень окисления атома любого элемента в свободном состоянии равна нулю.
Это связано с тем, что в чисто ковалентных двухатомных молекулах электроны не смещены ни к одному из атомов. Если вещество находится в атомном состоянии, то степень окисления его атомов также равна нулю. Примеры молекул, где степени окисления атомов равны нулю: H2, Fe, F2, Na, O2, N2, Ar.
2) Степень окисления любого простого одноатомного иона равна его заряду. Примеры:
H+ (+1),
Fe3+ (+3),
F– (-1),
Na+ (+1).
3) Степень окисления водорода в его соединениях с другими элементами равна +1.
Примеры молекул, где водород имеет степень окисления +1: H2O, NH3, CH4, HF, HCl. Исключение составляют довольно редкие соединения - гидриды металлов (например, LiH), в которых степень окисления водорода равна -1, потому что электроотрицательность металлов меньше, чем у водорода.
4) Степень окисления кислорода равна -2 во всех соединениях, где кислород не образует простой ковалентной связи О—О.
Примеры молекул, где кислород имеет степень окисления –2 (таких соединений кислорода – подавляющее большинство): H2O, SO2, SO3, NO2. Положительную степень окисления кислород проявляет только в соединениях с фтором (например, в соединении OF2, где степень окисления кислорода равна +2).
5) Алгебраическая сумма степеней окисления всех атомов в формуле нейтрального соединения всегда равна нулю.
6) Если в ходе химической реакции степень окисления атома повышается, то говорят, что он ОКИСЛЯЕТСЯ. Если же степень окисления понижается, то говорят, что он ВОССТАНАВЛИВАЕТСЯ.
Составление уравнений химических реакций методом электронного баланса
В этом методе сравнивают степени окисления атомов в исходных и конечных веществах, руководствуясь правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем. Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Последние определяются либо опытным путем, либо на основе известных свойств элементов. Рассмотрим применение этого метода на примерах.
1. Какие из указанных ниже соединений могут проявлять только окислительные свойства?
CrSO4 ; K2CrO4 ; NaCrO2 .
Решение.
Из предложенных соединений только окислительными свойствами обладает K2CrO4 , так как Сr в данном соединении проявляет высшую степень окисления + 6 и, следовательно, может только принимать электроны. В соединениях CrSO4 ; NaCrO2 хром проявляет промежуточные степени окисления +2 и +3 соответственно и может выполнять как функцию окислителя, так и функцию восстановителя.
Ответ: K2CrO4 .
2. Укажите, какие из приведенных процессов являются процессами окисления:
а) SO2 → S2– ;
б) ClO– → Cl– ;
в) CrO2– → CrO42– .
Решение.
Процессом окисления называется отдача атомом электронов, сопровождающаяся повышением его степени окисления. В данном случае таким процессом будет процесс : CrO2– → CrO42–. В этом превращении у хрома степень окисления меняется следующим образом: Сr3+ – 3e- → Cr6+ , а в других случаях:
а) S4+ + 6e- → S2– ; б) Cl+ + 2e- → Cl–
Ответ: в)
3. Укажите, какие из реакций являются окислительно-восстановительными:
а) 2Al + Cr2O3 → Al2O3 + 2Cr ;
б) Al2(SO4)3 + 6 NaOH → 2Al(OH)3 + 3Na2SO4 ;
в) Al(OH)3 + NaOH → Na[Al(OH)4] .
Решение.
Окислительно-восстановительными называются такие реакции, в результате которых изменяется степень окисления одного или нескольких участвующих в реакции элементов.
В случае а) меняется степень окисления у двух элементов Al и Cr, в случаях б) и в) элементы, участвующие в реакциях, не меняют свою степень окисления.
Ответ: а).
4. Уравняйте методом электронного баланса уравнения окислительно-восстановительных реакций и укажите количество молекул окислителя:
Na2MoO4 + HCl + Al → MoCl2 + AlCl3 + NaCl + H2O
Решение.
В данном процессе степень окисления меняют два элемента: Mo и Al:
Mo6+ → Mo2+ ; Al0 → Al3+
Записываем для этих элементов уравнения электронного баланса и подбором коэффициентов уравниваем число отданных и принятых электронов (коэффициенты записываются справа от уравнений за вертикальной чертой):
| Mo6+ + 4e- → Mo2+ | 3 восстановление окислителя (Na2MoO4) |
| Al0 – 3e- → Al3+ | 4 окисление восстановителя (Al) |
Из уравнений электронного баланса переносим коэффициенты в уравнение окислительно-восстановительной реакции:
3Na2MoO4 + HCl + 4Al → 3MoCl2 + 4AlCl3 + NaCl + H2O,
затем выравниваем число остальных атомов, кроме водорода и кислорода:
3Na2MoO4 + 24HCl + 4Al → 3MoCl2 + 4AlCl3 + 6NaCl + H2O,
выравниваем число атомов водорода:
3Na2MoO4 + 24HCl + 4Al → 3MoCl2 + 4AlCl3 + 6NaCl + 12H2O,
проверяем уравнение по кислороду (в левой и правой части уравнения число атомов кислорода должно быть одинаково).
Окислителем в данной реакции является Na2MoO4 .
Ответ: 3.
Решение заданий.
Задание 1. Составление уравнения реакции меди с раствором нитрата палладия (II). Запишем формулы исходных и конечных веществ реакции и покажем изменения степеней окисления:
Медь, образуя ион меди, отдает два электрона, ее степень окисления повышается от 0 до +2. Медь - восстановитель. Ион палладия, присоединяя два электрона, изменяет степень окисления от +2 до 0. Нитрат палладия (II) -окислитель. Эти изменения можно выразить электронными уравнениями
из которых следует, что при восстановителе и окислителе коэффициенты равны 1. Окончательное уравнение реакции:
Cu + Pd(NO3)2 = Cu(NO3)2 + Pd
Как видно, в суммарном уравнении реакции электроны не фигурируют.
Чтобы проверить правильность составленного уравнения, подсчитываем число атомов каждого элемента в его правой и левой частях. Например, в правой части 6 атомов кислорода, в левой также 6 атомов; палладия 1 и 1; меди тоже 1 и 1. Значит, уравнение составлено правильно.
Переписываем это уравнение в ионной форме:
Cu + Pd2+ + 2NO3- = Cu2+ + 2NO3- + Рd
И после сокращения одинаковых ионов получим
Cu + Pd2+ = Cu2+ + Pd
Задание 2. Составление уравнения реакции взаимодействия оксида марганца (IV) с концентрированной соляной кислотой (с помощью этой реакции в лабораторных условиях получают хлор).
Запишем формулы исходных и конечных веществ реакции:
НCl + МnО2 → Сl2 + MnСl2 + Н2О
Покажем изменение степеней окисления атомов до и после реакции:
Эта реакция окислительно-восстановительная, так как изменяются степени окисления атомов хлора и марганца. НCl - восстановитель, MnО2 — окислитель. Составляем электронные уравнения: и находим коэффициенты при восстановителе и окислителе. Они соответственно равны 2 и 1. Коэффициент 2 (а не 1) ставится потому, что 2 атома хлора со степенью окисления -1 отдают 2 электрона. Этот коэффициент уже стоит в электронном уравнении:
2НСl + MnO2 → Сl2 + MnСl2 + Н2О
Находим коэффициенты для других реагирующих веществ. Из электронных уравнений видно, что на 2 моль HCl приходится 1 моль MnО2. Однако, учитывая, что для связывания образующегося двухзарядного иона марганца нужно еще 2 моль кислоты, перед восстановителем следует поставить коэффициент 4. Тогда воды получится 2 моль. Окончательное уравнение имеет вид
4НCl + МnО2 = Сl2 + MnСl2 + 2Н2О
Проверку правильности написания уравнения можно ограничить подсчетом числа атомов одного какого-либо элемента, например хлора: в левой части 4 и в правой 2 + 2 = 4.
Поскольку в методе электронного баланса изображаются уравнения реакций в молекулярной форме, то после составления и проверки их следует написать в ионной форме.
Перепишем составленное уравнение в ионной форме:
4Н+ + 4Сl- + МnО2 = Сl2 + Мn2+ + 2Сl- + 2Н2О
и после сокращения одинаковых ионов в обеих частях уравнения получим
4Н+ + 2Cl- + MnO2 = Сl2 + Mn2+ + 2Н2О
Задание 3. Составление уравнения реакции взаимодействия сероводорода с подкисленным раствором перманганата калия.
Напишем схему реакции - формулы исходных и полученных веществ:
Н2S + КМnO4 + Н2SО4 → S + МnSО4 + К2SO4 + Н2О
Затем покажем изменение степеней окисления атомов до и после реакции:
Изменяются степени окисления у атомов серы и марганца (Н2S - восстановитель, КМnО4 - окислитель). Составляем электронные уравнения, т.е. изображаем процессы отдачи и присоединения электронов:
И наконец, находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах. Из электронных уравнений видно, что надо взять 5 моль Н2S и 2 моль КМnО4, тогда получим 5 моль атомов S и 2 моль МnSО4. Кроме того, из сопоставления атомов в левой и правой частях уравнения, найдем, что образуется также 1 моль К2SО4 и 8 моль воды. Окончательное уравнение реакции будет иметь вид
5Н2S + 2КМnО4 + ЗН2SО4 = 5S + 2МnSО4 + К2SО4 + 8Н2О
Правильность написания уравнения подтверждается подсчетом атомов одного элемента, например кислорода; в левой части их 2.4 + 3.4 = 20 и в правой части 2.4 + 4 + 8 = 20.
Переписываем уравнение в ионной форме:
5Н2S + 2MnO4- + 6H+ = 5S + 2Мn2+ + 8Н2О
Известно, что правильно написанное уравнение реакции является выражением закона сохранения массы веществ. Поэтому число одних и тех же атомов в исходных веществах и продуктах реакции должно быть одинаковым. Должны сохраняться и заряды. Сумма зарядов исходных веществ всегда должна быть равна сумме зарядов продуктов реакции.
Составление уравнений химических реакций методом полуреакции
Алгоритм написания окислительно-восстановительных реакций методом полуреакций
Найти окислитель и восстановитель.
Определить, какие ионы реально существуют.
Записать полуреакции окисления и восстановления.
Сбалансировать число атомов в каждой, добавляя Н+ или Н2О – в кислой среде, ОН- или Н2О – в щелочной среде.
Уравнять количество электронов (зарядов).
Суммировать полуреакции в полное электронно-ионное уравнение (электроны сокращаются).
Записать уравнение в молекулярном виде с коэффициентами.
Как показывает самоназвание, этот метод основан на составлении ионных уравнений для процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение.
В качестве примера составим уравнение той же реакции, которую использовали при объяснении метода электронного баланса. При пропускании сероводорода Н2S через подкисленный раствор перманганата калия КМnО4 малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементной серы,т.е. протекания процесса:
Н2S → S + 2H+
Эта схема уравнена по числу атомов. Для уравнивания по числу зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства:
Н2S - 2е- = S + 2H+
Это первая полуреакция - процесс окисления восстановителя Н2S.
Обесцвечивание раствора связано с переходом иона MnO4- (он имеет малиновую окраску) в ион Mn2+ (практически бесцветный и лишь при большой концентрации имеет слабо-розовую окраску), что можно выразить схемой
MnO4- → Mn2+
В кислом растворе кислород, входящий в состав ионов МnО4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так:
MnO4- + 8Н+→ Мn2+ + 4Н2О
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные - два положительных(2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:
MnO4- + 8Н+ + 5e-= Mn2+ + 4Н2О
Это вторая полуреакция - процесс восстановления окислителя, т.е. перманганат-иона
Для составления общего уравнения реакции надо уравнения полуреакций почленно сложить, предварительно уравняв числа отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются уравнения полуреакций.Сокращенно запись проводится так:
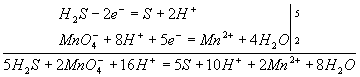
И, сократив на 10Н+, окончательно получим
5Н2S + 2MnO4- + 6H+ = 5S + 2Mn2+ + 8Н2О
Проверяем правильность составленного в ионной форме уравнения: число атомов кислорода в левой части 8, в правой 8; число зарядов: в левой части (2-)+(6+) = 4+, в правой 2(2+) = 4+. Уравнение составлено правильно, так как атомы и заряды уравнены.
Методом полуреакций составляется уравнение реакции в ионной форме. Чтобы от него перейти к уравнению в молекулярной форме, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону - анион. Затем те же ионы в таком же числе записываем в правую часть уравнения, после чего ионы объединяем в молекулы:
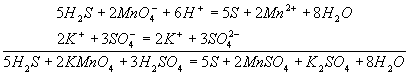
Таким образом, составление уравнений окислительно-восстановительных реакций с помощью метода полуреакций приводит к тому результату, что и метод электронного баланса.
Сопоставим оба метода. Достоинство ыметода полуреакций по сравнению с методом электронного баланса в том. что в нем применяются не гипотетические ионы,а реально существующие. В самом деле, в растворе нет ионов ![]() а есть ионы
а есть ионы ![]()
При методе полуреакций не нужно знать степень окисления атомов. Написание отдельных ионных уравнений полуреакций необходимо для понимания химических процессов в гальваническом элементе и при электролизе. При этом методе видна роль среды как активного участника всего процесса.
Наконец,при использовании метода полуреакций не нужно знать все получающиеся вещества, они появляются в уравнении реакции при выводе его. Поэтому методу полуреакций следует отдать предпочтение и применять его при составлении уравнений всех окислительно-восстановительных реакций, протекающих в водных растворах.
Заключение
В результате, анализируя методику предложенного элективного курса, можно сделать следующие выводы:
1. Элективный курс в современных условиях представляет собой наиболее оптимальную форму для организации дополнительной подготовки учащихся к ЕГЭ по химии;
2. Анализ результатов ЕГЭ по химии позволяет сделать вывод, что затруднения у выпускников вызывает выполнение части С, а именно, задания на темы: «Электролиз», «Растворы», «Генетическая связь между классами неорганических и органических соединений», «Вывод химических формул», «ОВР». Поэтому следует обращать внимание на изучение этих тем при подготовке учащихся к экзамену;
3. Составленный перечень заданий соответствует содержанию и структуре ЕГЭ по химии и отвечает требованиям, предъявляемым к выпускникам. В них включены как задания с рассмотрением решения, так и задания, предназначенные для самостоятельной работы.
Список литературы
Ахметов М.А. ЕГЭ по химии: результаты и методика подготовки выпускников. – Ульяновск: УИПК ПРО, 2004.- 150 с.
ЕГЭ – 2012, 2013, 2014, 2015, 2016 Химия. Тематические тренировочные задания/ И.А. Соколова – М.: АСТ: Астрель, 2012. – 286 с.
Ковальчукова О.В. Учись решать задачи по химии. – М.: Поматур, 1999. – 175 с.
Репетитор по химии/ Н.А. Белов – М.: АСТ: Астрель, 2011. – 294 с.
Химия: Полный справочник для подготовки к ЕГЭ/ Р.А. Лидин – М.: АСТ: Астрель, 2009. – 286, (2) с.
Хомченко Г.П. Пособие по химии для поступающих в ВУЗы.- М.: Новая волна, 1996.-462 с.
47
Просмотр содержимого документа
«РП БИОЛОГИЯ 6-9 класс»
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Статус документа: Программа по биологии составлена на основе Основной образовательной Программы и учебного плана МБОУ «Сарагашская сош» на 2016 – 2017 уч. год и соответствует Федеральному Положению Государственного образовательного стандарта.
Место предмета в учебном плане МБОУ «Сарагашская сош»
В учебном плане МБОУ «Сарагашская сош» на 2016 – 2017 уч. год для основного общего образования на изучение биологии выделено 245 ч. В 6 классе — 34 учебных часов (из расчета по 1 ч/нед.). В 7—8 классах — по 68 учебных часов (из расчета по 2 ч/нед.), 9 класс – 66 часов (2 часа в неделю). Поэтому систематический курс биологии для основной школы состоит из разделов:
Основные признаки и закономерности жизнедеятельности организмов (6 класс).
Многообразие живой природы (7 класс).
Человек и его здоровье (8 класс).
Основы общей биологии (9 класс).
Основными целями изучения биологии в основной школе являются:
освоение знаний о живой природе и присущих ей закономерностях; строении, жизнедеятельности и средообразующей роли живых организмов; человеке как биосоциальном существе; роли биологической науки в практической деятельности людей; методах познания живой природы;
овладение умениями применять биологические знания для объяснения процессов и явлений живой природы, жизнедеятельности собственного организма; использовать информацию о современных достижениях в области биологии и экологии, о факторах здоровья и риска; работать с биологическими приборами, инструментами, справочниками; проводить наблюдения за биологическими объектами и состоянием собственного организма, биологические эксперименты;
развитие познавательных интересов, интеллектуальных и творческих способностей при проведении наблюдений за живыми организмами, биологических экспериментов, работы с различными источниками информации;
воспитание позитивного ценностного отношения к живой природе, собственному здоровью и здоровью других людей; культуры поведения в природе;
применение знаний и умений в повседневной жизни для решения практических задач и обеспечения безопасности своей жизни; выращивания растений и животных; заботы о своем здоровье; оказания первой доврачебной помощи себе и окружающим; оценки последствий своей
деятельности по отношению к живой природе, собственному организму, здоровью других людей; соблюдения правил поведения в окружающей среде, норм здорового образа жизни; профилактики заболеваний, травматизма и стрессов, вредных привычек, ВИЧ-инфекции.
Особенности учебного предмета: Содержание программы систематического курса биологии для основной школы сформировано на основе принципов: соответствия содержания образования потребностям общества; учета единства содержательной и процессуальной сторон обучения; структурного единства содержания образования на разных уровнях его формирования.
Концептуальной основой систематического курса биологии для основной школы являются идеи интеграции учебных предметов; преемственности начального и основного общего образования; гуманизации образования; соответствия содержания образования возрастным закономерностям развития учащихся; личностной ориентации содержания образования; деятельностного характера образования и направленности содержания на формирование общих учебных умений, обобщенных способов учебной, познавательной, практической, творческой деятельности; формирования у учащихся готовности использовать усвоенные знания, умениями способы деятельности в реальной жизни для решения практических задач (ключевых компетенций). Эти идеи явились базовыми при определении структуры, целей и задач предлагаемого курса.
Биология как учебный предмет вносит существенный вклад в формирование у учащихся системы знаний как о живой природе, так и об окружающем мире в целом. Систематический курс биологии в основной школе направлен на формирование у учащихся представлений об отличительных особенностях живой природы, о ее многообразии и эволюции, человеке как биосоциальном существе.
Для формирования у учащихся основ научного мировоззрения, развития интеллектуальных способностей и познавательных интересов в процессе изучения биологии основное внимание следует уделять не передаче суммы готовых знаний, а знакомству учащихся с методами научного познания живой природы, постановке проблем, требующих от учащихся самостоятельной деятельности по их разрешению.
При обучении биологии важно ориентироваться на изложенные в программе требования к его результатам, стремиться к тому, чтобы все учащиеся получили обязательную общеобразовательную подготовку по биологии на необходимом уровне.
Тематический план:
| Название темы | Количество часов |
| Введение | 1 час |
| 1. Клеточное строение организмов | 3 часа |
| 2. Царства Бактерии и Грибы | 5 часов |
| 3. Царство Растения | 5 часов |
| 4.Строение и многообразие покрытосеменных растений | 8 часов |
| 5.Жизнь растений | 7 часов |
| 6.Природные сообщества 5 часов | 5 часов |
Учебно-методический комплекс
Федеральный компонент государственного стандарта основного общего образования по биологии. – официальные документы в образовании, 2005, №4.
Пасечник В. В. Биология. Бактерии. Грибы. Растения. 6 класс: учебник для общеобразовательных учреждений. – 2-е изд. – М.: «Дрофа», 2007.
Журнал «Биология в школе»
http://school-collection.edu.ru/
http://www.fcior.edu.ru/
СОДЕРЖАНИЕ ПРОГРАММ
Содержание программы – 6 класс
(35 часов, один час в неделю)
Введение 1 час
Биология – наука о живой природе.
Клеточное строение организмов 3 часа
Устройство увеличительных приборов. Строение клетки. Жизнедеятельность клетки. Ткани.
Лабораторные работы:
1. Устройство лупы и микроскопа.
2. Приготовление и рассматривание препарата кожицы чешуи лука под микроскопом.
Обучающиеся должны знать: устройство лупы, микроскопа и правила работы с ними, строение клетки и протекающие в ней жизненно важные процессы, основные виды тканей.
Обучающиеся должны уметь: пользоваться лупой и микроскопом, готовить микропрепараты, находить основные части растительной клетки на микропрепарате, в таблице, схематически изображать строение клетки.
Царства Бактерии и Грибы 5 часов
Строение и жизнедеятельность бактерий. Значение бактерий. Общая характеристика грибов. Шляпочные грибы. Плесневые грибы. Дрожжи. Роль грибов в природе и жизни человека.
Обучающиеся должны знать: особенности строения бактерий и грибов, место и роль бактерий и грибов в природе и жизни человека.
Обучающиеся должны уметь: распознавать представителей бактерий и грибов, отличать основные виды съедобных шляпочных грибов от ядовитых.
Царство Растения 5 часов
Одноклеточные водоросли. Многоклеточные водоросли. Лишайники. Мхи. Папоротники. Хвощи Плауны. Голосеменные. Покрытосеменные.
Обучающиеся должны знать: что изучает ботаника, представителей различных отделов растительного царства и особенности их строения, приспособленность растений к различным средам обитания и различным природным условиям.
Обучающиеся должны уметь: распознавать растения различных отделов, сравнивать растения различных отделов, находить черты усложнения, устанавливать связь между особенностями строения растений и средой их обитания.
Строение и многообразие покрытосеменных растений 8 часов
Строение семян растений. Прорастание семян. Виды корней и типы корневых систем. Видоизменения корней. Побег и почки. Внешнее строение листа. Клеточное строение листа. Видоизменения листа. Строение стебля. Видоизменённые побеги. Строение цветка. Соцветия. Плоды. Распространение плодов и семян.
Лабораторные работы:
3. Изучение строения цветка.
4. Ознакомление с различными видами соцветий.
5. Ознакомление с сухими и сочными плодами.
Обучающиеся должны знать: строение семян цветковых растений, внешнее и внутреннее строение корня, стебля, листьев, их видоизменения, зависимость особенностей строения цветкового растения от среды обитания, строение цветка и основные типы соцветий, строение и классификацию плодов, роль цветковых растений в природе и жизни человека.
Обучающиеся должны уметь: распознавать органы цветкового растения и их видоизменения, распознавать типы плодов, устанавливать связь особенностей строения органа со средой обитания.
Жизнь растений 7 часов
Химический состав растений. Минеральное питание растений. Фотосинтез. Дыхание растений. Испарение воды. Передвижение воды по стеблю. Растительный организм как единое целое. Размножение споровых и голосеменных растений. Вегетативное размножение покрытосеменных растений. Оплодотворение у покрытосеменных растений. Образование плодов и семян. Способы опыления у цветковых растений.
Обучающиеся должны знать: химический состав растений, основные процессы жизнедеятельности у растений, фотосинтез, рост и развитие растений, способы вегетативного размножения растений, процессы опыления, оплодотворения и образования плодов и семян.
Обучающиеся должны уметь: определять всхожесть семян, сравнивать способы размножения растений различных систематических групп.
Природные сообщества 5 часов
Основные экологические факторы и их влияние на растения. Характеристика основных экологических групп растений. Растительные сообщества. Взаимосвязи растений в сообществе.
Лабораторные работы:
6. Изучение особенностей строения растений различных экологических групп.
Обучающиеся должны знать: экологические факторы и экологические группы растений, влияние экологических факторов на растения, взаимосвязи растений в сообществах.
Обучающиеся должны уметь: доказывать влияние разных экологических факторов на растения, влияние растений в растительном сообществе.
Программа реализуется с помощью учебника: Пасечник В. В. Биология. Бактерии. Грибы. Растения. 6 класс: учебник для общеобразовательных учреждений. – 2-е изд. – М.: «Дрофа», 2007.
Требования к уровню подготовки учащихся
В результате изучения биологии в 6 классе ученик должен
знать/понимать:
признаки биологических объектов: живых организмов; клеток и организмов растений, грибов и бактерий; растений, грибов своего региона;
сущность биологических процессов: обмен веществ и превращения энергии, питание, дыхание, выделение, транспорт веществ, рост, развитие, размножение растений;
уметь:
объяснять: роль биологии в формировании современной естественнонаучной картины мира, в практической деятельности людей и самого ученика; родство, общность происхождения и эволюцию растений (на примере сопоставления отдельных групп); роль растительных организмов в жизни человека и собственной деятельности; взаимосвязи организмов и окружающей среды; биологического разнообразия в сохранении биосферы; необходимость защиты окружающей среды; место и роль человека в природе; взаимосвязи человека и окружающей среды; зависимость собственного здоровья от состояния окружающей среды;
изучать биологические объекты и процессы: ставить биологические эксперименты, описывать и объяснять результаты опытов; наблюдать за ростом и развитием растений, сезонными изменениями в природе; рассматривать на готовых микропрепаратах и описывать биологические объекты;
распознавать и описывать: на таблицах основные части и органоиды клетки; на живых объектах и таблицах органы цветкового растения, растения разных отделов; наиболее распространенные растения своей местности, культурные растения, съедобные и ядовитые грибы;
выявлять изменчивость организмов, приспособления растительных организмов к среде обитания, типы взаимодействия разных видов;
сравнивать биологические объекты (клетки, ткани, органы, организмы, представителей отдельных систематических групп) и делать выводы на основе сравнения;
определять принадлежность биологических объектов к определенной систематической группе (классификация);
анализировать и оценивать воздействие факторов окружающей среды, факторов риска на здоровье, последствий деятельности человека, влияние собственных поступков на живые организмы;
проводить самостоятельный поиск биологической информации: находить в тексте учебника отличительные признаки основных систематических групп; в биологических словарях и справочниках значения биологических терминов; в различных источниках необходимую информацию о живых организмах (в том числе с использованием информационных технологий).
Виды контроля
Текущий
Тематический
Итоговый
Формы контроля знаний: срезовые и итоговые тестовые, самостоятельные работы; фронтальный и индивидуальный опрос; отчеты по практическим и лабораторным работам.
Тематический план:
| Название темы | Количество часов |
| Введение | 1 |
| 1. Клетка – основа строения и жизнедеятельности | 6 |
| 2.Разнообразие организмов | 7 |
| 3.Жизнедеятельность организмов | 10 |
| 4.Размножение, рост и развитие организмов | 3 |
| 5.Регуляция жизнедеятельности организмов | 7 |
| Лабораторных работ Практических работ | 5 2 |
Учебно-методический комплекс
3 Латюшин В.В., Шапкин В. А.. Биология. Животные. 7 класс, учебник для общеобразовательных учебных заведений. – М.: Дрофа, 2005.
Адреса сайтов в Интернете:
1. http://bio.1september.ru - газета «Биология» - приложение к «1 сентября»
2. www.bio.nature.ru - научные новости биологии
3. www.edios.ru - Эйдос - центр дистанционного образования.
Содержание тем учебного курса биологии в 7 классе
(68 часов, 2 часа в неделю)
Введение. Общие сведения о животном мире (2 часа)
История изучения животных. Методы изучения животных. Наука зоология и ее структура. Сходство и различия животных и растений. Систематика животных.
РАЗДЕЛ 1
Многообразие животных (37 часов)
Простейшие. Многообразие, среда и места обитания. Образ жизни и поведение. Биологические и экологические особенности. Значение в природе и жизни человека. Колониальные организмы.
Демонстрация живых инфузорий, микропрепаратов простейших.
Многоклеточные животные.
Тип Губки. Многообразие, среда обитания, образ жизни. Биологические и экологические особенности. Значение в природе и жизни человека.
Тип Кишечнополостные. Многообразие, среда обитания, образ жизни. Биологические и экологические особенности. Значение в природе и жизни человека. Исчезающие, редкие и охраняемые виды.
Демонстрация микропрепаратов гидры, образцов кораллов, влажных препаратов медуз, видеофильма.
Типы Плоские, Круглые, Кольчатые черви. Многообразие, среда и места обитания. Образ жизни и поведение. Биологические и экологические особенности. Значение в природе и жизни человека.
■ Лабораторная работа
Знакомство с многообразием кольчатых червей.
Тип Моллюски. Многообразие, среда обитания, образ жизни и поведение. Биологические и экологические особенности. Значение в природе и жизни человека.
Демонстрация разнообразных моллюсков и их раковин.
Тип Иглокожие. Многообразие, среда обитания, образ жизни и поведение. Биологические и экологические особенности. Значение в природе и жизни человека.
Демонстрация морских звезд и других иглокожих, видеофильма.
Тип Членистоногие. Класс Ракообразные. Многообразие. Среда обитания, образ жизни и поведение. Биологические и экологические особенности. Значение в природе и жизни человека.
■ Лабораторная работа
Знакомство с разнообразием ракообразных.
Класс Паукообразные. Многообразие. Среда обитания, образ жизни и поведение. Биологические и экологические особенности. Значение в природе и жизни человека.
Класс Насекомые. Многообразие. Среда обитания, образ жизни и поведение. Биологические и экологические особенности. Значение в природе и жизни человека.
■ Лабораторная работа
Изучение представителей отрядов насекомых.
Тип Хордовые. Класс Ланцетники. Надкласс Рыбы. Многообразие: круглоротые, хрящевые, костные. Среда обитания, образ жизни, поведение. Биологические и экологические особенности. Значение в природе и жизни человека. Исчезающие, редкие и охраняемые виды.
Лабораторная работа
Наблюдение за внешним строением и передвижением рыб.
Класс Земноводные. Многообразие. Среда обитания, образ жизни и поведение. Биологические и экологические особенности. Значение в природе и жизни человека. Исчезающие, редкие и охраняемые виды.
Класс Пресмыкающиеся. Многообразие. Среда обитания, образ жизни и поведение. Биологические и экологические особенности. Значение в природе и жизни человека. Исчезающие, редкие и охраняемые виды.
Класс Птицы. Многообразие. Среда обитания, образ жизни и поведение. Биологические и экологические особенности. Значение в природе и жизни человека. Исчезающие, редкие и охраняемые виды.
■ Лабораторная работа
Изучение внешнего строения птиц.
■ Экскурсия
Изучение многообразия птиц.
Класс Млекопитающие. Важнейшие представители отрядов млекопитающих. Среда обитания, образ жизни и поведение. Биологические и экологические особенности. Значение в природе и жизни человека. Исчезающие, редкие и охраняемые виды.
Демонстрация видеофильма.
РАЗДЕЛ 2
Эволюция строения. Взаимосвязь строения и функций органов и их систем у животных (12 часов)
Покровы тела. Опорно-двигательная система и способы передвижения. Полости тела. Органы дыхания, пищеварения, выделения, кровообращения. Кровь. Обмен веществ и энергии. Органы размножения, продления рода. Органы чувств, нервная система, инстинкт, рефлекс. Регуляция деятельности организма.
Демонстрация влажных препаратов, скелетов, моделей и муляжей.
• Лабораторная работа
Изучение особенностей различных покровов тела.
РАЗДЕЛ 3
Индивидуальное развитие животных (4 часа)
Способы размножения. Оплодотворение. Развитие с превращением и без превращения. Периодизация и продолжительность жизни.
■ Лабораторная работа
Изучение стадий развития животных и определение их возраста.
РАЗДЕЛ 4
Развитие животного мира на Земле (3 часа)
Доказательства эволюции: сравнительно-анатомические, эмбриологические, палеонтологические.
Ч. Дарвин о причинах эволюции животного мира. Усложнение строения животных и разнообразие видов как результат эволюции.
Демонстрация палеонтологических доказательств эволюции.
РАЗДЕЛ 5
Закономерности размещения животных на Земле (2 часа)
Ареалы обитания. Закономерности размещения животных.
Миграции.
РАЗДЕЛ 6
Биоценозы (4 часов)
Естественные и искусственные биоценозы (водоем, луг, степь, тундра, лес, населенный пункт). Факторы среды и их влияние на биоценоз. Цепи питания, поток энергии. Взаимосвязь компонентов биоценоза и их приспособленность друг к другу.
■ Экскурсии
Изучение взаимосвязи животных с другими компонентами биоценоза.
Фенологические наблюдения за весенними явлениями в жизни животных.
РАЗДЕЛ 7
Животный мир и хозяйственная деятельность человека (3 часа)
Воздействие человека и его деятельности на животных. Промыслы.
Одомашнивание. Разведение, основы содержания и селекции сельскохозяйственных животных.
Законы об охране животного мира. Система мониторинга. Охраняемые территории. Красная книга. Рациональное использование животных.
■ Экскурсия
Посещение выставок сельскохозяйственных и домашних животных.
Важными формами деятельности учащихся являются:
· Практическая деятельность учащихся по проведению наблюдений, постановке опытов, учету природных объектов, описанию экологических последствий при использовании и преобразовании окружающей среды;
Требования к уровню подготовки учащихся
В результате изучения биологии ученик должен:
знать/ понимать:
· признаки биологических объектов: живых организмов; животных; популяций; экосистем и агроэкосистем; животных своего региона.
· сущность биологических процессов: обмен веществ, питание, дыхание, выделение, транспорт веществ, рост, развитие, размножение, регуляция жизнедеятельности организма животных, раздражимость, круговорот веществ и превращения энергии в экосистемах.
· особенности строения организмов животных разных систематических групп.
Уметь:
· объяснять: роль биологии в формировании современной естественнонаучной картины мира, в практической деятельности людей и самого ученика; родство, общность происхождения и эволюцию животных; роль различных организмов в жизни человека и собственной деятельности; взаимосвязи организмов и окружающей среды; необходимость защиты окружающей среды
· изучать биологические объекты и процессы: ставить биологические эксперименты, описывать и объяснять результаты опытов; наблюдать за ростом и развитием животных, поведением животных, сезонными изменениями в природе; рассматривать на готовых и приготовленных микропрепаратов и описывать биологические объекты
· распознавать и описывать: на таблицах основные части и органоиды животной клетки; на живых объектах и таблицах органы и системы органов животных, животных отдельных типов и классов; наиболее распространённых животных своей местности, домашних животных, опасные для человека животные.
· выявлять изменчивость организмов, приспособления животных к среде обитания, типы взаимодействия разных видов животных между собой и с другими компонентами экосистем
· сравнивать биологические объекты (клетки, ткани, органы и системы органов, животных, представителей отдельных систематических групп) и делать выводы на основе сравнения;
· определять принадлежность животных определенной систематической группе (классификация)
· проводить самостоятельный поиск биологической информации: находить в тексте учебника отличительные признаки животных основных систематических групп; в биологических словарях и справочниках значение зоологических терминов; в различных источниках необходимую информацию о животных (в том числе с использованием информационных технологий).
Использовать приобретённые знания и умения в практической деятельности и повседневной жизни для:
· Соблюдения мер профилактики заболеваний, вызываемых животными;
· Оказания первой помощи при укусах животных
· Соблюдения правил поведения в окружающей среде
· Выращивания и размножения домашних животных, ухода за ними.
Виды контроля
Текущий
Тематический
Итоговый
Формы контроля знаний: срезовые и итоговые тестовые, самостоятельные работы; фронтальный и индивидуальный опрос; отчеты по практическим и лабораторным работам.
Учебно-тематический план
| № | Название раздела | Кол-во часов |
|
| ВВЕДЕНИЕ. ОБЩИЕ СВЕДЕНИЯ О ЖИВОТНОМ МИРЕ. | 2 часа |
| 1 | МНОГООБРАЗИЕ ЖИВОТНЫХ. | 37часов |
| 2 | ЭВОЛЮЦИЯ СТРОЕНИЯ. ВЗАИМОСВЯЗЬ СТРОЕНИЯ И ФУНКЦИЙ ОРГАНОВ И ИХ СИСТЕМ. | 12 часов |
| 3 | ИНДИВИДУАЛЬНОЕ РАЗВИТИЕ ЖИВОТНЫХ. | 4 часа |
| 4 | РАЗВИТИЕ ЖИВОТНОГО МИРА НА ЗЕМЛЕ. | 3 часа |
| 5 | ЗАКОНОМЕРНОСТИ РАЗМЕЩЕНИЯ ЖИВОТНЫХ НА ЗЕМЛЕ. | 2 часа |
| 6 | БИОЦЕНОЗЫ. | 4часов |
| 7 | ЖИВОТНЫЙ МИР И ХОЗЯЙСТВЕННАЯ ДЕЯТЕЛЬНОСТЬ ЧЕЛОВЕКА. | 3 часа |
|
| Всего: | 68 часов |
Учебно-методический комплекс
Колесов Д.В., Маш Р.Д., Беляев И.Н. Биология. Человек: учебник для 8 кл. общеобразовательных учебных заведений. – М.: Дрофа, 2008.
http://school-collection.edu.ru/
http://www.fcior.edu.ru/
Содержание программы 8 класс
(68 часов, два часа в неделю)
Введение. Науки, изучающие человека 2 часа
Человек как звено в ряду живых существ: общность в проявлении основных биологических функций, клеточном строении; схожесть плана строения организма человека и млекопитающих животных.
Науки о человеке: анатомия, физиология, психология, гигиена, медицина. История и методы изучения человека.
Значение знаний о человеке для охраны его здоровья.
Обучающиеся должны знать:
- определение и методы наук анатомия, физиология, психология, гигиена;
- вклад учёных в развитие наук о человеке.
Обучающиеся должны уметь:
- соблюдать правила личной и общественной гигиены;
- находить общность и различие человека и млекопитающих животных;
- работать с учебником: с текстом, рисунками.
Происхождение человека 3 часа
Систематическое положение человека. Историческое прошлое людей.
Расы человека.
Обучающиеся должны знать:
- систематическое положение человека;
- строение и жизнь древнейших, древних и первых современных людях;
- становление рас.
Обучающиеся должны уметь:
- использовать сравнительно-анатомические, физиологические и эмбриологические методы для доказательства родства живых организмов.
Строение организма:
Общий обзор. Клеточное строение. Рефлекторная регуляция. 4 часа
Общий обзор организма. Уровни организации организма. Структура тела. Органы и системы органов. Клеточное строение организма. Внешняя и внутренняя среда.
Строение животной клетки. Строение и функции ядра. Органоиды клетки и их функции (клеточная мембрана, эндоплазматическая сеть, рибосомы, митохондрии, лизосомы). Деление клетки. Жизненные процессы клетки (обмен веществ и энергии, рост и развитие клетки, покой и возбуждение клеток). Ферменты.
Ткани (эпителиальная, соединительная, мышечная, нервная). Особенности строения и функции тканей. Рефлекторная регуляция. Центральная и периферическая нервная система. Рефлекс и рефлекторная дуга.
Лабораторные работы:
Рассматривание клеток и тканей в оптический микроскоп.
Микропрепараты клеток эпителиальной, мышечной и нервной тканей.
Самонаблюдение мигательного рефлекса и условия его проявления и торможения
Коленный рефлекс
Обучающиеся должны знать:
- расположение внутренних органов;
- строение животной клетки;
- особенности строения и функции основных тканей;
- функцию нервных клеток.
Обучающиеся должны уметь:
- распознавать органы и их топографию; системы органов;
- пользоваться анатомическими таблицами;
-пользоваться микроскопом;
- анализировать рефлексы и их рефлекторные дуги.
Опорно-двигательная система 7 часов
Значение опорно-двигательной системы. Химический состав костей. Макроскопическое и микроскопическое строение кости. Типы костей.
Функции скелета. Осевой скелет: череп, туловище. Скелет поясов и свободных конечностей: добавочный скелет. Типы соединения костей: неподвижные, полуподвижные, суставы.
Строение мышц. Работа скелетных мышц и их регуляция. Гиподинамия. Осанка. Предупреждение и лечение плоскостопия. Понятия: ушибы, переломы, растяжение связок, вывихи суставов, первая помощь.
Лабораторные работы:
5. Микроскопическое строение костей.
6. Самонаблюдения работы основных мышц, роль плечевого пояса в движении руки.
7. Мышцы человеческого тела (выполняется в дома).
8. Утомление при статистической и динамической работе.
9. Выявление нарушения осанки.
10. Выявление плоскостопия.
Обучающиеся должны знать:
- строение и функции скелета и мышц;
- о приспособлении организма к труду и прямохождению;
- о нервной регуляции работы мышц;
- о тренировочном эффекте и вреде гиподинамии.
Обучающиеся должны уметь:
- выявлять нарушение осанки и плоскостопие;
- оказывать первую помощь при ушибах, переломах костей, растяжениях связок и вывихах.
Внутренняя среда организма. 3 часа
Понятие о внутренней среде организма: кровь, лимфа, тканевая жидкость – как внутренняя среда живого организма. Кровь – соединительная ткань. Значение крови и её состав. Клетки крови: эритроциты, тромбоциты, лейкоциты. Функции крови: транспортная, информационная, защитная, поддержание постоянства температуры тела, сохранение постоянства внутренней среды (гомеостаз). Болезни крови. Значение анализа крови для диагностики заболеваний. Лимфа, её движение, свойства и значение. Тканевая совместимость и переливание крови.
Кроветворные органы человека. Иммунная система человека. Иммунный ответ организма. Открытие и обоснование процесса фагоцитоза И.И. Мечниковым. Вакцинация. Инфекционные заболевания. Профилактика гриппа, СПИДа. Аллергические заболевания человека. Резус-фактор.
Обучающиеся должны знать:
- состав крови, лимфы, тканевой жидкости;
- об иммунной системе;
- причины возникновения и способы профилактики инфекционных заболеваний;
- о переливании крови;
- о пересадке органов и преодолении тканевой несовместимости.
Обучающиеся должны уметь:
- определять форменные элементы крови;
- распознавать инфекционные болезни, пресекать пути их распространения;
- бороться с болезнетворными микроорганизмами.
Кровеносная и лимфатическая системы. 7 часов
Органы кровеносной системы: сердце, кровеносные сосуды: артерии вены и капилляры.
Лимфатическая система. Строение артерий, капилляров, вен и лимфатических сосудов.
Малый и большой круги кровообращения. Регуляция кровообращения.
Сердце, его строение и функции. Особенности мышечной ткани сердца. Клапаны сердца и их функции. Кровоснабжение и проводящая система сердца. Работа сердца. Пульс. Болезни сердца. Кровяное давление.
Влияние различных факторов окружающей среды на работу сердца. Курение и алкоголь – факторы риска. Первая помощь при стенокардии, кровотечениях.
Лабораторные работы:
12. Положение венозных клапанов в опущенной и поднятой руке.
13. Изменения в тканях при перетяжках, затрудняющих кровообращение.
14. Определение скорости кровотока в сосудах ногтевого ложа.
15. Опыты, выясняющие природу пульса.
16. Функциональная проба. Реакция сердечно-сосудистой системы на дозированную нагрузку (выполняется дома).
Обучающиеся должны знать:
- как взаимодействуют кровеносная и лимфатическая системы;
- работу сердца;
- как происходит регуляция деятельности сердца и сосудов;
- что надо делать при нарушении сердечной деятельности и кровотечениях.
Обучающиеся должны уметь:
- с помощью функциональных проб определять степень тренированности сердечно-сосудистой системы;
- подсчитывать число пульсовых ударов;
- оказывать первую помощь при кровотечениях.
Дыхательная система 4 часа
Значение дыхания. Строение и функции органов дыхания. Голосообразование. Инфекционные и хронические заболевания дыхательных путей. Лёгкие. Лёгочное и тканевое дыхание. Механизмы вдоха и выдоха. Регуляция дыхания: рефлекторная и гуморальная. Значение чистого воздуха для здоровья человека. Курение как фактор риска.
Защита атмосферного воздуха от загрязнений. Источники загрязнения атмосферного воздуха.
Основные заболевания дыхательной системы, их лечение и профилактика. Первая помощь при поражении органов дыхания. Искусственное дыхание.
Лабораторная работа:
17. Измерение обхвата грудной клетки в состоянии вдоха и выдоха.
18. Функциональные пробы с задержкой дыхания на вдохе и выдохе.
Обучающиеся должны знать:
- строение и функции органов дыхания, голосообразование;
- способы укрепления дыхательных мышц и повышение жизненной ёмкости лёгких;
- как предупредить заболевания органов дыхательной системы;
- меры первой помощи при утоплении, завалах землёй, электротравмах;
- клиническая и биологическая смерть и способы реанимации: искусственное дыхание и непрямой массаж сердца.
Обучающиеся должны уметь:
- определять состояние миндалин и аденоидов;
- измерять обхват грудной клетки;
- проводить дыхательные функциональные пробы;
- оказывать доврачебную помощь при нарушении дыхания.
Пищеварительная система 7 часов
Пища – источник энергии и строительного материала. Пищеварение. Строение и функции органов пищеварения. Питательные вещества и пищевые продукты. Рецепторы вкуса. Этапы процессов пищеварения.
Строение зубов. Уход за зубами. Заболевания зубов.
Пищеварительные железы: печень и поджелудочная железа. Нервная регуляция пищеварения. Условные и безусловные рефлексы. Гуморальная регуляция пищеварения.
Гигиена питания. Предупреждение желудочно-кишечных инфекций.
Лабораторные работы:
19. Действие ферментов слюны на крахмал.
Обучающиеся должны знать:
- строение и функции органов пищеварения;
- значение пищеварительных желёз;
- строение зубов;
- условные и безусловные рефлексы.
Обучающиеся должны уметь:
- определять местоположение желудка, печени, аппендикса;
- распознавать желудочно-кишечные расстройства и оказывать первую помощь при их проявлении;
- соблюдать правила ухода за зубами.
Обмен веществ и энергии. 4 часа
Общая характеристика обмена веществ и энергии. Пластический и энергетический обмен, их взаимосвязь. Обмен жиров, углеводов, белков, воды, минеральных солей.
Витамины. Их роль в обмене веществ. Гиповитаминоз. Гипервитаминоз. Авитаминоз.
Энерготраты человека и пищевой рацион.
Лабораторные работы:
20. Установление зависимости между нагрузкой и уровнем энергетического обмена.
21. Составление пищевых рационов в зависимости от энерготрат (выполняется дома).
Обучающиеся должны знать:
- превращения белков, жиров и углеводов в организме, о значении воды и минеральных солей в организме;
- подготовительную, основную и заключительную фазы обмена
- об энерготратах организма и энергетической ёмкости пищевых веществ;
- правила рационального питания;
- значение витаминов.
Обучающиеся должны уметь:
- составлять пищевые рационы в зависимости от энергетических трат;
- проводить функциональные пробы с задержкой дыхания до и после нагрузки, позволяющие определить особенности энергетического обмена при выполнении работы.
Покровные органы. Терморегуляция. Выделение. 5 часов
Наружные покровы тела человека. Строение и функции кожи. Роль кожи в теплорегуляции. Уход за кожей. Гигиена одежды и обуви. Заболевания кожи и их предупреждение.
Терморегуляция организма. Закаливание. Профилактика и первая помощь при тепловом, солнечном ударах, обморожении, электрошоке.
Значение выделения. Органы выделения. Почки, их строение и функции. Нефроны.
Болезни органов выделения, их предупреждение.
Обучающиеся должны знать:
- защитную роль кожных покровов от потери влаги и микроорганизмов;
- участие кожных покровов в поддержании температуры тела;
- как происходит удаление жидких продуктов распада из организма;
- как регулируется содержание питательных веществ в крови.
Обучающиеся должны уметь:
- ухаживать за кожей, волосами, ногтями, следить за одеждой и обувью;
- предупреждать заболевания кожи;
- оказывать помощь при ожогах и обморожениях, при тепловом и солнечном ударе;
- закаливать организм;
- предупреждать заболевания почек.
Нервная система. 5 часов
Значение и строение нервной системы. Центральная и периферическая нервная системы. Строение и функции отделов головного мозга и спинного мозга. Большие полушария головного мозга. Кора больших полушарий. Соматический и автономный (вегетативный) отделы нервной системы. Симпатический и парасимпатический подотделы автономной нервной системы.
Лабораторные работы:
22. Пальценосовая проба и особенности движения, связанные с функцией мозжечка.
23. Рефлексы продолговатого и среднего мозга, штриховое раздражение кожи. (Тест) определяющий изменение тонуса симпатической и парасимпатической системы.
Обучающиеся должны знать:
- строение и функции спинного и головного мозга, нервов и нервных узлов;
- врождённые и приобретённые рефлексы;
- функционирование соматического и автономного (вегетативного) отделов нервной системы.
Обучающиеся должны уметь:
- проводить функциональные пробы, позволяющие выявить особенности нервной деятельности.
Анализаторы. Органы чувств. 4 часа
Анализаторы. Строение и функции анализаторов. Значение анализаторов.
Зрительный анализатор. Значение зрения. Положение и строение глаза. Строение сетчатки. Корковая часть зрительного анализатора. Предупреждение глазных инфекций, близорукости и дальнозоркости, косоглазия. Катаракта. Травмы глаз.
Слуховой анализатор. Значение слуха. Строение органа слуха. Наружное ухо, среднее ухо, внутреннее ухо. Гигиена органов слуха.
Органы равновесия. Мышечное чувство. Кожная чувствительность. Обоняние. Орган вкуса. Иллюзия. Компенсация одних анализаторов другими.
Лабораторные работы:
24. Иллюзия, связанная с бинокулярным зрением.
Обучающиеся должны знать:
- строение и работу органов чувств.
Обучающиеся должны уметь:
- оценивать работу органов чувств;
- предупреждать возможные нарушения органов чувств;
- овладеть некоторыми методами тренировки ряда анализаторов.
Высшая нервная деятельность. Поведение. Психика. 5 часов
Понятие высшая нервная деятельность. И. М. Сеченов и И. П. Павлов, их вклад в разработку учения о высшей нервной деятельности. Рефлекс – основа нервной деятельности. Виды рефлексов. Торможение условного рефлекса. Метод условных рефлексов.
Разные формы торможения. Доминанта. Врождённые и приобретённые программы поведения.
Сон и сновидения. Потребности людей и животных. Речь.
Познавательные процессы: ощущения и восприятия, память, воображение, мышление.
Воля, эмоции, внимание. Стресс.
Лабораторные работы:
25. Выработка навыка зеркального письма.
26. Измерение числа колебаний образа усечённой пирамиды в различных условиях.
Обучающиеся должны знать:
- врождённые и приобретённые программы поведения;
- природу сна и сновидений, памяти, мышлении, об эмоциях и волевых действиях;
- значение речи и трудовой деятельности.
Обучающиеся должны уметь:
- разбираться в схемах безусловных и условных рефлексов;
- оценивать свою наблюдательность, память, внимание и путём тренировок улучшать их.
Эндокринная система. 2 часа
Железы внутренней, внешней и смешанной секреции. Гормоны и их роль в обменных процессах. Нервно-гуморальная регуляция процессов жизнедеятельности организма как основа его целостности, связи со средой. Функция желёз внутренней секреции.
Обучающиеся должны знать:
- действие гормонов на организм;
- признаки эндокринных нарушений и способы их устранений у людей.
Обучающиеся должны уметь:
- определять расположение некоторых эндокринных желёз;
- распознавать симптомы ряда эндокринных заболеваний.
Индивидуальное развитие организма. 5 часов
Размножение: бесполое и половое. Система органов размножения; строение и гигиена.
Оплодотворение. Внутриутробное развитие, роды. Наследственные и врождённые заболевания. Болезни, передаваемые половым путём. СПИД. Сифилис. Гепатит В.
Рост и развитие ребёнка. Темперамент. Характер. Индивид и личность. Интересы, склонности, способности.
Обучающиеся должны знать:
- развитие человеческого организма;
- изменения в организме в подростковом возрасте;
- болезни передающиеся половым путём;
- типы темперамента и особенности характера;
- понятие интерес и склонности, о развитии способностей к той или иной деятельности.
Обучающиеся должны уметь:
- доказывать филогенетическое родство эмбриологическими методами;
- определять темперамент;
- различать интересы и склонности;
- использовать знания о своих способностях для выбора дальнейшего жизненного пути.
Требования к уровню подготовки учащихся
В результате изучения биологии в 8 классе ученик должен
знать/понимать:
признаки биологических объектов: живых организмов; генов и хромосом; клеток и организмов;
сущность биологических процессов: обмен веществ и превращения энергии, питание, дыхание, выделение, транспорт веществ, рост, развитие, размножение, наследственность и изменчивость, регуляция жизнедеятельности организма;
особенности организма человека, его строения, жизнедеятельности, высшей нервной деятельности и поведения;
основы экологии человека
уметь:
объяснять: роль биологии в формировании современной естественнонаучной картины мира, в практической деятельности людей и самого ученика; родство человека с млекопитающими животными, место и роль человека в природе; взаимосвязи человека и окружающей среды; зависимость собственного здоровья от состояния окружающей среды; причины наследственности и изменчивости, проявления наследственных заболеваний, иммунитета у человека; роль гормонов и витаминов в организме;
изучать биологические объекты и процессы: ставить биологические эксперименты, описывать и объяснять результаты опытов; рассматривать на готовых микропрепаратах и описывать биологические объекты;
распознавать и описывать: на таблицах основные части и органоиды клетки, органы и системы органов человека;
сравнивать биологические объекты (клетки, ткани, органы и системы органов) и делать выводы на основе сравнения;
анализировать и оценивать воздействие факторов окружающей среды, факторов риска на здоровье;
проводить самостоятельный поиск биологической информации: находить в тексте учебника отличительные признаки основных систематических групп; в биологических словарях и справочниках значения биологических терминов (в том числе с использованием информационных технологий);
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
соблюдения мер профилактики заболеваний; травматизма, стрессов, ВИЧ-инфекции, вредных привычек (курение, алкоголизм, наркомания); нарушения осанки, зрения, слуха, инфекционных и простудных заболеваний;
оказания первой помощи при отравлении ядовитыми грибами, растениями, укусах животных; при простудных заболеваниях, ожогах, обморожениях, травмах, спасении утопающего;
рациональной организации труда и отдыха, соблюдения правил поведения в окружающей среде;
проведения наблюдений за состоянием собственного организма.
Виды контроля
Текущий
Тематический
Итоговый
Формы контроля знаний: срезовые и итоговые тестовые, самостоятельные работы; фронтальный и индивидуальный опрос; отчеты по практическим и лабораторным работам.
Тематическое планирование
| № | Тема | Количество часов |
| Введение | 2 |
| | Систематическое положение человека, его происхождение | 3 |
| | Общий обзор организма | 1 |
| | Клеточное строение организма. Ткани. | 3 |
| | Рефлекторная регуляция органов и систем органов | 1 |
| | Опорно-двигательная система | 7 |
| | Внутренняя среда организма | 3 |
| | Кровеносная и лимфатическая среда человека | 7 |
| | Дыхательная система | 4 |
| | Пищеварительная система | 7 |
| | Обмен веществ и энергии | 4 |
| | Покровные органы. Теплорегуляция. | 4 |
| | Выделительная система | 1 |
| | Нервная система человека | 5 |
| | Анализаторы | 4 |
| | Высшая нервная деятельность. Поведение. Психика. | 5 |
| | Эндокринная система | 2 |
| | Индивидуальное развитие организма | 5 |
| | Резервное время | 1 |
| Итого: 68 часов | ||
Учебно-методический комплекс
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. Введение в общую биологию и экологию: учеб. для общеобразоват. учеб. заведений. – М.: Дрофа, 2008. – 303 с.
м е т о д и ч е с к о е п о с о б и е д л я у ч и т е л я:
Пасечник, В. В. Введение в общую биологию и экологию. 9 класс. Тематическое и поурочное планирование к учебнику А. А. Каменского, Е. А. Криксунова, В. В. Пасечника «Введение в общую биологию и экологию»: пособие для учителя. – М.: Дрофа, 2008. – 128 с.
Содержание курса биологии 9 класса
(66 часов, два часа в неделю)
Введение. Биология в системе наук (3 ч)
Биология как наука. Место биологии в системе наук. Значение биологии для понимания научной картины мира. Методы биологических исследований. Понятие «жизнь». Современные научные представления о сущности жизни. Значение биологической науки в деятельности человека.
Демонстрации: портреты ученых-биологов; схема «Связь биологии с другими науками».
Раздел I. Уровни организации живой природы (44 ч)
Глава 1. Молекулярный уровень (9 ч)
Предмет, задачи и методы исследования цитологии как науки. История открытия и изучения клетки. Основные положения клеточной теории. Значение цитологических исследований для развития биологии и других биологических наук, медицины, сельского хозяйства.
Клетка как структурная и функциональная единица живого. Химический состав клетки. Группы органических соединений: углеводы, липиды, белки, нуклеиновые кислоты. Биологические катализаторы.
Вирусы.
Глава 2. Клеточный уровень (10 ч)
Основные компоненты клетки. Строение мембран и ядра, их функции. Цитоплазма и основные органоиды. Их функции в клетке.
Особенности строения клеток бактерий, грибов, животных и растений. Различия в строении клеток прокариот и эукариот.
Обмен веществ и превращения энергия в клетке. Способы получения органических веществ: автотрофы и гетеротрофы. Фотосинтез, его космическая роль в биосфере.
Биосинтез белков. Понятие о гене. ДНК — источник генетической информации. Генетический код. Матричный принцип биосинтеза белков. Образование РНК по матрице ДНК. Регуляция биосинтеза.
Понятие о гомеостазе, регуляция процессов превращения веществ и энергии в клетке. Деление клетки. Митоз.
Демонстрации: микропрепараты клеток растений и животных; модель клетки; опыты, иллюстрирующие процесс фотосинтеза; модели РНК и ДНК, различных молекул и вирусных частиц; схема путей метаболизма в клетке; модель-аппликация «Синтез белка».
Лабораторные работы:
Строение эукариотических клеток у растений, животных, грибов и прокариотических клеток у бактерий.
Наблюдение плазмолиза и деплазмолиза в клетках эпидермиса лука.
Глава 3. Организменный уровень (14ч)
Размножение и индивидуальное развитие (онтогенез) организмов. Самовоспроизведение — всеобщее свойство живого. Формы размножения организмов. Бесполое размножение и его типы. Митоз как основа бесполого размножения и роста многоклеточных организмов, его биологическое значение.
Половое размножение. Мейоз, его биологическое значение. Биологическое значение оплодотворения.
Понятие индивидуального развития (онтогенеза) у растительных и животных организмов. Деление, рост, дифференциация клеток, органогенез, размножение, старение, смерть особей. Влияние факторов внешней среды на развитие зародыша. Уровни приспособления организма к изменяющимся условиям.
Демонстрации: таблицы, иллюстрирующие виды бесполого и полового размножения, эмбрионального и постэмбрионального развития высших растений, сходство зародышей позвоночных животных; схемы митоза и мейоза.
Генетика как отрасль биологической науки. История развития генетики.
Закономерности наследования признаков живых организмов. Работы Г. Менделя. Методы
исследования наследственности. Гибридологический метод изучения наследственности.
Моногибридное скрещивание. Закон доминирования. Закон расщепления. Полное и .
неполное доминирование. Закон чистоты гамет и его цитологическое обоснование. Фенотип и генотип.
Генетическое определение пола. Генетическая структура половых хромосом. Наследование признаков, сцепленных с полом.
Хромосомная теория наследственности. Генотип как целостная система.
Основные формы изменчивости. Генотипическая изменчивость. Мутации. Причины и частота мутаций, мутагенные факторы. Эволюционная роль мутаций.
Комбинативная изменчивость. Возникновение различных комбинаций генов и их роль в создании генетического разнообразия в пределах вида. Эволюционное значение комбинативной изменчивости.
Фенотипическая, или модификационная, изменчивость. Роль условий внешней среды в развитии и проявлении признаков и свойств.
Демонстрации: модели-аппликации, иллюстрирующие законы наследственности, перекрест хромосом; результаты опытов, показывающих влияние условий среды на изменчивость организмов; гербарные материалы, коллекции, муляжи гибридных, полиплоидных растений.
Лабораторные работы:
Изучение изменчивости у растений и животных.
Изучение фенотипов растений. Практическая работа:
Решение генетических задач.
Генетика человека
Методы изучения наследственности человека. Генетическое разнообразие человека. Генетические основы здоровья. Влияние среды на генетическое здоровье человека. Генетические болезни. Генотип и здоровье человека.
Демонстрации: хромосомные аномалии человека и их фенотипические проявления.
Лабораторная работа:
• Составление родословных.
Основы селекции и биотехнологии
Задачи и методы селекции. Генетика как научная основа селекции организмов. Достижения мировой и отечественной селекции.
Демонстрации: живые растения, гербарные экземпляры, муляжи, таблицы, фотографии, иллюстрирующие результаты селекционной работы; портреты селекционеров.
Глава 4. Популяционно - видовой уровень (3 ч)
Вид. Критерии вида. Видообразование. Понятие микроэволюции. Популяционная структура вида. Популяция как элементарная эволюционная единица. Биологическая классификация.
Глава 5. Экосистемный уровень (4ч)
Сообщество, экосистема, биогеоценоз. Состав и структура сообщества. Продуктивность сообщества. Потоки вещества и энергии в экосистеме.
Экосистемная организация живой природы. Экосистемы. Роль производителей, потребителей и разрушителей органических веществ в экосистемах и круговороте веществ в природе. Пищевые связи в экосистеме. Особенности агроэкосистем.
Лабораторные работы:
Строение растений в связи с условиями жизни.
Подсчет индексов плотности для определенных видов растений.
Выделение пищевых цепей в искусственной экосистеме (на примере аквариума). Практические работы:
Наблюдения за сезонными изменениями в живой природе.
Составление схем передачи веществ и энергии (цепей питания)
Глава 6. Биосферный уровень (4ч)
Биосфера — глобальная экосистема. Среды жизни. Средообразующая деятельность организмов. Круговорот веществ в биосфере. Экскурсия:
• Среда жизни и ее обитатели.
Раздел П. Эволюция органического мира (13ч)
Глава 1. Основы учения об эволюции (7ч)
Учение об эволюции органического мира. Ч. Дарвин — основоположник учения об эволюции. Движущие силы и результаты эволюции. Усложнение растений и животных в процессе эволюции. Биологическое разнообразие как основа устойчивости биосферы, результат эволюции. Сущность эволюционного подхода к изучению живых организмов.
Движущие силы и результаты эволюции. Факторы эволюции и их характеристика
Естественный отбор — движущая и направляющая сила эволюции. Борьба за существование как основа естественного отбора. Роль естественного отбора в формировании новых свойств, признаков и новых видов.
Возникновение адаптации и их относительный характер. Взаимоприспособленность видов как результат действия естественного отбора.
Значение знаний о микроэволюции для управления природными популяциями, решения проблем охраны природы и рационального природопользования.
Понятие о макроэволюции. Соотнесение микро- и макроэволюции. Усложнение растений и животных в процессе эволюции. Биологическое разнообразие как основа устойчивости биосферы, результат эволюции.
Демонстрации: живые растения и животные; гербарные экземпляры и коллекции животных, показывающие индивидуальную изменчивость и разнообразие сортов культурных растений и пород домашних животных, а также результаты приспособленности организмов к среде обитания и результаты видообразования; схемы, I иллюстрирующие процессы видообразования и соотношение путей прогрессивной биологической эволюции.
Лабораторная работа:
• Изучение приспособленности организмов к среде обитания.
Глава 2. Происхождение и развитие жизни на Земле (6 ч)
Взгляды, гипотезы и теории о происхождении жизни. Органический мир как результат эволюции. История развития органического мира. Гипотеза Опарина - Холдейна. Демонстрации: окаменелости, отпечатки растений и животных в древних породах; репродукции картин, отражающих флору и фауну различных эр и периодов.
Экскурсия:
• История развития жизни на Земле (краеведческий музей, геологическое обнажение).
Раздел III. Основы экологии (6ч)
Окружающая среда — источник веществ, энергии и информации. Экология, как наука. Влияние экологических факторов на организмы. Условия среды. Приспособления организмов к различным экологическим факторам. Популяция. Типы взаимодействия популяций разных видов (конкуренция, хищничество, симбиоз, паразитизм).
Межвидовые отношения организмов, колебания численности организмов. Лабораторная работа* Выявление приспособлений организмов к среде обитания (на конкретных примерах), типов взаимодействия популяций разных видов в конкретной экосистеме
Биосфера — глобальная экосистема. В. И. Вернадский — основоположник учения о биосфере. Роль человека в биосфере. Экологические проблемы, их влияние на жизнь человека. Последствия деятельности человека в экосистемах, влияние его поступков на живые организмы и экосистемы.
Демонстрации: таблицы, иллюстрирующие структуру биосферы; схема круговорота веществ и превращения энергии в биосфере; схема влияния хозяйственной деятельности человека на природу; модель-аппликация «Биосфера и человек»; карты заповедников России.
Лабораторная работа.
• Анализ и оценка влияния факторов окружающей среды, факторов риска на здоровье, последствий деятельности человека в экосистемах, собственных поступков на живые организмы и экосистемы.
Тематическое планирование
| № п/п |
Тема |
Количество часов
|
| 1 | Введение | 3 |
| 2 | Молекулярный уровень | 9 |
| 3 | Клеточный уровень | 10 |
| 4 | Организменный уровень | 14 |
| 5 | Популяционно - видовой | 3 |
| 6 | Экосистемный уровень | 4 |
| 7 | Биосферный уровень | 4 |
| 8 | Основные учения об эволюции | 7 |
| 9 | Происхождение и развитие жизни на Земле | 6 |
| 10 | Основы экологии | 6 |
| | Всего | 66 ч. |
ТРЕБОВАНИЯ К УРОВНЮ ПОДГОТОВКИ ВЫПУСКНИКОВ
ОСНОВНОЙ ШКОЛЫ
В результате изучения биологии учащиеся должны знать/понимать:
признаки биологических объектов: живых организмов; генов и хромосом; клеток и организмов растений, животных, грибов и бактерий; популяций; экосистем и
агроэкосистем; биосферы; растений, животных и грибов своего региона;
сущность биологических процессов: обмена веществ и превращения энергии, питания, дыхания, выделения, транспорта веществ, роста, развития, размножения, наследственности и изменчивости, регуляции жизнедеятельности организма, раздражимости, круговорота
веществ и превращения энергии в экосистемах;
особенности организма человека, его строения, жизнедеятельности, высшей нервной деятельности и поведения;
уметь:
• объяснять: роль биологии в формировании современной естественно-научной картины мира, в практической деятельности людей и самого ученика; родство, общность происхождения и эволюцию растений и животных (на примере сопоставления отдельных групп); роль различных организмов в жизни человека и его деятельности; взаимосвязи организмов и окружающей среды; роль биологического разнообразия в сохранении биосферы; необходимость защиты окружающей среды; родство человека с млекопитающими животными, место и роль человека в природе; взаимосвязи человека и окружающей среды; зависимость здоровья человека от состояния окружающей среды; причины наследственности и изменчивости, проявления наследственных заболеваний, иммунитета у человека; роль гормонов и витаминов в организме;
изучать биологические объекты и процессы: ставить биологические эксперименты, описывать и объяснять результаты опытов; наблюдать за ростом и развитием растений и животных, поведением животных, сезонными изменениями в природе; рассматривать на готовых
микропрепаратах и описывать биологические объекты;
распознавать и описывать: на таблицах основные части и органоиды клетки, органы и системы органов человека; на живых объектах и таблицах органы цветкового растения, органы и системы органов животных, растения разных отделов, животных отдельных типов и классов; наиболее распространенные растения и животных своей местности, культурные растения и домашних животных, съедобные и ядовитые грибы, опасные для человека растения и животных;
выявлять изменчивость организмов, приспособления организмов к среде обитания, типы взаимодействия разных видов в экосистеме;
сравнивать биологические объекты (клетки, ткани, органы и системы органов, организмы, представителей отдельных систематических групп) и делать выводы на основе сравнения;
определять принадлежность биологических объектов к определенной систематической группе (классификация);
анализировать и оценивать воздействие факторов окружающей среды, факторов риска на здоровье человека, последствий деятельности человека в экосистемах, влияние его поступков на живые организмы и экосистемы;
проводить самостоятельный поиск биологической информации: находить в тексте учебника отличительные признаки основных систематических групп; в биологических словарях и справочниках — значение биологических терминов; в различных источниках — необходимую информацию о живых организмах (в том числе с использованием информационных технологий);
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
соблюдения мер профилактики заболеваний, вызываемых растениями, животными, бактериями, грибами и вирусами, а также травматизма, стрессов, ВИЧ-инфекции, вредных привычек (курение, алкоголизм, наркомания), нарушения осанки, зрения, слуха, инфекционных и простудных заболеваний;
оказания первой помощи при отравлении ядовитыми грибами, растениями, при укусах животных; при простудных заболеваниях, ожогах, обморожениях, травмах, спасении утопающего;
рациональной организации труда и отдыха, соблюдения правил поведения в окружающей среде;
выращивания и размножения культурных растений и домашних животных, ухода за ними;
проведения наблюдений за состоянием собственного организма.
Виды контроля
Текущий
Тематический
Итоговый
Формы контроля знаний: срезовые и итоговые тестовые, самостоятельные работы; фронтальный и индивидуальный опрос; отчеты по практическим и лабораторным работам.
Критерии и нормы оценки знаний учащихся
Отметка "5" ставится в случае:
1. Знания, понимания, глубины усвоения обучающимся всего объёма программного материала.
2. Умения выделять главные положения в изученном материале, на основании фактов и примеров обобщать, делать выводы, устанавливать межпредметные и внутрипредметные связи, творчески применяет полученные знания в незнакомой ситуации.
3. Отсутствие ошибок и недочётов при воспроизведении изученного материала, при устных ответах устранение отдельных неточностей с помощью дополнительных вопросов учителя, соблюдение культуры письменной и устной речи, правил оформления письменных работ.
Отметка "4":
1. Знание всего изученного программного материала.
2. Умений выделять главные положения в изученном материале, на основании фактов и примеров обобщать, делать выводы, устанавливать внутрипредметные связи, применять полученные знания на практике.
3. Незначительные (негрубые) ошибки и недочёты при воспроизведении изученного материала, соблюдение основных правил культуры письменной и устной речи, правил оформления письменных работ.
Отметка "3" (уровень представлений, сочетающихся с элементами научных понятий):
1. Знание и усвоение материала на уровне минимальных требований программы, затруднение при самостоятельном воспроизведении, необходимость незначительной помощи преподавателя.
2. Умение работать на уровне воспроизведения, затруднения при ответах на видоизменённые вопросы.
3. Наличие грубой ошибки, нескольких негрубых при воспроизведении изученного материала, незначительное несоблюдение основных правил культуры письменной и устной речи, правил оформления письменных работ.
Отметка "2":
1. Знание и усвоение материала на уровне ниже минимальных требований программы, отдельные представления об изученном материале.
2. Отсутствие умений работать на уровне воспроизведения, затруднения при ответах на стандартные вопросы.
3. Наличие нескольких грубых ошибок, большого числа негрубых при воспроизведении изученного материала, значительное несоблюдение основных правил культуры письменной и устной речи, правил оформления письменных работ.
Оценка выполнения практических (лабораторных) работ
Отметка "5" ставится, если ученик:
1) правильно определил цель опыта;
2) выполнил работу в полном объеме с соблюдением необходимой последовательности проведения опытов и измерений;
3) самостоятельно и рационально выбрал и подготовил для опыта необходимое оборудование, все опыты провел в условиях и режимах, обеспечивающих получение результатов и выводов с наибольшей точностью;
4) научно грамотно, логично описал наблюдения и сформулировал выводы из опыта. В представленном отчете правильно и аккуратно выполнил все записи, таблицы, рисунки, графики, вычисления и сделал выводы;
5) проявляет организационно-трудовые умения (поддерживает чистоту рабочего места и порядок на столе, экономно использует расходные материалы).
7) эксперимент осуществляет по плану с учетом техники безопасности и правил работы с материалами и оборудованием.
Отметка "4" ставится, если ученик выполнил требования к оценке "5", но:
1. опыт проводил в условиях, не обеспечивающих достаточной точности измерений;
2. или было допущено два-три недочета;
3. или не более одной негрубой ошибки и одного недочета,
4. или эксперимент проведен не полностью;
5. или в описании наблюдений из опыта допустил неточности, выводы сделал неполные.
Отметка "3" ставится, если ученик:
1. правильно определил цель опыта; работу выполняет правильно не менее чем наполовину, однако объём выполненной части таков, что позволяет получить правильные результаты и выводы по основным, принципиально важным задачам работы;
2. или подбор оборудования, объектов, материалов, а также работы по началу опыта провел с помощью учителя; или в ходе проведения опыта и измерений были допущены ошибки в описании наблюдений, формулировании выводов;
3. опыт проводился в нерациональных условиях, что привело к получению результатов с большей погрешностью; или в отчёте были допущены в общей сложности не более двух ошибок (в записях единиц, измерениях, в вычислениях, графиках, таблицах, схемах, и т.д.) не принципиального для данной работы характера, но повлиявших на результат выполнения;
4. допускает грубую ошибку в ходе эксперимента (в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с материалами и оборудованием), которая исправляется по требованию учителя.
Отметка "2" ставится, если ученик:
1. не определил самостоятельно цель опыта; выполнил работу не полностью, не подготовил нужное оборудование и объем выполненной части работы не позволяет сделать правильных выводов;
2. или опыты, измерения, вычисления, наблюдения производились неправильно;
3. или в ходе работы и в отчете обнаружились в совокупности все недостатки, отмеченные в требованиях к оценке "3";
4. допускает две (и более) грубые ошибки в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые не может исправить даже по требованию учителя.
Оценка самостоятельных письменных и контрольных работ
Отметка "5" ставится, если ученик:
1. выполнил работу без ошибок и недочетов;
2) допустил не более одного недочета.
Отметка "4" ставится, если ученик выполнил работу полностью, но допустил в ней:
1. не более одной негрубой ошибки и одного недочета;
2. или не более двух недочетов.
Отметка "3" ставится, если ученик правильно выполнил не менее 2/3 работы или допустил:
1. не более двух грубых ошибок;
2. или не более одной грубой и одной негрубой ошибки и одного недочета;
3. или не более двух-трех негрубых ошибок;
4. или одной негрубой ошибки и трех недочетов;
5. или при отсутствии ошибок, но при наличии четырех-пяти недочетов.
Отметка "2" ставится, если ученик:
1. допустил число ошибок и недочетов превосходящее норму, при которой может быть выставлена оценка "3";
2. или если правильно выполнил менее половины работы.
Просмотр содержимого документа
«РП БИОЛОГИЯ 10-11 класс»

ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Статус документа. Программа по биологии составлена на основе Основной образовательной Программы и учебного плана МБОУ «Сарагашская сош» на 2016 – 2017 уч. год и соответствует Федеральному Положению Государственного образовательного стандарта.
Место предмета в учебном плане. Рабочая Программа по биологии 10 – 11 классов составлена на основе учебного плана МБОУ «Сарагашская сош» на 2016– 2017 уч. год и ООП полного среднего образования: 67 часов (1 час в неделю в 10 классе - 34 ч., 1 час в неделю в 11 классе - 33 ч).
Рабочая программа ориентирована на использование учебника А.А.Каменского, Е.А. Криксунова, В. В.Пасечника Общая биология 10-11 классы - М.: Дрофа, 2012 г.
Цели и задачи программы обучения
Изучение биологии на ступени среднего (полного) общего образования старшей школе в 10 – 11 классах на базовом уровне направлено на достижение следующих целей:
освоение знаний о биологических системах (клетка, организм); истории развития современных представлений о живой природе; выдающихся открытиях в биологической науке; роли биологической науки в формировании современной естественнонаучной картины мира; методах научного познания;
овладение умениями обосновывать место и роль биологических знаний в практической деятельности людей, развитии современных технологий; находить и анализировать информацию о живых объектах;
развитие познавательных интересов, интеллектуальных и творческих способностей в процессе изучения выдающихся достижений биологии, вошедших в общечеловеческую культуру; сложных и противоречивых путей развития современных научных взглядов, идей, теорий, концепций в ходе работы с различными источниками информации;
воспитание убежденности в возможности познания живой природы, необходимости бережного отношения к природной среде, собственному здоровью; уважения к мнению оппонента при обсуждении биологических проблем;
использование приобретенных знаний и умений в повседневной жизни для оценки последствий своей деятельности по отношению к окружающей среде, здоровью других людей и собственному здоровью; обоснования и соблюдения мер профилактики заболеваний, правил поведения в природе.
Общая характеристика учебного предмета:
Курс биологии на ступени среднего (полного) общего образования на базовом уровне направлен на формирование у учащихся знаний о живой природе, ее отличительных признаках – уровневой организации и эволюции, поэтому программа включает сведения об общих биологических закономерностях, проявляющихся на разных уровнях организации живой природы. Основу отбора содержания на базовом уровне составляет культуросообразный подход, в соответствии с которым учащиеся должны освоить знания и умения, значимые для формирования общей культуры, определяющие адекватное поведение человека в окружающей среде, востребованные в жизни и практической деятельности. В связи с этим на базовом уровне в программе особое внимание уделено содержанию, лежащему в основе формирования современной естественнонаучной картины мира. Основу структурирования содержания курса биологии в старшей школе на базовом уровне составляют ведущие идеи – отличительные особенности живой природы, ее уровневая организация и эволюция. В соответствии с ними выделены содержательные линии курса: «Биология как наука. Методы научного познания», «Клетка», «Организм», «Основы учения об эволюции»; «Антропогенез»; «Основы экологии»; «Эволюция биосферы и человека».
Изучение биологии в средней школе продолжается по 3 варианту концентрической программы (автор В.В.Пасечник), которая является логическим продолжением программы по биологии основной школы. Таким образом, соблюдается преемственность в изучением биологии между основной и средней (полной) школой.
Для приобретения практических навыков и повышения уровня знаний в рабочую программу включены лабораторные и практические работы, предусмотренные программой В.В.Пасечника. При выполнении практических и лабораторных работ изучаются живые биологические объекты, микропрепараты, гербарии, коллекции и т.д. Выполнение практической работы направлено на формирование общеучебных умений, а также умений учебно-познавательной деятельности.
С целью более глубокого усвоения учебного материала и качественной подготовки к ЕГЭ введен компонент образовательного учреждения по биологии, из расчета 1 час в неделю. Компонент ОУ включает в себя темы, выделенные в тематическом планировании Федерального компонента, и представляет тем самым поддерживающий курс, расширяющий кругозор учащихся и углубляющий знания по данным темам, позволяющий более качественно отработать, обобщить и закрепить материал.
Важным моментом в процессе изучения курса «Общей биологии» на ступени старшей школы является развитие интеллектуальных способностей учащихся, так как резко увеличивающийся поток информации требует умения извлекать наиболее существенные знания, переносить в новую ситуацию.
Глубокому усвоению знаний способствуют организация работы с цифровыми образовательными ресурсами, научно-популярной литературой, система повторения и закрепления, разработанная с учётом индивидуальных особенностей школьников, разнообразные разноуровневые формы контроля: тестовые, кратковременные письменные работы, решение логических задач.
УЧЕБНО-МЕТОДИЧЕСКИЙ КОМПЛЕКТ
1. А.А.Каменского, Е.А.Криксунова, В. В.Пасечника Общая биология 10 классы - Волгоград.: «Учитель», И.В. Лысенко, 2009 г.
2. Г.В.Чередникова Биология 11 класс: поурочные планы по учебнику А.А.Каменского, Е.А.Криксунова, В.В.Пасечника – Волгоград: Учитель,2009.
Содержание учебного курса 10 класс
(34 часов, 1 час в неделю)
Раздел 1
Введение. (2часа)
Тема 1.1.
Краткая история развития биологии.
Методы исследования в биологии (2 часа)
Объект изучения биологии — живая природа. Краткая история развития биологии. Методы исследования в биологии. Роль биологических теорий, идей, гипотез в формировании современной естественнонаучной картины мира.
Тема 1.2.
Сущность жизни и свойства живого.
Уровни организации живой материи (2 часа)
Сущность жизни и свойства живого. Уровни организации живой материи. Биологические
системы. Методы познания живой природы.
Демонстрации
Портреты ученых. Схемы: «Связь биологии с другими науками», «Система биологических наук», «Биологические системы», «Уровни организации живой природы», «Свойства живой материи», «Методы познания живой природы».
Раздел 2
Основы цитологии (14 часов)
Тема 2.1.
Методы цитологии. Клеточная теория (1 час)
Развитие знаний о клетке (Р. Гук, Р. Вирхов,К. Бэр, М. Шлейден и Т. Шванн). Клеточная теория и ее основные положения. Роль клеточной теории в становлении современной естественнонаучной картины мира. Методы цитологии.
Тема 2.2.
Химический состав клетки (5 часов)
Химический состав клетки. Неорганические и органические вещества и их роль в клетке.
Тема 2.3.
Строение клетки (3 часа)
Строение клетки. Основные части и органоиды клетки, их функции; эукариотические и прокариотические клетки. Строение и функции хромосом.
Тема 2.4.
Реализация наследственной информации в клетке (1 час)
ДНК — носитель наследственной информации. Удвоение молекулы ДНК в клетке. Значение постоянства числа и формы хромосом в клетках. Ген. Генетический код. Роль генов в биосинтезе белка.
Тема 2.5.
Вирусы (1 час)
Вирусы. Особенности строения и размножения. Значение в природе и жизни человека. Меры профилактики распространения вирусных заболеваний. Профилактика СПИДа.
Демонстрации
Схемы, таблицы, фрагменты видеофильмов и компьютерных программ: «Строение молекулы белка», «Строение молекулы ДНК», «Строение молекулы РНК», «Строение клетки», «Строение клеток прокариот и эукариот», «Строение вируса», «Хромосомы», «Характеристика гена», «Удвоение молекулы ДНК».
Лабораторные и практические работы
Наблюдение клеток растений и животных под микроскопом на готовых микропрепаратах и их описание.
Сравнение строения клеток растений и животных.
Приготовление и описание микропрепаратов клеток растений.
Раздел 3
Размножение и индивидуальное развитие организмов (6 часов)
Тема 3.1.
Организм — единое целое.
Многообразие живых организмов (1 час)
Организм — единое целое. Многообразие организмов. Одноклеточные, многоклеточные и колониальные организмы.
Тема 3.2.
Обмен веществ и превращения энергии —
свойство живых организмов (2 часа)
Обмен веществ и превращения энергии — свойство живых организмов. Особенности обмена веществ у растений, животных, бактерий.
Тема 3.3.
Размножение (4 часа)
Размножение — свойство организмов. Деление клетки — основа роста, развития и размножения организмов. Половое и бесполое размножение. Оплодотворение, его значение. Искусственное опыление у растений и оплодотворение у животных.
Тема 3.4.
Индивидуальное развитие организма
(онтогенез) (2 часа)
Индивидуальное развитие организма (онтогенез). Причины нарушений развития организмов. Индивидуальное развитие человека. Репродуктивное здоровье. Последствия влияния алкоголя, никотина, наркотических веществ на развитие зародыша человека.
Тема 3.5.
Раздел 4
Основы генетики (9 часов)
Наследственность и изменчивость - свойства организмов. Генетика — наука о закономерностях наследственности и изменчивости. Г. Мендель - основоположник генетики. Генетическая терминология и символика. Закономерности наследования, установленные Г. Менделем. Хромосомная теория наследственности. Современные представления о гене и геноме. Наследственная и ненаследственная изменчивость. Влияние мутагенов на организм человека. Значение генетики для медицины и селекции. Наследование признаков у человека. Половые хромосомы. Сцепленное с полом наследование. Наследственные болезни человека, их причины и профилактика.
Тема 3.6.
Генетика — теоретическая основа селекции.
Раздел 5
Генетика человека (2 часа)
Генетика — теоретическая основа селекции. Селекция. Учение Н. И. Вавилова о центрах многообразия и происхождения культурных растений. Основные методы селекции: гибридизация, искусственный отбор. Биотехнология, ее достижения, перспективы развития. Этические аспекты развития некоторых исследований в биотехнологии (клонирование че_
ловека).
Демонстрация
Схемы, таблицы, фрагменты видеофильмов и компьютерных программ: «Многообразие организмов», «Обмен веществ и превращения энергии в клетке», «Фотосинтез», «Деление клетки (митоз, мейоз)», «Способы бесполого размножения», «Половые клетки», «Оплодотворение у растений и животных», «Индивидуальное развитие организма», «Моногибридное скрещивание», «Дигибридное скрещивание», «Перекрест хромосом», «Неполное доминирование», «Сцепленное наследование», «Наследование, сцепленное с полом», «Наследственные болезни человека», «Влияние алкоголизма, наркомании, курения на наследственность», «Мутации», «Модификационная изменчивость», «Центры многообразия и происхождения культурных растений», «Искусственный отбор», «Гибридизация», «Исследования в области биотехнологии».
Лабораторные и практические работы
Выявление признаков сходства зародышей человека и других млекопитающих как доказательство их родства.
Составление простейших схем скрещивания.
Решение элементарных генетических задач.
Выявление источников мутагенов в окружающей среде (косвенно) и оценка возможных последствий их влияния на организм.
Требования к уровню подготовки учащихся
В результате изучения биологии на базовом уровне в 10 классе ученик должен
знать /понимать
основные положения биологических теорий (клеточная); сущность законов Г.Менделя, закономерностей изменчивости;
строение биологических объектов: клетки; генов и хромосом;
сущность биологических процессов: размножение, оплодотворение,
вклад выдающихся ученых в развитие биологической науки;
биологическую терминологию и символику;
уметь
объяснять: роль биологии в формировании научного мировоззрения; вклад биологических теорий в формирование современной естественнонаучной картины мира; единство живой и неживой природы, родство живых организмов; отрицательное влияние алкоголя, никотина, наркотических веществ на развитие зародыша человека; влияние мутагенов на организм человека, экологических факторов на организмы; взаимосвязи организмов и окружающей среды; причины нарушений развития организмов, наследственных заболеваний, мутаций;
решать элементарные биологические задачи; составлять элементарные схемы скрещивания;
выявлять источники мутагенов в окружающей среде (косвенно), антропогенные изменения в экосистемах своей местности;
сравнивать: биологические объекты (химический состав тел живой и неживой природы, процессы (половое и бесполое размножение) и делать выводы на основе сравнения;
анализировать и оценивать глобальные экологические проблемы и пути их решения, последствия собственной деятельности в окружающей среде;
находить информацию о биологических объектах в различных источниках (учебных текстах, справочниках, научно-популярных изданиях, компьютерных базах данных, ресурсах Интернет) и критически ее оценивать;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
соблюдения мер профилактики отравлений, вирусных и других заболеваний, стрессов, вредных привычек (курение, алкоголизм, наркомания); правил поведения в природной среде;
оценки этических аспектов некоторых исследований в области биотехнологии (клонирование, искусственное оплодотворение).
Виды контроля
Текущий
Тематический
Итоговый
Формы контроля знаний: срезовые и итоговые тестовые, самостоятельные работы; фронтальный и индивидуальный опрос; отчеты по практическим и лабораторным работам
ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ
| № п/п |
Наименование раздела, темы |
Количество часов |
| 1 | Введение. Биология как наука. Методы научного познания | 2часа |
| 2 | Основы цитологии | 14 часов |
| 3 | Размножение и индивидуальное развитие организмов | 6 часов |
| 4 | Основы генетики | 9 часов |
| 5 | Генетика человека | 2 часа |
| | Повторение | 1 час |
ИТОГО: 34 часа
Содержание разделов и тем учебного курса 11 класс
(33 часа, один час в неделю)
Основы учения об эволюции (10 ч)
Сущность эволюционного подхода и его методическое значение. Основные признаки биологической эволюции: адаптивность, поступательный характер
Основные проблемы и методы эволюционного учения, его синтетический характер. Основные этапы развития эволюционных идей. Значение данных других наук для доказательства эволюции органического мира. Комплексность методов изучения эволюционного процесса.
Вид. Критерии вида. Видообразование. Понятие микроэволюции. Популяционная структура вида. Популяция как элементарная эволюционная единица. Факторы эволюции и их характеристика. Естественный отбор)— движущая и направляющая сила эволюции. Предпосылки действия естественного отбора. Наследственная гетерогенность особей. Борьба за существование как основа естественного отбора. Механизм действия отбора. Основные формы отбора. Роль естественного отбора в формировании новых свойств, признаков и новых видов. Возникновение адаптации и их относительный характер. Взаимоприспособленность видов как результат действия естественного отбора.
Значение знаний о микроэволюции для управления природными популяциями, решения проблем охраны природы и рационального природопользования
Понятие о макроэволюции. Соотношение микро- и макроэволюции. Макроэволюция и филогенез. Закономерности филогенеза.Главные направления эволюции.
Значение эволюционной теории в практической деятельности человека.
Демонстрация живых растений и животных, гербарных экземпляров, коллекций, показывающих индивидуальную изменчивость и разнообразие сортов культурных растений и пород домашних животных, а также результаты приспособленности организмов к среде обитания и результаты видообразования; примеров гомологичных и аналогичных органов, их строения и происхождения в процессе онтогенеза; схем, иллюстрирующих процессы видообразования и соотношение путей прогрессивной биологической эволюции. Лабораторные работы Изучение приспособленности организмов к среде обитания.Изучение ароморфозов и идиоадаптаций у растений и животных.
Основы селекции и биотехнологии (4 ч)
Задачи и методы селекции. Генетика как научная основа селекции организмов. Исходный материал для селекции. Учение Н. И. Вавилова о центрах происхождения культурных растений. Порода, сорт, штамм. Селекция растений и животных. Искусственный отбор в селекции. Гибридизация как метод в селекции. Типы скрещиваний. Полиплоидия в селекции растений. Достижения современной селекции.
Микроорганизмы, грибы, прокариоты как объекты биотехнологии. Селекция микроорганизмов, ее значение для микробиологической промышленности. Микробиологическое производство пищевых продуктов, витаминов, ферментов, лекарств и т. д. Проблемы и перспективы биотехнологии. Генная и клеточная инженерия, ее достижения и перспективы. Демонстрация живых растений, гербарных экземпляров, муляжей, таблиц, фотографий, иллюстрирующих появление новых сортов растений и пород животных.
Антропогенез (4 ч)
Место человека в системе органического мира.
Доказательства происхождения человека от животных. Движущие силы антропогенеза. Биологические и социальные факторы антропогенеза. Основные направления эволюции человека. Прародина человечества. Расы человека.
Популяционная структура вида Homo sapiens. Развитие материальной и духовной культуры, преобразование природы. Факторы эволюции современной эволюции человека.
Влияние деятельности человека на биосферу Демонстрация моделей скелетов человека, модели «Этапы развития человека»
Основы экологии (12 ч)
Абиотические факторы среды. Роль температуры, освещенности, влажности и других факторов в жизнедеятельности сообществ. Интенсивность действия фактора среды; ограничивающий фактор. Взаимодействие факторов среды, пределы выносливости. Адаптации организмов. Биотические факторы среды. Формы взаимоотношений между организмами. Позитивные отношения — симбиоз: мутуализм, кооперация, комменсализм. Антибиотические отношения: хищничество, паразитизм, конкуренция. Нейтральные отношения — нейтрализм. Экосистема, её структура. Учение В. Н. Сукачёвым учения о биогеоценозе. Популяция - основная единица биогеоценоза. Агроэкосистемы.
Практическая работа Составление цепей питания, схем пищевых связей в экосистеме.
Эволюция биосферы и человек (3 ч)
Взгляды, гипотезы и теории о происхождении жизни. Органический мир как результат эволюции. Краткая история развития органического мира. Основные ароморфозы в эволюции органического мира. Основные НАправления эволюции различных групп растений и животных. Филогенетические связи в живой природе. Современные классификации живых организмов.
Учение В. И. Вернадского о биосфере. Круговорот веществ и энергетические процессы в биосфере. Место и роль человека в биосфере. Антропогенное воздействие на биосферу. Понятие о ноосфере. Ноосферное мышление. Международные и национальные программы оздоровления природной среды.
Демонстрация окаменелостей, отпечатков растений и животных в древних породах; репродукций картин, отражающих флору и фауну различных эр и периодов, таблиц, иллюстрирующих структуру биосферы; схем круговорота веществ и превращения энергии в биосфере; влияния хозяйственной деятельности человека на природу.
Требования к уровню подготовки.
В результате обучения ученики 11 класса должны:
характеризовать (описывать) основные уровни организации живой природы; основные положения клеточной
теории; химический состав клетки, роль белков, нуклеиновых кислот, АТФ, липидов, воды и других неорганических веществ в жизни клетки и организмов; строение и функции гена, генетический код; строение и функции клеток прокариот и эукариот, автотрофов и гетеротрофов, особенности строения и функционирования вирусов; энергетический и пластический обмен, их значение, особенности пластического обмена у растений, их космическую (планетарную) роль; роль ферментов в обмене веществ; бесполое и половое размножение организмов; хромосомы, их роль в хранении и передаче наследственной информации; значение видового постоянства числа, формы и размеров хромосом; митоз, мейоз, оплодотворение и их значение; онтогенез, зародышевое и послезародышевое развитие; основную генетическую терминологию и символику; методы генетики, особенности методов изучения генетики человека; законы наследственности, модификационную, мутационную и комбинативную изменчивость, их причины; норму реакции; значение генотипа и условий среды в формировании фенотипа, мутаций в эволюции, генетики для селекции и здравоохранения; экосистемы и агроэкосистемы, их структурные компоненты; причины колебания численности популяций, регуляцию численности как основу сохранения популяций, саморегуляцию; пищевые и территориальные связи между популяциями разных видов в экосистеме, их значение; правила экологической пирамиды; круговорот веществ в экосистеме, его значение, причины устойчивости и смены экосистем; биосферу как глобальную экосистему, учение В.И.Вернадского о биосфере и ноосфере; значение живого вещества (биомассы) в круговороте веществ и потоке энергии; влияние хозяйственной деятельности человека на
экосистемы, биосферу; меры, направленные на их сохранение; учение Ч.Дарвина об эволюции, его развитие; движущие силы эволюции, причины многообразия видов и приспособленности организмов к среде обитания; возникновение жизни на Земле, эволюцию органического мира, ее основные направления, основные ароморфозы в эволюции растительного и животного мира, причины вымирания видов; происхождение человека, движущие силы антропогенеза; вид, его критерии, популяцию как структурную единицу вида и единицу эволюции; основные царства живой природы; учение Н.И.Вавилова о селекции, центрах происхождения и многообразия культурных растений; методы выведения сортов растений и пород животных; роль биотехнологии в селекции растений;
сравнивать (распознавать, узнавать, определять) строение клеток автотрофов и гетеротрофов, прокариот и эукариот; митоз и мейоз; способы размножения организмов; фенотипы и генотипы, гомо и гетерозиготы, мутационную и модификационную изменчивость организмов; экосистемы и агроэкосистемы;
обосновывать (объяснять, сопоставлять, делать выводы) значение мутаций для эволюции, законов генетики для селекции; роль пищевых связей, ярусного расположения организмов, круговорота веществ, разнообразия видов в экосистеме, меры регулирования^ численности популяций, сохранения видов, экосистем; влияние антропогенного фактора на виды, экосистемы, биосферу, меры их охраны; роль организмов - продуцентов, консументов, редуцентов - и человека в агроэкосистемах; роль многообразия видов, популяций, круговорота веществ в сохранении равновесия в экосистемах, в биосфере; использование достижений биотехнологии в народном хозяйстве для охраны природы; роль заповедников, заказников, национальных парков, ботанических и зоологических садов в сохранении биологического разнообразия, равновесия в биосфере; схемы пищевых цепей, круговорота веществ;
применять знания по биологии для оценки состояния окружающей среды своего региона; о движущих силах эволюции; объяснения процессов возникновения приспособлений и образования новых видов; исторического развития органического мира; клеточной теории - для доказательства единства органического мира; генетической терминологии при составлении схем скрещиваний, решении задач;
овладевать умениями пользоваться предметными именными указателями при работе с научной и популярной литературой; составлять развернутый план - тезисы текста, конспектировать текст, готовить рефераты; сопоставлять схемы, таблицы на основе работы с текстом учебника.
Требования к уровню подготовки выпускников
В результате изучения биологии на базовом уровне ученик должен:
знать /понимать
основные положения биологических теорий (клеточная); сущность законов Г. Менделя, закономерностей изменчивости,
эволюционная теория Ч.Дарвина, учение В.И. Вернадского о биосфере;
строение биологических объектов: клетки; генов и хромосом;
сущность биологических процессов: размножение, оплодотворение,
вклад выдающихся ученых в развитие биологической науки;
биологическую терминологию и символику;
уметь
объяснять: роль биологии в формировании научного мировоззрения; вклад биологических теорий в формирование современной естественнонаучной картины мира; единство живой и неживой природы, родство живых организмов; отрицательное влияние алкоголя, никотина, наркотических веществ на развитие зародыша человека; влияние мутагенов на организм человека, причины нарушений развития организмов, наследственных заболеваний, мутаций; взаимосвязи организмов и окружающей среды; причины эволюции, изменяемости видов, устойчивости и смены экосистем; необходимость сохранения многообразия видов;
решать элементарные биологические задачи; составлять элементарные схемы скрещивания;
выявлять источники мутагенов в окружающей среде (косвенно);
сравнивать: биологические объекты (химический состав тел живой и неживой природы, зародыши человека и других млекопитающих), процессы (половое и бесполое размножение) и делать выводы на основе сравнения;
анализировать и оценивать различные гипотезы сущности жизни, последствия собственной деятельности в окружающей среде;
находить информацию о биологических объектах в различных источниках (учебных текстах, справочниках, научно-популярных изданиях, компьютерных базах данных, интернет-ресурсах) и критически ее оценивать;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для: соблюдения мер профилактики отравлений, вирусных и других заболеваний, стрессов, вредных привычек (курение, алкоголизм, наркомания); правил поведения в природной среде;
оказания первой помощи при простудных и других заболеваниях, отравлении пищевыми продуктами;
оценки этических аспектов некоторых исследований в области биотехнологии (клонирование, искусственное оплодотворение).
Виды контроля
Текущий
Тематический
Итоговый
Формы контроля знаний: срезовые и итоговые тестовые, самостоятельные работы; фронтальный и индивидуальный опрос; отчеты по практическим и лабораторным работам
Тематическое планирование 11 класс
| № п/п | Наименование темы | Количество часов | |
| 1 | Основы учения об эволюции | 10 | |
| 2 | Основы селекции и биотехнологии | 4 | |
| 3 | Антропогенез | 4 | |
| 4 | Основы экологии | 12 | |
| 5 | Эволюция и биосфера человека | 3 | |
|
| ИТОГО: | 33 часа | |
|
| Зачётов | 2 | |
| Лабораторных | 3 | ||
| Практических | 1 | ||
Оценочная деятельность
Оценка устного ответа учащихся
Отметка "5" ставится в случае:
1. Знания, понимания, глубины усвоения обучающимся всего объёма программного
материала.
Умения выделять главные положения в изученном материале, на основании фактов и примеров обобщать, делать выводы, устанавливать межпредметные и внутрипредметные связи, творчески применяет полученные знания в незнакомой ситуации.
Отсутствие ошибок и недочётов при воспроизведении изученного материала, при устных ответах устранение отдельных неточностей с помощью дополнительных вопросов учителя, соблюдение культуры устной речи.
Отметка "4":
1. Знание всего изученного программного материала.
Умений выделять главные положения в изученном материале, на основании фактов и примеров обобщать, делать выводы, устанавливать внутрипредметные связи, применять полученные знания на практике.
Незначительные (негрубые) ошибки и недочёты при воспроизведении изученного материала, соблюдение основных правил культуры устной речи.
Отметка "3" (уровень представлений, сочетающихся с элементами научных понятий):
Знание и усвоение материала на уровне минимальных требований программы, затруднение при самостоятельном воспроизведении, необходимость незначительной помощи преподавателя.
Умение работать на уровне воспроизведения, затруднения при ответах на видоизменённые вопросы.
Наличие грубой ошибки, нескольких негрубых при воспроизведении изученного материала, незначительное несоблюдение основных правил культуры устной речи.
Отметка "2":
Знание и усвоение материала на уровне ниже минимальных требований программы, отдельные представления об изученном материале.
Отсутствие умений работать на уровне воспроизведения, затруднения при ответах на стандартные вопросы.
Наличие нескольких грубых ошибок, большого числа негрубых при воспроизведении изученного материала, значительное несоблюдение основных правил культуры устной речи.
Оценка выполнения практических (лабораторных) работ
Отметка "5" ставится, если ученик:
1. Правильно определил цель опыта.
2. Выполнил работу в полном объеме с соблюдением необходимой последовательности
проведения опытов и измерений.
3. Самостоятельно и рационально выбрал и подготовил для опыта необходимое
оборудование, все опыты провел в условиях и режимах, обеспечивающих получение
результатов и выводов с наибольшей точностью.
Научно грамотно, логично описал наблюдения и сформулировал выводы из опыта. В представленном отчете правильно и аккуратно выполнил все записи, таблицы, рисунки, графики, вычисления и сделал выводы.
Проявляет организационно-трудовые умения (поддерживает чистоту рабочего места и порядок на столе, экономно использует расходные материалы).
Эксперимент осуществляет по плану с учетом техники безопасности и правил работы с материалами и оборудованием.
Отметка "4" ставится, если ученик:
Опыт проводил в условиях, не обеспечивающих достаточной точности измерений.
Или было допущено два-три недочета.
Или не более одной негрубой ошибки и одного недочета.
4. Или эксперимент проведен не полностью.
5. Или в описании наблюдений из опыта допустил неточности, выводы сделал неполные. Отметка "3" ставится, если ученик:
1. Правильно определил цель опыта; работу выполняет правильно не менее чем
наполовину, однако объём выполненной части таков, что позволяет получить правильные
результаты и выводы по основным, принципиально важным задачам работы.
Или подбор оборудования, объектов, материалов, а также работы по началу опыта провел с помощью учителя; или в ходе проведения опыта и измерений были допущены ошибки в описании наблюдений, формулировании выводов.
Опыт проводился в нерациональных условиях, что привело к получению результатов с большей погрешностью; или в отчёте были допущены в общей сложности не более двух ошибок (в записях единиц, измерениях, в вычислениях, графиках, таблицах, схемах, и т.д.) не принципиального для данной работы характера, но повлиявших на результат выполнения.
Допускает грубую ошибку в ходе эксперимента (в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с материалами и оборудованием), которая исправляется по требованию учителя.
Отметка "2" ставится, если ученик:
1. Не определил самостоятельно цель опыта; выполнил работу не полностью, не
подготовил нужное оборудование и объем выполненной части работы не позволяет
сделать правильных выводов.
2. Или опыты, измерения, вычисления, наблюдения производились неправильно.
Или в ходе работы и в отчете обнаружились в совокупности все недостатки, отмеченные в требованиях к оценке "3".
Допускает две (и более) грубые ошибки в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые не может исправить даже по требованию учителя.
Оценка самостоятельных письменных и контрольных работ.
Отметка "5" ставится, если ученик:
1. Выполнил работу без ошибок и недочетов.
2. Допустил не более одного недочета.
Отметка "4" ставится, если ученик выполнил работу полностью, но допустил в ней:
Не более одной негрубой ошибки и одного недочета.
Или не более двух недочетов.
Отметка "3й ставится, если ученик правильно выполнил не менее 2/3 работы или допустил:
Не более двух грубых ошибок.
Или не более одной грубой и одной негрубой ошибки и одного недочета.
Или не более двух-трех негрубых ошибок.
Или одной негрубой ошибки и трех недочетов.
Или при отсутствии ошибок, но при наличии четырех-пяти недочетов. Отметка "2" ставится, если ученик:
Допустил число ошибок и недочетов превосходящее норму, при которой может быть выставлена оценка "3".
Или если правильно выполнил менее половины работы.















