Просмотр содержимого документа
«Растворы. Презентация к уроку»

Тема: Растворы.
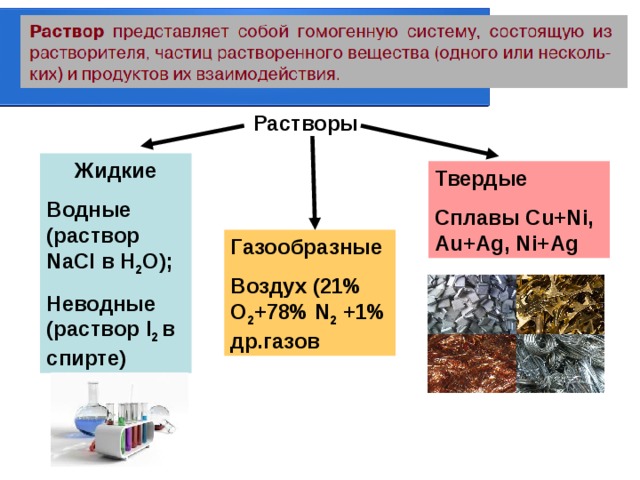
Растворы
Жидкие
Водные (раствор NaCl в H 2 O) ;
Неводные (раствор I 2 в спирте)
Твердые
Сплавы Cu+Ni, Au+Ag, Ni+Ag
Газообразные
Воздух (21% О 2 +78% N 2 +1% др.газов

Растворение веществ
Процесс растворения — сложный физико-химический процесс, при котором происходит взаимодействие частиц растворяемого вещества и растворителя.
- Разрушение структуры растворяемого вещества и распределение его частиц между молекулами растворителя – это физический процесс.
- Взаимодействие молекул растворителя с частицами растворенного вещества- химический процесс
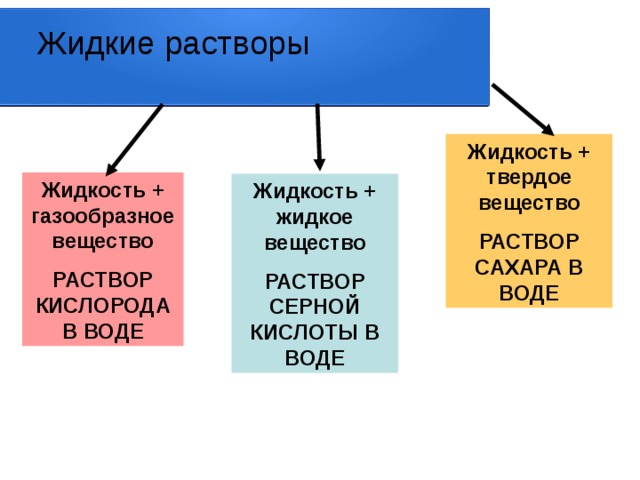
Жидкие растворы
Жидкость + твердое вещество
РАСТВОР САХАРА В ВОДЕ
Жидкость + газообразное вещество
РАСТВОР КИСЛОРОДА В ВОДЕ
Жидкость + жидкое вещество
РАСТВОР СЕРНОЙ КИСЛОТЫ В ВОДЕ

ЖИДКИЕ РАСТВОРЫ
- Неводные - растворителем являются другие жидкости (бензол, спирт, эфир и др.
- Водные – растворителем является вода


Растворимость вещества зависит от:
- Природы растворенного вещества
- Температуры
- Давления (для газов)
Растворимость газов при повышении температуры уменьшается, при повышении давления увеличивается
 10 г вещества в 1л воды) Например: сахар в 1 л воды растворяется 2000 г Практически нерастворимые (Н) ( 0,01 г вещества в 1 л воды) Например: AgCl в 1 л воды растворяется 1,5∙10 -3 г Малорастворимые (М) (от 0,01 до 10 г в 1 л воды) Например: гипс CaSO 4 ∙2H 2 O в 1 л воды растворяется 2 г " width="640"
10 г вещества в 1л воды) Например: сахар в 1 л воды растворяется 2000 г Практически нерастворимые (Н) ( 0,01 г вещества в 1 л воды) Например: AgCl в 1 л воды растворяется 1,5∙10 -3 г Малорастворимые (М) (от 0,01 до 10 г в 1 л воды) Например: гипс CaSO 4 ∙2H 2 O в 1 л воды растворяется 2 г " width="640"
Коэффициент растворимости показывает, какая максимальная масса вещества может раствориться в 1000 мл растворителя при данной температуре
Вещества (растворимость в воде 20 º С)
Хорошо растворимые (Р) ( 10 г вещества в 1л воды)
Например: сахар в 1 л воды растворяется 2000 г
Практически нерастворимые (Н) ( 0,01 г вещества в 1 л воды)
Например: AgCl в 1 л воды растворяется 1,5∙10 -3 г
Малорастворимые (М) (от 0,01 до 10 г в 1 л воды)
Например: гипс CaSO 4 ∙2H 2 O в 1 л воды растворяется 2 г
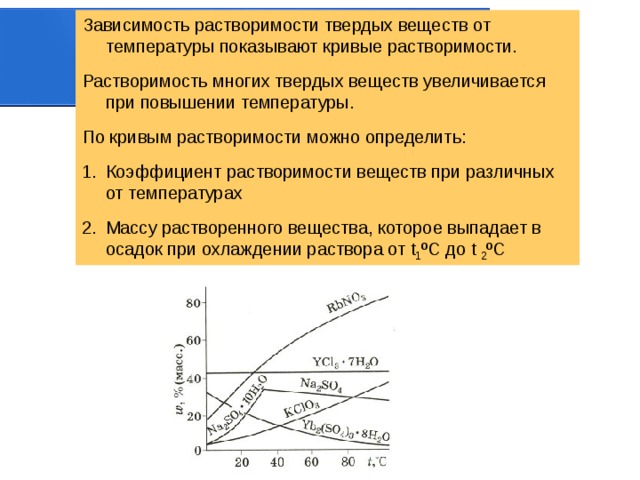
Зависимость растворимости твердых веществ от температуры показывают кривые растворимости.
Растворимость многих твердых веществ увеличивается при повышении температуры.
По кривым растворимости можно определить:
- Коэффициент растворимости веществ при различных от температурах
- Массу растворенного вещества, которое выпадает в осадок при охлаждении раствора от t 1 ºC до t 2 ºC
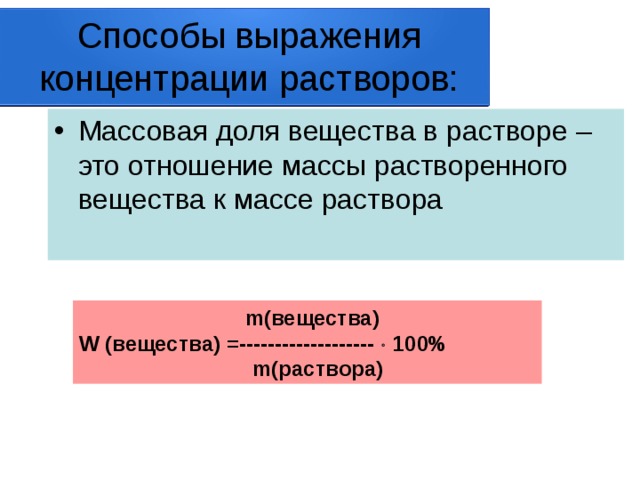
Способы выражения концентрации растворов:
- Массовая доля вещества в растворе – это отношение массы растворенного вещества к массе раствора
m (вещества)
W (вещества) =------------------- 100%
m (раствора)
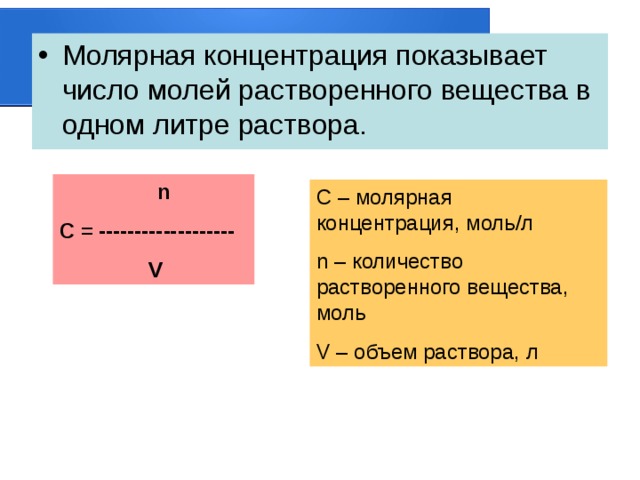
- Молярная концентрация показывает число молей растворенного вещества в одном литре раствора.
n
С = -------------------
V
C – молярная концентрация, моль/л
n – количество растворенного вещества, моль
V – объем раствора, л














 10 г вещества в 1л воды) Например: сахар в 1 л воды растворяется 2000 г Практически нерастворимые (Н) ( 0,01 г вещества в 1 л воды) Например: AgCl в 1 л воды растворяется 1,5∙10 -3 г Малорастворимые (М) (от 0,01 до 10 г в 1 л воды) Например: гипс CaSO 4 ∙2H 2 O в 1 л воды растворяется 2 г " width="640"
10 г вещества в 1л воды) Например: сахар в 1 л воды растворяется 2000 г Практически нерастворимые (Н) ( 0,01 г вещества в 1 л воды) Например: AgCl в 1 л воды растворяется 1,5∙10 -3 г Малорастворимые (М) (от 0,01 до 10 г в 1 л воды) Например: гипс CaSO 4 ∙2H 2 O в 1 л воды растворяется 2 г " width="640"













