Контрольная работа № 3 по теме: Вещества и их свойства
Вариант 1
1. Расположите в порядке усиления металлических свойств следующие знаки химических элементов: Po, O, S, Te, Se. Обоснуйте полученный ряд, исходя из строения атомов этих элементов.
2. Исходя из различных признаков классификации кислот, дайте полную характеристику серной кислоте. (1б)
3. С какими из перечисленных формул веществ может вступать в химическое взаимодействие гидроксид натрия: Mg, H2SO4, CaO, FeCl3, SO2.
Напишите уравнения реакций.
4. В схеме реакции расставьте коэффициенты методом электронного баланса:
HBr + H2SO4 → Br2 + SO2 + H2O
Укажите окислитель и восстановитель.
5. На полную нейтрализацию 110 г раствора серной кислоты потребовалось 80 г 10% раствора гидроксида натрия. Рассчитайте массовую долю кислоты в исходном растворе.
Контрольная работа № 3 по теме: Вещества и их свойства
Вариант 2
1. Расположите в порядке усиления неметаллических свойств следующие знаки химических элементов: O, F, Be, Li, B, C, N. Обоснуйте полученный ряд, исходя из строения атомов этих элементов.
2. Исходя из различных признаков классификации кислот, дайте полную характеристику азотной кислоте.
3. С какими из перечисленных формул веществ может вступать в химическое взаимодействие гидроксид натрия: Mg, HNO3, BaO, CuSO4, CO2.
Напишите уравнения реакций.
4. В схеме реакции расставьте коэффициенты методом электронного баланса:
Cu+ HNO3 (конц) → Cu(NO3)2 + NO2 + H2O
Укажите окислитель и восстановитель.
5. На полную нейтрализацию 100 г раствора азотной кислоты потребовалось 70 г 10% раствора гидроксида натрия. Рассчитайте массовую долю кислоты в исходном растворе.







 металлические свойства увеличиваются, так как увеличивается
металлические свойства увеличиваются, так как увеличивается 
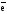 Br
Br неметаллические свойства увеличиваются, так как уменьшается
неметаллические свойства увеличиваются, так как уменьшается