| Урок. Периодический закон и периодическая система химических элементов
Д.И.Менделеева. 8 класс Эпиграф на доске. «Периодическому закону будущее не грозит разрушением, а только надстройка и развитие обещаются» (Д.И.Менделеев).
Цели. Дать учащимся представление о законе Д.И.Менделеева и о структуре его периодической системы, выявить значение этого закона для развития химии и понимания научной картины мира в целом. Научить школьников работать с таблицей Д.И.Менделеева.
Задачи. Образовательные.
• Сформировать знания о периодическом законе и периодической системе Д.И.Менделеева.
• Научить учащихся работать с периодической системой (уметь определять положение элемента в периодической системе, свойства элемента в зависимости от положения его в периодической системе).
• Продолжить формирование умений работать с учебником, тетрадью. Развивающие.
• Развивать наблюдательность, память (при изучении физического смысла периодического закона и графического его отображения).
• Развивать умение сравнивать (например, сравнение свойств элементов в зависимости от их положения в периодической системе).
• Научить учащихся обобщать и делать выводы. Воспитательные.
• Продолжить формирование мировоззрения учащихся на основе представлений о значении закона Д.И.Менделеева. Методы ведения урока. Словесный (беседа, объяснение, рассказ), наглядный (кодокарты, периодическая система, ребусы), практический (демонстрация опытов).
Тип урока. Комбинированный урок. ХОД УРОКА Актуализация знаний, умений и навыков Учитель. Нам известно, что периодический закон и периодическая система химических элементов были открыты Д.И.Менделеевым. А какие еще ученые внесли свой вклад в классификацию элементов?
Ученик. И.Дёберейнер, Дж.Ньюлендс, А.Шанкуртуа, Л.Мейер (рассказ о работе этих ученых).
Учитель. На какие группы можно разделить все химические элементы?
Ученик. На металлы, неметаллы и амфотерные элементы.
Учитель. У меня на столе стоит набор склянок с различными веществами: сера, железо, фосфор, йод, цинк, алюминий и т. д. Разделите все эти склянки на три группы.
К столу выходит ученик и разделяет, анализируя, все склянки на группы металлов, неметаллов и амфотерных веществ.
Учитель. Где расположены металлы и неметаллы в периодической системе? Приведите примеры.
Ученик. Слева в периодической системе расположены металлы, а справа – неметаллы (приводятся примеры).
Учитель. Какие по свойствам образуются вещества из металлов, неметаллов и амфотерных соединений?
К доске выходит ученик с набором магнитных карточек и составляет схему на доске: K 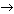 K2O K2O 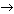 КОН КОН Аl 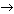 Аl2О3 Аl2О3 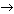 Аl(ОН)3 Аl(ОН)3 P 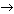 P2O5 P2O5 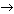 H3PO4 H3PO4 Подтверждается схема с помощью демонстрационного опыта.
Демонстрация опыта. Определяются основности и кислотности гидроксидов с помощью индикаторов. При взаимодействии оксида калия с водой образуется основный гидроксид, что подтверждается действием фенолфталеина; при растворении кислотного оксида фосфора в воде образуется гидроксид кислотного характера, что подтверждается действием лакмуса.
Учитель. Какие естественные семейства выделяются в периодической системе?
Ученик. Например, щелочные металлы, щелочно-земельные металлы, галогены, инертные газы. Изучение нового материала | План 1. Периодический закон. Физический смысл закона.
2. Периодическая система химических элементов.
3. Характеристика элементов в зависимости от положения в периодической системе. | Учитель. Начать изучение периодического закона и периодической системы химических элементов Д.И.Менделеева мне бы хотелось с прочтения стихотворения М.Глазкова
«Таблица Менделеева»: | «Пусть в зимний день
с метелями
Не навещает грусть,
Таблицу Менделеева
Я знаю наизусть.
Зачем ее я выучил?
Могу сказать зачем,
В ней стройность и величие
Любимейших поэм.
| Без многословья книжного
В ней смысла торжество,
И элемента лишнего
В ней нет ни одного.
В ней пробужденье дерева
И вешних льдинок хруст,
Таблицу Менделеева
Я знаю наизусть». |
На прошлом занятии мы с вами говорили о том, что периодичность – это повторяемость через определенный интервал. Почему же свой закон и свою таблицу Менделеев назвал периодической? Чтобы ответить на этот вопрос, необходимо проследить, как изменяются свойства элементов в периодической системе.
Учащиеся открывают таблицу и работают по ней. Все вместе делают вывод о том, что каждый период периодической системы начинается щелочным металлом и заканчивается инертным газом. На доске и в тетради записывают схему: щелочные металлы 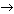 щелочно-земельные металлы щелочно-земельные металлы 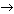 галогены галогены  инертные газы. инертные газы. Учитель. Располагая элементы в порядке возрастания относительной атомной массы, Менделеев наблюдал периодическое изменение их свойств. В 1869 г. он сформулировал закон. Открытие периодического закона – это научный подвиг, который совершил молодой ученый, профессор Петербургского университета. Учитель. Итак, давайте обобщим все то, что сказано, и сделаем выводы о периодичности, которая отражена в периодическом законе и прослеживается в таблице Д.И.Менделеева.
Делаются выводы, которые учащиеся записывают в тетради. Физический смысл периодического закона
1. В ряду от лития до фтора наблюдается постепенное ослабление металлических и усиление неметаллических свойств. 2. С возрастанием относительной атомной массы от лития до углерода валентность увеличивается от одного до четырех.
3. Начиная с натрия, наблюдается повторяемость свойств элементов предыдущего ряда.
Учитель. Периодический закон – величайшее достижение химической науки, основа современной химии. Каждый из нас должен знать формулировку этого закона: свойства простых тел, а также формы и свойства простых и сложных соединений элементов находятся в периодической зависимости от относительных атомных масс элементов.
Теперь давайте немного отдохнем и послушаем о том, каким же человеком был Д.И.Менделеев, чем он занимался, каких еще достиг в науке успехов.
Один из учеников делает доклад на тему «Биография Д.И.Менделеева».
Учитель. На основе периодического закона периодической системы Д.И.Менделеев пришел к выводу о существовании новых, не открытых еще в то время элементов; свойства трех из них он подробно описал и дал им условные названия – экабор, экаалюминий и экасилиций.
Несмотря на то, что Менделееву никто не поверил, ему действительно удалось предсказать существование трех элементов, которые были открыты позднее.
В 1875 г. Поль Эмиль Лекок де Буабодран (Франция) открыл галлий, предсказанный Менделеевым (экаалюминий – подобный алюминию).
В 1879 г. Ларс Фредерик Нильсон (Швеция) открыл скандий, предсказанный Менделеевым (экабор – подобный бору).
В 1886 г. Клеменс Александр Винклер (Германия) открыл германий, предсказанный Менделеевым (экасилиций – подобный кремнию).
На основе периодического закона изображена его графическая структура – периодическая система химических элементов (ПСХЭ). В настоящее время известно более 800 вариантов ПСХЭ. Это различные формы передачи периодического закона. Наиболее распространена короткая форма.
Нам необходимо разобрать строение, состав и структуру ПСХЭ.
Каждый элемент, изображенный соответствующим символом, имеет порядковый номер и занимает определенную клетку – это занумерованное место элемента в ПСХЭ, его координаты.
Горизонтальный ряд элементов, расположенных по возрастанию порядковых номеров, в котором закономерно изменяются свойства при переходе от металлов к неметаллам, называется периодом.
Учитель. Сколько всего периодов в ПСХЭ?
Ученик. В ПСХЭ семь периодов, из них 1-й, 2-й, 3-й – малые, 4-й, 5-й, 6-й, 7-й – большие. Вертикальный ряд, объединяющий элементы с одинаковой валентностью в высших оксидах, называется группой. Всего восемь групп.
Учитель. В пределах одной группы не все элементы явно сходны по своим свойствам. Однако, например, натрий и медь находятся в одной группе, но они по-разному взаимодействуют с водой. Поэтому каждая группа делится на две подгруппы – главную и побочную. Главные подгруппы включают в себя элементы малых периодов и сходные с ними по свойствам элементы больших периодов.
Где расположены, например, элементы алюминий, медь, сера?
Ученик. Алюминий расположен в 3-м периоде, III группе, главной подгруппе; медь расположена в
4-м периоде, I группе, побочной подгруппе; сера расположена в 3-м периоде, VI группе, главной подгруппе.
Учитель. Теперь давайте немного поиграем. Я буду показывать вам ребусы, вы должны будете отгадать, что за элемент зашифрован в ребусе, и затем определить, где этот элемент расположен в ПСХЭ и какими свойствами должен обладать, исходя из его расположения в ПСХЭ.
Закрепление изученного материала (решение ребуса, тест) Домашнее задание. § 35, 36, упр.4, задача, с.122 Творческие задания.
Придумать и нарисовать ребусы.
Подведение итогов
 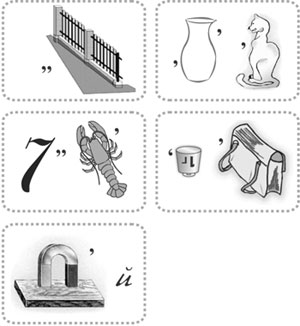
(Ответы на ребусы:
барий, цинк, калий, кальций,
никель, мышьяк, гелий,
золото, медь, кремний, бор,
азот, сера, марганец, магний.) Тесты 1. К щелочным металлам относятся элементы:
а) Na; б) Al; в) Ca; г) Li. 2. Натрий хранят под слоем:
а) керосина; б) воды; в) песка; г) бензина. 3. Самый активный среди элементов:
а) Li; б) Na; в) Сs; г) K. 4. Среда, характерная для раствора NaOH:
а) кислая; б) щелочная; в) нейтральная. 5. Установите соответствие: | Щелочной металл | Оксид | | 1) Na | а) Li2O | | 2) Li | б) Cs2O | | 3) Cs | в) Na2O | | | г) Na2O2 | | | д) СsO2 | 6. Установите соответствие: | Оксид | Гидроксид | | 1) Li2O | а) NaOH | | 2) Rb2O | б) LiOH | | 3) Na2O | в) RbOH | | 4) K2O | г) KOH | 7. К галогенам относятся:
а) Сl; б) Mn; в) Вr; г) Re. 8. Выберите среду, характерную для водного раствора НСl:
а) щелочная; б) кислая; в) нейтральная. 9. В основу классификации элементов Д.И.Менделеев положил:
а) массу; б) плотность; в) температуру. 10. Допишите предложение:
«Д.И.Менделеев расположил элементы в порядке…» 11. В перечне химических элементов Al, P, Na, C, Cu больше:
а) металлов; б) неметаллов. 12. Малые периоды – это:
а) 1; б) 2; в) 5; г) 7. 13. В главную подгруппу I группы входят:
а) Nа; б) Сu; в) K; г) Li. 14. В главной подгруппе с уменьшением порядкового номера металлические свойства:
а) усиливаются; б) ослабевают; в) не меняются. |



















