Сосуд разделён на две равные по объёму части пористой неподвижной перегородкой. В левой части сосуда содержится 8 г гелия, в правой − 1 моль аргона. Перегородка может пропускать молекулы гелия и является непроницаемой для молекул аргона. Температура газов одинакова и остаётся постоянной. Выберите два верных утверждения, описывающих состояние газов после установления равновесия в системе. |
| | 1) | Давление в обеих частях сосуда одинаково. | | | 2) | Концентрация гелия и аргона в правой части сосуда одинакова. | | | 3) | Внутренняя энергия гелия в сосуде больше, чем внутренняя энергия аргона. | | | 4) | Внутренняя энергия гелия в сосуде в конечном состоянии больше, чем
в начальном. | | | 5) | В правой части сосуда общее число молекул газов в 2 раза меньше, чем в левой части. |
|
Решение:
Проверяем № 1. Из уравнения Менделеева-Клапейрона p =  . Объемы частей V и температуры газов T одинаковы, количество вещества ν в правой и левой части разное. Количество вещества гелия ν =
. Объемы частей V и температуры газов T одинаковы, количество вещества ν в правой и левой части разное. Количество вещества гелия ν = 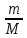 =
= 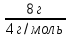 = 2 моль. Этот вариант неверный.
= 2 моль. Этот вариант неверный.
№ 2. Перегородка пропускает гелий, и он распределится равномерно по всему объему. В правой части сосуда находится 1 моль гелия. Концентрация показывает число молекул газа в единице объема n = 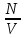 , N = ν∙ NA. Количество вещества одинаково, значит и концентрация тоже. Вариант верный.
, N = ν∙ NA. Количество вещества одинаково, значит и концентрация тоже. Вариант верный.
№ 3. Внутренняя энергия идеального газа U =  . Температура Т газов одинакова, количество ν гелия больше чем аргона, поэтому внутренняя энергия гелия в сосуде больше, чем внутренняя энергия аргона. Вариант верный.
. Температура Т газов одинакова, количество ν гелия больше чем аргона, поэтому внутренняя энергия гелия в сосуде больше, чем внутренняя энергия аргона. Вариант верный.
№ 4. Внутренняя энергия гелия в сосуде в конечном и начальном состоянии одинакова, т.к. температура и количество вещества не меняются. Вариант неверный.
№ 5. Число молекул газа N = ν∙NA. В правой части сосуда общее ν = 2 моль, что в 2 раза больше, чем в левой. Вариант неверный.
Ответ: 23 или 32.
1 моль идеального одноатомного газа участвует в процессе 1–2–3, график которого представлен на рисунке в координатах V–p, где V – объём газа, p – его давление. Температуры газа в состояниях 1 и 3 T1= T3=300 К. В процессе 2–3 газ увеличил свой объём в 3 раза. Какое количество теплоты отдал газ в процессе 1–2?
Дано:
Решение:
ν = 1 моль,
V3 = 3V2,
T1 = T3 = 300 К,
Найти:
Q12
Процесс 1-2, изохорный V = const, V1 = V2.
Первый закон термодинамики для изохорного процесса Q1 2 = ΔU, где ΔU = 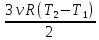 изменение внутренней энергии газа в этом процессе.
изменение внутренней энергии газа в этом процессе.
Процесс 2-3, изобарный p = const, p2 = p3. Закон Гей-Люссака 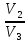 =
=  ,
,  =
= 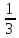 ,
,
T2 = 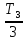 = 100 К.
= 100 К.
Q12 = 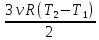 , Q12 =
, Q12 =  = - 2493 Дж.
= - 2493 Дж.
Ответ: - 2493 Дж.
На графике представлена зависимость объёма постоянного количества молей одноатомного идеального газа от средней кинетической энергии теплового движения молекул газа. Опишите, как изменяются температура и давление газа в процессах 1−2 и 2−3. Укажите, какие закономерности Вы использовали для объяснения.
Решение. Давление идеального газа в состоянии 1 и 2: p1 =  n
n =
=  , p2 =
, p2 = 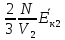 . По условию
. По условию 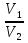 =
=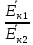 , поэтому
, поэтому  =
= 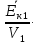
 = 1, p1 = p2.
= 1, p1 = p2.
Средняя кинетическая энергия теплового движения молекул газа пропорциональна температуре  =
=  . В процессе 1-2 давление газа не изменяется, температура увеличивается.
. В процессе 1-2 давление газа не изменяется, температура увеличивается.
По графику видно, что  =
=  , следовательно T2 = T3. Так как процесс изотермический, применяем закон Бойля-Мариотта: p2V2 = p3V3, V3 V2, значит p3 p2. В процессе 2-3 давление газа увеличивается, температура не изменяется.
, следовательно T2 = T3. Так как процесс изотермический, применяем закон Бойля-Мариотта: p2V2 = p3V3, V3 V2, значит p3 p2. В процессе 2-3 давление газа увеличивается, температура не изменяется.
Ответ: в процессе 1-2 давление газа не изменяется, температура увеличивается; в процессе 2-3 давление газа увеличивается, температура не изменяется.
На рисунке показан график циклического процесса, проведённого с одноатомным идеальным газом, в координатах р–Т, где р – давление газа, Т – абсолютная температура газа. Количество вещества газа постоянно.
Из приведённого ниже списка выберите два правильных утверждения, характеризующих процессы на графике.
| | 1) | Газ за цикл совершает положительную работу. |
| | 2) | В процессе АВ газ получает положительное количество теплоты. |
| | 3) | В процессе ВС внутренняя энергия газа уменьшается. |
| | 4) | В процессе СD над газом совершают работу внешние силы. |
| | 5) | В процессе DA газ изотермически расширяется. |
Решение.
Чтобы проверить первое утверждение, построим график циклического процесса в координатах р –V.
Проанализируем каждый переход. Процесс АВ: V = const,  = const, pВ pА, TВ TА; процесс ВС: T = const, рV = const, pС pВ, VС VВ; процесс СD: V = const, pD pC, TD TC; процесс DA: T = const, рV = const, , pA pD, VA VD.
= const, pВ pА, TВ TА; процесс ВС: T = const, рV = const, pС pВ, VС VВ; процесс СD: V = const, pD pC, TD TC; процесс DA: T = const, рV = const, , pA pD, VA VD.
Работа газа на участках АВ и СD равна 0, т.к. V = const, на участке ВС работа газа положительна, т.к. объем газа увеличивается. на участке DA - отрицательна. По модулю работа газа больше на участке ВС, т.к. площадь фигуры под графиком ВС в координатах р –V – наибольшая. Работа газа за цикл А = ААВ + АВС + АСD + АDA. Следовательно, газ за цикл совершает положительную работу. Первое утверждение верное.
Для изохорного процесса АВ первый закон термодинамики QАВ = ΔUАВ, где ΔU - изменение внутренней энергии газа пропорционально ΔТ. Т.к. ΔТ 0, ΔU 0, QАВ 0. Второе утверждение верное.
В процессе ВС внутренняя энергия газа не изменяется, т.к. не изменяется температура. Утверждение № 3 не верно.
В процессе СD над газом не совершают работу, т.к. ΔV = 0. Утверждение № 4 не верно.
В процессе DA объем газа уменьшается, газ изотермически сжимается. Утверждение № 5 не верно.
Ответ: 12 или 21.
Для того чтобы совершить воздушный полёт, отважный мальчик решил использовать воздушные шары объёмом 10 л, наполненные гелием. Сколько воздушных шаров потребуется, чтобы поднять в воздух мальчика массой 40 кг при нормальном атмосферном давлении? Температура окружающего воздуха 28 °C. Массой оболочек шаров и их упругостью, а также силой Архимеда, действующей на мальчика, пренебречь.
| Дано: | Решение: |
| Т = 301 К, V0 = 10 л = 0,01м3, p = 105 Па, m = 40 кг, M1 = 0,029 , , M2 = 0,004 Найти: N | Запишем условие плавания тел: FA = Fтяж. (1) Сила Архимеда FA равна, весу вытесненного шарами воздуха FA = m1g, массу вытесненного воздуха найдем из уравнения Менделеева-Клапейрона pV =  , V = NV0, m1 = . Аналогично найдем массу гелия m2 = . , V = NV0, m1 = . Аналогично найдем массу гелия m2 = . Сила тяжести, действующая на мальчика с шарами Fтяж = (m + m2)g = (m + )g. (2) Сила Архимеда FA= g. (3) Подставим (2) и (3) в (1): g = (m + )g, выразим N. - = m,  (M1 - M2) = m, N = , (M1 - M2) = m, N = , N = ≈ 4002. Ответ: ≈ 4002. |
Постоянное количество одноатомного идеального газа участвует в процессе, который изображён на рисунке в переменных p – U, где U – внутренняя энергия газа, p – его давление. Опираясь на законы молекулярной физики и термодинамики, определите, получает газ теплоту или отдаёт в процессах 1–2 и 2–3.
Решение. Процесс 1-2: U = const, значит T = const, т.к. внутренняя энергия идеального газа пропорциональна его температуре Т. Из закона Бойля-Мариотта для изотермического процесса (m и T = const, рV = const) давление газа обратно пропорционально зависит от объема. По графику p2 p1, значит V2 V1. Работа газа А12 Согласно первому закону термодинамики для изотермического процесса Q12 = А12. В процессе 1-2 газ отдает тепло, т.к. Q12
Процесс 2-3: по графикуU3 U2, ΔU23 значит T3 T2. Процесс изобарный: p, m = const,  = const. Значит V3 V2. Газ совершает отрицательную работу А23 Согласно первому закону термодинамики для изобарного процесса Q23 = ΔU 23 + А23. Из выше сказанного следует Q23
= const. Значит V3 V2. Газ совершает отрицательную работу А23 Согласно первому закону термодинамики для изобарного процесса Q23 = ΔU 23 + А23. Из выше сказанного следует Q23
Ответ: газ отдает тепло в процессе 1-2 и 2-3.
Аргон помещают в открытый сверху сосуд под лёгкий подвижный поршень и начинают охлаждать. Давление воздуха, окружающего сосуд, равно 105 Па. Начальный объём газа 9 л, начальная температура 450 К. Масса газа в сосуде остаётся неизменной. Трением между поршнем и стенками сосуда пренебречь.
Установите соответствие между физическими величинами, характеризующими аргон, и формулами, выражающими их зависимость от абсолютной температуры T газа в условиях данной задачи.
К каждой позиции первого столбца подберите соответствующую позицию
из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
| | | ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ | ФОРМУЛЫ | | А) | объём газа V(T) | | Б) | внутренняя энергия газа U(T) |
| | 1) | ɑT, ɑ=2⋅10−5 м3/К | | 2) | bT, b=4050 м3⋅К | | 3) | сT, c=20 Дж/К | | 4) | dT, d=3 Дж/К |
|
|
Ответ: 14.
Чему равно атмосферное давление в момент измерения барометром (см. рис), если погрешность прямого измерения давления равна цене деления барометра?
Ответ: ( ± ) мм рт. ст.
Ответ: p = (748 ±1) мм рт. ст.
На pV-диаграмме (см. рисунок) показано, как изменялось давление газа при его переходе из состояния 1 в состояние 3. Каково отношение A12/A23 работ газа в процессах 1–2 и 2–3?
Решение. Работа газа численно равна площади фигуры под графиком в координатах p-V/
A12 = p(3V – V) = 2pV, A23 =  (p+3p)(5V – 3V) = 4pV,
(p+3p)(5V – 3V) = 4pV,  =
=  =
=  .
.
Ответ:  .
.
В вертикальном цилиндре с гладкими стенками, открытом сверху, под поршнем находится одноатомный идеальный газ. В начальном состоянии поршень массой M и площадью основания S покоится на высоте h, опираясь на выступы (см. рис. 1). Давление газа p0равно внешнему атмосферному. Какое количество теплоты Q нужно сообщить газу при медленном его нагревании, чтобы поршень оказался на высоте H (см. рис. 2)? Тепловыми потерями пренебречь.






 . Объемы частей V и температуры газов T одинаковы, количество вещества ν в правой и левой части разное. Количество вещества гелия ν =
. Объемы частей V и температуры газов T одинаковы, количество вещества ν в правой и левой части разное. Количество вещества гелия ν = 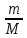 =
= 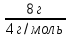 = 2 моль. Этот вариант неверный.
= 2 моль. Этот вариант неверный.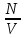 , N = ν∙ NA. Количество вещества одинаково, значит и концентрация тоже. Вариант верный.
, N = ν∙ NA. Количество вещества одинаково, значит и концентрация тоже. Вариант верный. . Температура Т газов одинакова, количество ν гелия больше чем аргона, поэтому внутренняя энергия гелия в сосуде больше, чем внутренняя энергия аргона. Вариант верный.
. Температура Т газов одинакова, количество ν гелия больше чем аргона, поэтому внутренняя энергия гелия в сосуде больше, чем внутренняя энергия аргона. Вариант верный.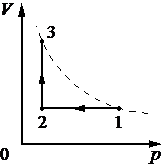
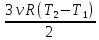 изменение внутренней энергии газа в этом процессе.
изменение внутренней энергии газа в этом процессе. 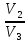 =
=  ,
, 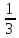 ,
, 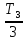 = 100 К.
= 100 К. = - 2493 Дж.
= - 2493 Дж.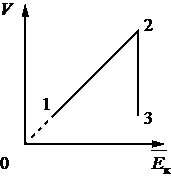
 n
n =
=  , p2 =
, p2 = 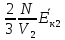 . По условию
. По условию 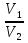 =
=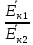 , поэтому
, поэтому  =
= 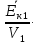
 = 1, p1 = p2.
= 1, p1 = p2.


















