
Скорость химических реакций
Автор презентации: учитель химии первой категории
МБОУ «СОШ№14 с УИОП»
Дмитриева Наталья Алексеевна
г.Балахна Нижегородская область

Химические реакции протекают с разными скоростями. Очень быстро проходят реакции в водных растворах, практически мгновенно. Быстро, но не мгновенно горит сера,
магний растворяется в соляной кислоте,
этилен обесцвечивает бромную воду. Медленно образуется ржавчина на железных предметах, налет на медных и бронзовых изделиях, гниет листва, разрушаются зубы.
Так почему же одни реакции происходят быстро, а другие могут длиться годами?

Химические реакции
гомогенные
гетерогенные
- Скорость гомогенной реакции определяется как изменение концентрации одного из исходных веществ в единицу времени (если объем системы не меняется).
- Скорость гетерогенной реакции определяется как изменение количества вещества в единицу времени на единице поверхности.

Факторы, влияющие на скорость химической реакции
- Природа реагирующих веществ
- Концентрация реагирующих веществ
- Давление (для газов)
- Температура
- Наличие катализатора
- Площадь поверхности раздела фаз (для гетерогенных реакций)

Природа реагирующих веществ
Под «природой реагирующих веществ» понимают:
Для веществ молекулярного строения – тип химических связей в молекулах реагентов, прочность связей.
Для веществ, у которых «молекула» состоит из одного атома (металлы, благородные газы) – строение электронной оболочки атома, прочность связывания внешних электронов.
Для молекул сложной формы – вероятность благоприятного для реакции взаимного расположения реагентов при соударении.

Влияние природы реагирующих веществ
Налить в три пробирки на ¼ от их объема 0,5М раствор серной кислоты.
Добавить:
В первую пробирку – Zn
Во вторую пробирку – Mg
В третью пробирку – Cu

Ход работы
Zn + H 2 SO 4 = ZnSO 4 + H 2 ↑
Mg + H 2 SO 4 = MgSO 4 + H 2 ↑
Cu + H 2 SO 4 ≠
При добавлении в пробирки металлов, в двух пробирках ( Zn и Mg ) происходит выделение водорода, причем в пробирке с магнием оно идет более энергично. В пробирке с медью реакция не идет. Это объясняется тем, что металлы находятся на разных позициях в ряду активности металлов. Из них магний самый активный металл, а медь – самый неактивный.
Следовательно, эти металлы имеют разную природу.
Вывод:
Скорость химической реакции зависит от природы реагентов.

В настоящем опыте исследуется влияние концентрации реагентов на скорость взаимодействия тиосульфата натрия с серной кислотой:
В четыре пробирки налить по 6мл 0,5М раствора серной кислоты. В четыре пронумерованных стаканчика (по 50мл) налить указанное в таблице количество 0,5М раствора тиосульфата натрия и воды. Вылить в стаканчик №1 отмеренные 6мл серной кислоты, быстро перемешать и измерить время (секунды) до начала появления в объеме раствора мути. Скорость реакции определить как величину, обратно пропорциональную полученному времени. Повторить опыт со стаканчиками №2-№4 и данные занести в таблицу.
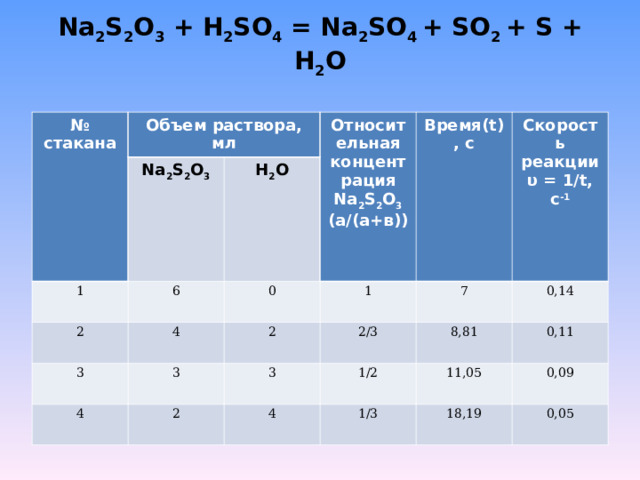
Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 + SO 2 + S + H 2 O
№ стакана
Объем раствора, мл
Na 2 S 2 O 3
1
Относительная концентрация Na 2 S 2 O 3 (а/(а+в))
H 2 O
6
2
4
Время (t) , с
0
3
4
3
2
Скорость реакции
υ = 1/ t , с -1
1
2/3
2
7
3
0,14
8,81
1/2
4
0,11
1/3
11,05
0,09
18,19
0,05


Температура
- Опытным путем Вант-Гофф установил, что скорость большинства химических реакций увеличивается в 2-4 раза при повышении температуры на 10 градусов. Это правило носит его имя и выражается уравнением
- где υ t 2 и υ t 1 – скорости реакций соответственно при конечной( t 2) и начальной( t 1) температурах, γ- температурный коэффициент скорости реакции, показывающий, во сколько раз увеличивается скорость реакции с повышением температуры на каждые 10 ○ С и равный 2-4.

Катализатор
Влияние катализатора на скорость химической реакции.
А) Гетерогенный катализ
В три пробирки налить по ¼ объема пероксида водорода. Одновременно добавить:
В первую пробирку – MnO 2
Во вторую – SiO 2
В третью – FeO
Наблюдать реакции разложения пероксида водорода.



Ход работы
При добавлении оксида марганца ( IV ) произошло бурное выделение кислорода, тлеющая лучинка, опущенная в пробирку, ярко загорелась
При добавлении оксида кремния скорость реакции шла без увеличения скорости, тлеющая лучинка погасла, значит, SiO 2 не является катализатором.
При добавлении FeO реакция происходила медленнее остальных реакций. Лучинка продолжает тлеть.
2 H 2 O 2 = MnO 2 2 H 2 O + 2 O ↑(протекает быстро)
2 H 2 O 2 = FeO 2 H 2 O + 2 O ↑(протекает очень медленно)
2 H 2 O 2 ≠ SiO2
Вывод:
MnO 2 – сильный катализатор
SiO 2 – не является катализатором
FeO – слабый катализатор
При гетерогенном катализе скорость химической реакции увеличивается.

Опыт
В две пробирки на 1/3 объема налить 0,5М раствор серной кислоты. В каждую пробирку бросить по кусочку цинка и добавить по 1 капле раствора KMnO 4 . Одну пробирку оставить в качестве эталона, а в другую – добавить несколько кристаллов KNO 3 в качестве катализатора.




При взаимодействии металлического цинка с раствором серной кислоты образуется атомарный водород, который, рекомбинируя, выделяется в виде газа H 2 . В первой пробирке восстановление перманганата калия происходит непосредственно атомарным водородом (реакция протекает довольно медленно). Во второй пробирке атомарный водород вначале восстанавливает ион NO 3 - до иона NO 2 - , который реагирует с перманганатом калия значительно быстрее
При этом MnO 4 - восстанавливается до Mn 2+ , а ион NO 2 - вновь окисляется до NO 3 - .
- Zn + H 2 SO 4 = ZnSO 4 +2H
- 2H = H 2 – рекомбинация
- 5 KNO 3 + 10H = 5KNO 2 + 5H 2 O
- 5KNO 2 + 2KMnO 4 + 3H 2 SO 4 = 5KNO 3 + 2MnSO 4 + K 2 SO 4 +3H 2 O
Таким образом, нитрат калия, участвуя в промежуточных стадиях процесса, способствует более быстрому протеканию реакции восстановления перманганата калия. Сам же KNO 3 в результате реакции не расходуется и остается в первоначально взятом количестве.
Суммарная реакция:
5 Zn + 2 KMnO 4 + 8 H 2 SO 4 = 5 ZnSO 4 + 2 MnSO 4 + K 2 SO 4 + 8 H 2 O
Катализатор снижает энергетический барьер реакции
Вывод:
При гомогенном катализе скорость химической реакции увеличивается

Влияние поверхности раздела фаз на скорость реакции
Налить в два стаканчика на ¼ их объема 2М раствор соляной кислоты.
Выбрать два одинаковых кусочка мела, поместить один из них в фарфоровую ступку и растереть в порошок.
Пересыпать порошок на листок бумаги.
Одновременно в первую пробирку бросить кусочек мела, а во вторую – порошок.
Наблюдать выделение газа.





Вывод
Химическая кинетика – довольно молодая наука, в ней много неизученного. Но знания в этой области необходимы как на производстве, так и в быту.

Спасибо за внимание !













































