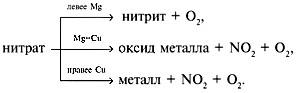Урок по теме: «Нитраты – соли азотной кислоты. Азотные удобрения»
Цель урока: закрепить знания учащихся об общих свойствах солей, изучить особые свойства нитратов и их применение.
Задачи урока:
Образовательные:
закрепить понятия о составе нитратов как представителях класса солей;
рассмотреть физические свойства нитратов;
углубить знания о солях-нитратах в свете теории электролитической диссоциации и участия в окислительно-восстановительных процессах;
научить определять нитрат-ион в растворе;
познакомить учащихся с важнейшими представителями нитратов и показать их значение в народном хозяйстве и быту.
Воспитательные:
формировать навыки безопасного обращения с веществами;
формировать умения применения полученных знаний в быту;
воспитывать самостоятельность, чувство собственного достоинства;
воспитывать уверенность в своих силах, настойчивость.
Развивающие:
развивать умения анализировать, сравнивать, обобщать, делать выводы, грамотно излагать свои мысли;
развивать умения и навыки при проведении эксперимента с соблюдением правил техники безопасности;
развивать творческую деятельность;
совершенствовать навыки работы с компьютером;
развивать познавательные способности, потребности и интерес у учащихся к предмету.
Тип урока: урок формирования знаний
Используемые технологии: Педагогика сотрудничества, элементы ИКТ, проектного обучения, проблемного обучения, игровых технологий.
Оборудование: компьютер, проектор, экран, презентация, видеофильмы; демонстрационные пробирки, спиртовка, спички, тигельные щипцы,
Реактивы: набор нитратов: NaNO3, KNO3, Cu(NO3)2, Сa(NO3)2, AgNO3, Ва(NO3)3, NaOH NaCL, Fe (железный гвоздь), CuSO4
Растительные объекты: свекла, морковь, картофель, редька, редис, помидор, яблоко, апельсин, банан, свежевыжатые соки .
Предварительная работа
4-е ученика работают над проектом «Круглый стол». Результаты работы учащиеся оформляют в виде сообщений.
I. МОТИВАЦИОННО - ЦЕЛЕВОЙ ЭТАП
Организационный этап: создание доброжелательной обстановки на уроке
Сегодня мы продолжаем изучать азот и его соединения. Тема «Соли азотной и азотистой кислот. Азотные удобрения».
Эпиграф:
«Высшее призвание человека состоит в том, чтобы не
только объяснить, но и изменить мир, - сделать его лучшим»
И.В.Мичурин.
Учитель: Ребята, я вам желаю благоприятного сотрудничества, чтобы все цели, которые мы сегодня перед собой поставили, были достигнуты.
Работать вы будете и в группах. Успех работы группы зависит от работы каждого члена этой группы, поэтому необходима взаимопомощь. На столах у каждого из вас есть карта с заданиями для группы.
Мотивация
Учитель: Но урок я хочу начать с проверки письменного домашнего задания и с проверки качества усвоения изученного материала. Все ли получилось по письменным заданиям? (называю ОТВЕТ К ЗАДАЧЕ)
II. Проверка З Н А Н И Й
1. Фронтальный опрос
С классом Блиц-опрос:
1.Элемент, который находится под порядковым номером 7 –
2.Общее число электронов у атома азота –
3. Число неспаренных электронов атомов элементов подгруппы азота –
4.Степень окисления азота в азотной кислоте -
5. Степень окисления азота в аммиаке –
6.В молекуле азота связь –
7. В молекуле аммиака связь –
8. 3 – 10% - раствор аммиака называется …
9. «Азот – непременная составная часть живых организмов». Речь идет о простом веществе или химическом элементе?
10. в составе воздуха азот - %
11. Аммиак при нормальных условиях – это …
12. Аммиак при н.у. занимает объем …
13. Формула оксида азота (IV) – это …
14. Почему вовремя грозы почва обогащается азотом?
15. Как правильно хранить азотную кислоту?
2. Индивидуальный опрос (у доски)
Карточка № 1
Закончите уравнения практически осуществимых реакций:
а) HNO3 + CaCl2 =
б) HNO3 + NaOH =
в) НNO3 + SO2 =
г)HNO3 + K2SiO3 = (это реакция с упр. дом. зад)
Подпишите названия полученных солей. Последнюю реакцию запишите в ионном виде.
Карточка 2. 1). В молекулярном уравнении реакции

коэффициент перед формулой окислителя равен…
2) В молекулярном уравнении реакции
HNO3 + Zn = Zn( NO3)2 + NO2 + H2O
коэффициент перед формулой восстановителя равен…
а) формула «царской водки»
Карточка 3. Написать с.о. азота, их соединения и дать им краткую характеристику.
N N2 N N N N N
NH3 N- N N2O NO N2O3 NO2 +Н2О =HNO3+HNO2 N2O5
HNO2 4NO2+2H2O+O2=4HNO3 HNO3
( соли нитриты) ( соли нитраты )
Аммиак - бесцветный газ с резким запахом, ядовит. Хорошо растворим в воде, образуя раствор NH4OH. Водный раствор аммиака обладает щелочными свойствами, ион аммония NH4 положительно заряжен, играет роль катиона металла.
В 1787 году Лавуазье установил наличие в воздухе газа, не поддерживающего дыхание и горения. По его предложению этому газу было дано название «азот», означающее «безжизненный», другое латинское название «нитрогениум» означает «рождающий селитру». Бесцветный газ без запаха и вкуса. Прочностью молекулы азота обусловлена его химическая инертность. Без белка нет жизни, а без азота нет белка. К сожалению, связывать свободный атмосферный азот, т.е. превращать в соединения способны только «клубеньковые» бактерии, которые живут в клубеньках на корнях бобовых растений. Таким образом, азот входит в состав растительных белков. Человек получает белки из растительной и животной пищи, животные, в свою очередь, получают их также из растений.
N2O- не солеобразующий оксид, бесцветный газ со слабым сладковатым запахом, растворим в воде. При высоких концентрациях возбуждает нервную систему («веселящий газ»). Активно использовался медиками стоматологами в 19 веке, в 20 веке в хирургии в качестве наркоза. Но его небезопасное воздействие было замечено вовремя. Поэтому его стали совмещать с кислородом. Замечен газ как пищевая добавка Е 942 – продлевает срок годности продуктов. Молодежь мегаполисов начинает «приседать» на новую разновидность наркотика, употребление которого приводит к страшным последствиям. Надеемся, что доступность закиси азота («веселящего газа») – это дело времени. ?
NO – несолеобразующий оксид, в природе образуется при температуре электрической дуги. Реакция обратима.
N2O3 – солеобразующий оксид, неустойчив при обычных условиях, взаимодействует с водой, образуя азотистую кислоту – HNO2
NO2 – промышленники называют «лисьи хвост», бурый газ, тяжелее воздуха, солеобразующий, ядовит. Для человека смертельна даже присутствие 0,01% в крови
N2O5 – бесцветное кристаллическое вещество, легко разлагается на NO2 и O2. сильный окислитель. В воде легко растворяется с образованием азотной кислоты.
А) что называется солеобразующими оксидами?
III. Переход к новой теме
Используя уравнения реакций 1, выясняем названия солей азотной кислоты. Нитраты” - в переводе с греч. означает “селитра”. КNO3, NaNO3, Са(NO3)2, NН4 NO3 называются селитрами.
NaNO3 – чилийская селитра
KNO3 – индийская селитра
Ca(NO3)2 – норвежская селитра
Как вы считаете, почему их так назвали? (потому, что основные залежи минералов – именно в этих местах). И все они являются солями азотной кислоты и применяются как азотные удобрения
Целеполагание ПРОБЛЕМНЫЙ ВОПРОС?
Проблема нитратов активно обсуждается в настоящее время. Вопрос очень актуален, о нем говорят со всех каналов телевидения, пишут в газетах, говорят все, даже те, кто вообще не знает химию.
Но почему же, если все знают об опасности нитратов, зачем их применяют? Попробуем в этом разобраться и мы.
Итак, как можно сформулировать тему урока?
IV. Изучение нового
Учащиеся называют: «НИТРАТЫ – соли азотной кислоты. Азотные удобрения»
Учитель: Математик Н.М. Крылов сказал: «Теория без практики мертва, практика без теории сверх того пагубна». Обратите внимание на оборудование на столах. Будете проводить исследовательскую работу по группам и наблюдать за экспериментом по плану:
- общие свойства нитратов;
- особенные свойства нитратов;
- решение задач на вычисление % доли вещества
СЛАЙД
1. Химические свойства нитратов общие с другими солями
| №п.п | Ход работы | реактивы | Уравнения реакций и наблюдения |
| 1 | Растворимость в воде | KNO3 |
|
| 2 | Взаимодействие с кислотами | Ba(NO3)2 H2SO4 | |
| 3 | Взаимодействие со щелочами | Cu(NO3)2 NaOH |
|
| 4 | Взаимодействие с солями | AqNO3 NaCL |
|
| 5 | Взаимодействие с металлами | Fe CuSO4 |
|
Вывод: Итак, нитраты участвуют во всех реакциях, свойственных солям.
2. Особые свойства нитратов (введение новых знаний).
Учитель: соли азотной кислоты обладают особыми свойствами, узнаем из стиха
Ученик: Даром времени не тратя,
Разберемся, как нитраты
В «печке» разлагаются.
Что же получается?
Щелочной металл – такой активный,
Он командным тоном говорит:
«Быть нитратом – это так противно,
Из нитрата превращусь в нитрит!»
А металлы из компании от магния до меди,
Цинк, железо и другие их соседи –
Осторожно и спокойно, без обид,
Из нитрата извлекают свой оксид.
На соседей меди справа
Огонь влияет как облава,
Разлагая тот нитрат
На кислород и NО2.
При этом есть такой накал,
что выделяется металл.
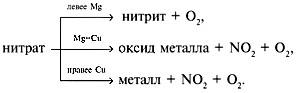
ЗАКРЕПЛЕНИЕ СЛАЙД
а) 2NaNO3 ----- 2NaNO2 + O2
б) 2Cu( NO3)2------2CuO + 4NO2 + O2
в) 2AgNO3 -------- 2Ag + 2NO2 + O2
Проблемный вопрос перед проведением опыта.
Учитель. Какие вещества образуются при разложении нитратов?
--------- нитриты;
---------оксиды металлов;
---------металлы
-------- кислород (во всех случаях) повторить Т.Б
Демонстрация опыта на разложение нитратов «Огонь-ХУДОЖНИК»
Сказать о правилах хранения нитратов
3.Закрепим правила разложения (ребята выполняют самостоятельно, используя электрохимический ряд напряжений металлов).
KNO3, Hg(NO3)2., Ca(NO3)2, Zn(NO3)2
1) 2KNO3 = 2KNO2 + O2
2) Ca(NO3)2 = Ca(NO2)2 + O2
3) 2Zn(NO3)2 = 2ZnO + 4NO2 + O2
4) Hg(NO3)2 = Hg + 2NO2 + O2
Учитель: Однако, что касается нитрата аммония: NH4NO3= N2O + 2H2O
Качественная реакция на нитрат - ион
Учитель: Каким способом можно определить нитрат- ион в растворе? (учащиеся отмечают, что NO3- ион не образует нерастворимых соединений, реакцией обмена определить нельзя). Вспомните яркое, заметное соединение, которое выделяется из нитрат – иона. Учащиеся отмечают бурый газ NO2 . Видиоролик
В раствор нитрата добавить серную кислоту до кислой реакции и медь. Смесь слегка подогреть. Выделение бурого газа указывает на наличие нитрат- иона в растворе.
NaNO3 + H2SO4 = NaHSO4 + HNO3
4HNO3 + Cu = Cu(NO3)2 + 2NO2 + 2H2O
Твердые нитраты можно распознать также по вспышке на раскаленном угольке щепоточки кристалликов соли. ( демонстрация ) ОПЫТ
4. Решить задачу. Вычислить м. д. в % азота в следующих соединениях:
а) KNO3 14%
б) Ca (NO3)2 15%
в) CO(NH2)2 46%
5. ТЕСТЫ
В а р и а н т 1 .
1. Как называются соли азотной кислоты:
а) сульфаты; б) нитраты; в) хлориды.
2. При разложении нитратов образуется газ:
а) водород; б) азот; в) кислород.
3. KNO3 – это вещество, которое:
а) хорошо растворяется в воде;
б) газообразно, без цвета и запаха;
в) твердое вещество белого цвета;
г) твердое вещество синего цвета;
д) не растворяется в воде;
е) сильный электролит.
Запишите соответствующие буквы.
4. При нагревании нитрата меди(II), кроме оксида азота(IV) и кислорода, образуется:
а) нитрит меди; б) оксид меди; в) медь.
5. Соль, которую нельзя назвать селитрой, – это:
а) NaNO3; б) NH4NO3; в) AgNO3.
В а р и а н т 2 .
1. К солям азотной кислоты относится:
а) нитрат бария;
б) карбонат кальция;
в) сульфат меди.
2. Соли азотной кислоты по отношению к воде:
а) растворимые вещества;
б) нерастворимые вещества;
в) малорастворимые вещества.
3. При разложении аммиачной селитры не образуется:
а) кислород; б) оксид азота(I); в) оксид азота(IV).
4. Специфические свойства нитратов – это:
а) реакция с металлами;
б) разложение при нагревании;
в) обменная реакция с кислотами.
5. Установите соответствие между разлагающимися веществами и продуктами реакции.
Вещество Продукты реакции
1) KNO3 а) Нg + NO2 + O2
2) Cu(NO3)2 б) KNO2 + O2
3) Нg(NO3)2 в) CuO + NO2 + O2
г) Сu + NO2 + O2
Учитель: Мы живем в 21 веке, но, к сожалению, пока с нитратами. На улице весна, а вместе с ней весенняя страда. В чем плюсы и минусы использования нитратов, наверное, интересует каждого из нас . Итак, «Круглый стол» людей разных сфер деятельности.
Это эксперт-врач, эксперт-эколог, практик из среды опытных огородников и известный шеф-повар.
К р у г л ы й с т о л
Эксперт-врач. Избыток в почве нитратов ухудшает качество выращиваемых овощей, фруктов, зерновых культур и др. Несомненно, при потреблении в повышенных количествах нитраты в пищеварительном тракте частично восстанавливаются до нитритов (более токсичных соединений) и даже до аммиака. Последние при поступлении в кровь могут вызвать:
• развитие онкологических заболеваний;
• появление заболевания, при котором кровь не способна удерживать кислород, – метгемоглобинемии (кислородного голодания);
• нарушение деятельности щитовидной железы и др.
--- Для самих растений нитраты безвредны, а для человека и животных опасны. Смертельная доза для человека 8–15 гр
---- Признаки небольшого отравления – слабость, головокружение, тошнота. Первая помощь при отравлении нитратами – обильное промывание желудка, приём активированного угля. Уменьшит вредное влияние нитратов – употребление витамина С. При критическом самочувствии незамедлительно обращаться к врачам.
Нитраты фармацевтике используют для получения лекарственных препаратов и это, конечно, большая польза
--нитрат серебра, который чернит ткать, бумагу (ляпис) применяют как противомикробное средство для лечения кожных язв, прижигания бородавок
-- основный нитрит висмута (денол) назначают внутрь при язвенной болезни желудка и двенадцатиперстной кишки.
--нитраты также в составе мазей, присыпках, назначаемые при воспалительных заболеваниях кожи.
Нитрит натрия применяют в медицине как спазмолитическое средство. Нитросоединения, в лице Нитроглицерина, давно известный препарат, снимающий приступы стенокардии, в народе «грудная жаба». Этой болезнью страдал мой любимый писатель Марк Твен, автор романа «Приключения Тома Сойера». Еще
нитраты это полимеры, фотопленка тоже нашли использование в медицине.
Нитросоединения нашли свое применение для получения взрывчатых веществ.
С их прямой опасностью для жизни человека в русском языке появились новые термины. Это терроризм, террор, теракт. Печальных примеров, один страшнее другого, много. Мы против террора, нам ненавистен Игил. Не место на моей планете терроризму.
Не допустим!
Я закончу выводом: « Практическую медицину невозможно представить без лекарственных препаратов, получаемых из нитратов и нитритов. Взрывы же на основе нитросоединений пусть будут только в мирных целях
Эксперт-эколог
Азот основной питательный элемент, который влияет на рост вегетативных органов – стеблей и листьев. Избыточное употребление азотных удобрений не только ведёт к аккумуляции нитратов в растениях, но и приводит к загрязнению окружающей среды. Один из признаков загрязнения водоёма, цветение воды, вызываемое буйным размножением водорослей.
Многие растения способны накапливать большое количество нитратов, например: капуста, кабачки, петрушка, укроп, свекла во время роста и развития стеблей и листьев. А при созревании семян потребление азота практически прекращается. Практически нужно прекратить и внесение азотных удобрений, т.е. нитратов в этот период. Плоды, достигшие полной зрелости, не содержат нитратов. В висячих плодах нитратов вообще нет. В зимний период угроза отравления нитратами невелика, однако в весенне-летний период этот риск значительно возрастает. Совет, в сезон созревания фруктов ввести в рацион питания чёрную и красную смородину, другие ягоды и фрукты. И конечно, зеленый чай.
Как распределяются нитраты в различных овощах?
1) У свеклы нитраты сконцентрированы в верхней части корнеплода – до 65%;
2) у моркови: в сердцевине – 90% и в наружной части – 10%;
3) у капусты – в кочерыжке и в толстых черешках листьев;
4) у картофеля в мелких клубнях нитратов больше, чем в крупных. Сосредоточены они под кожурой (поэтому необходимо чистить не экономя);
5) маленькие огурцы содержат нитратов меньше, чем большие, в огурце, сорванном утром, нитратов меньше.
Взрослый человек нормально переносит 150–200 мг нитратов в день, а 500 мг – предельно допустимая для него доза. Для грудного ребенка токсичны уже 10 мг.
шеф-повар.
В пищевой промышленности применяют в колбасном производстве, 7г на 100г фарша. Нитриты придают колбасе розовый цвет. К тому же присутствие нитритов необходимо ещё и по другой причине: они предотвращают развитие микроорганизмов, выделяющих токсические вещества. В своей работе я придерживаюсь следующих рекомендаций по предотвращению отравлении нитратами
Рекомендации по предотвращению отравления нитратами
1. Тщательное промывание овощей и фруктов уменьшает содержание нитратов на 10%, а механическая очистка – на 15–20%.
2. Зелень (петрушку, укроп, салат и др.) необходимо поставить, как букет, в воду на прямой солнечный свет. В таких условиях нитраты в листьях в течение 2–3 ч полностью перерабатываются и потом практически не обнаруживаются. После этого зелень можно без опасения употреблять в пищу.
3. Свеклу, кабачки, капусту, тыкву и другие овощи перед приготовлением необходимо нарезать мелкими кубиками и 2–3 раза залить теплой водой, выдерживая по 5–10 мин. (Нитраты хорошо растворимы в воде (особенно теплой) и вымываются из овощей.)
4. Варка овощей снижает содержание нитратов на 50–80%.
5. Квашение, соление, консервирование и маринование способствуют снижению нитратов на 60–70%.
6. Нейтрализовать поступившие в организм нитраты могут ягоды черной и красной смородины, зеленый чай, а также аскорбиновая кислота (по 0,3–0,4 г в сутки).
Практик-огородник
Вы знаете у меня свой огород, выращиваю все культуры и с большим успехом. Получаю очень высокие урожаи. Применяю нитраты- т.е. азотные удобрения, но соблюдаю нормы и сроки их внесения. Азотные удобрения рекомендуется вносить в несколько приемов поздней осенью или ранней весной, так как талые воды смывают половину удобрений в моря и океаны. А там самое большое разнообразие жизни, обреченные на отравление ими.
Хочу дать совет всем огородникам из личного опыта. Бобовые растения вообще не нуждаются в азоте. Они сами обогащают им почву. Практикую севооборот – хороший метод! Высеваю поздней осенью клевер – это бобовое растение. Ранней весной скашиваю. Зеленая масса идет как витаминизированный корм моим домашним животным: коровам, козам. Тут двойная польза: молоко без вредных добавок, а почва с естественным азотом. Такая земля любую культуру родит на славу! Так при минимальных затратах могу предостеречь себя и свою семью от отравления нитратами. Вообще, для себя решил,- будущую свою профессию я вижу в сельскохозяйственном производстве
Я очень доволен, что мне посчастливилось выступить на этом мероприятии и хочу обратиться ко всем жителям нашей планеты с просьбой:
« Берегите эти земли, эти воды,
Даже малую былиночку любя.
Берегите всех зверей внутри природы.
Убивайте лишь зверей внутри себя»
Е.Евтушенко.
Учитель.
Заключение. «В жизни надо иметь свое служение, служение какому- то делу. Пусть дело это будет маленьким, оно станет большим, если будет ему верен. А люди, служившие другим, служившие по-умному, имевшие в жизни добрую и значительную цель, запоминаются надолго»
Д.С.Лихачев - литературовед
V. Сообщение домашнего задания: п.29 до конца, упр. 8-9, итоги
VI. Рефлексия
Учитель. Мне очень понравилось сегодня с вами работать. Работая в паре, вы общались. Как это влияло на результат? Я предлагаю вам примеры ответов, которые вы можете использовать, или сформулировать свои:
• работа стала более эффективной;
• это тормозило процесс;
• в работе мы допускали неточности;
• не позволило задействовать ресурсы всех участников группы.
Закончить фразы:
Я узнал..........
Я научился..........
Я понял, что могу..........
Мне понравилось..........