СОДЕРЖАНИЕ:
1. Вступление ……………………………………………………………………..2
2. Цель и задачи …………………………………………………………………..3
3. Общая характеристика солей …………………………………………………3
4. Характеристика различных солей и сфера их применения …………………8
4.1 Средние соли ………………………………………………………………….9
4.2 Кислые соли …………………………………………………………………..9
4.3 Двойные соли …………………………………………………………………9
4.4 Основные соли .……………………………………………………………….9
4.5 Комплексные соли .………………………………………………………….10
4.6 Кристаллогидраты солей …………………………………………………...11
5. Практическая часть.
Опыт №1 «Золотой дождь» …………………………………………………….11
Опыт №2 «Вулкан» ……………………………………………………………..12
Опыт №3 «Дым без огня» ………………………………………………………12
Опыт №4 «насыщение водой кристаллогидрата медного купороса» ……….13
6. Вывод и рекомендации. ……………………………………………………...15
7. Список литературы …………………………………………………………..16
-
Вступление.
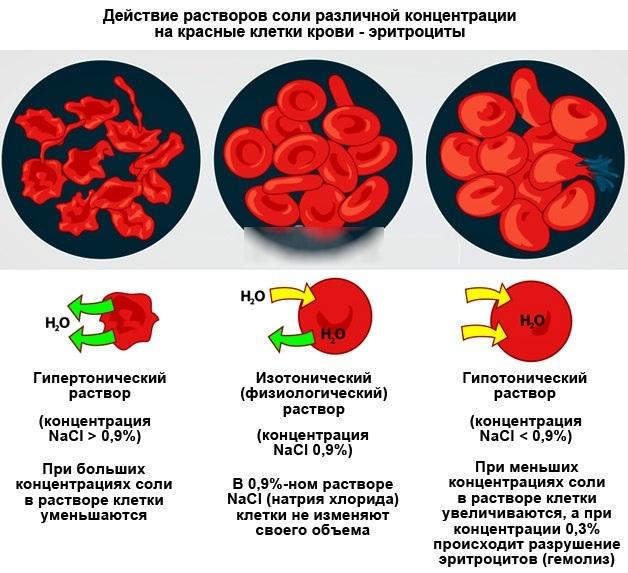
Соли - неотъемлемая часть в жизни человека. С биологической точки зрения, соли играют важную роль в организме. К примеру, процессы кроветворения, регуляция мембранной проницаемости соматических клеток. Нормальной общей концентрацией солей в плазме крови считается 0.9 %. При ее изменении объемы клеток крови – эритроцитов, будут меняться, что приведет к их разрушению, и, соответственно, гибели организма. Именно поэтому раствор хлорида натрия, или физ. раствор, широко использующийся в медицине, имеет концентрацию соли, как в крови.
В 1648 году в Москве в результате реформирования повысились цены, в том числе, на поваренную соль, что вызвало недовольство людей, и они подняли соляной бунт. На протяжении 19-20 веков фунт соли был основной денежной валютой, она стоила в четыре раза дороже говядины, а в некоторых случаях – дороже земельного участка. Обычная по сегодняшним меркам поваренная соль очень ценилась на протяжении всего существования человечества. Она находится повсеместно, например, в одном кубометре морской воды в среднем содержится почти 28 килограмм соли.
Насчитывается большое количество солей. Впервые с ними мы встречаемся в курсе химии 8 класса. Мы подробно изучаем их номенклатуру и свойства. Однако, помимо этого, в лекциях указывалось применение солей. Но более человек почти не встречается с этим понятием, что сильно сказывается на его кругозоре. В связи с этим, некоторые даже не представляют, насколько необходимы эти вещества в нашей жизни, и насколько широк спектр их применения.
Гипотеза
Интересно, а как тесно связана наша жизнь с солями? И осознают ли люди, как часто они используют соли?
2. Цель работы
Узнать сферу применения данных химических соединений в жизни человека.
Задачи работы
- Изучить общие свойства солей;
- Составить классификацию солей;
- Выяснить сферу их применения;
- Провести практические опыты;
- Проанализировать найденную информацию и обобщить ее.
Методы исследования
- Изучение литературы и ресурсов Интернет (теоретическая часть);
- Проведение экспериментов по интересующей теме.
Теоретическая часть
3. Общая характеристика солей.
Определение.
Соли - химическое соединение, состоящее из металла/неметалла и кислотного остатка, а точнее, их ионов, так как зачастую они связаны ионной связью.
Номенклатура.
Названия солей кислот по номенклатуре ИЮПАК складывается из названия кислотного остатка в именительном падеже и названия металла/неметалла в родительном падеже с указанием степени окисления римской цифрой в скобках.
Разберем на примере: Al2(SО4)3. Это алюминиевая соль серной кислоты с зарядом металла 3+. Название этой соли будет звучать так: Сульфат алюминия (II).
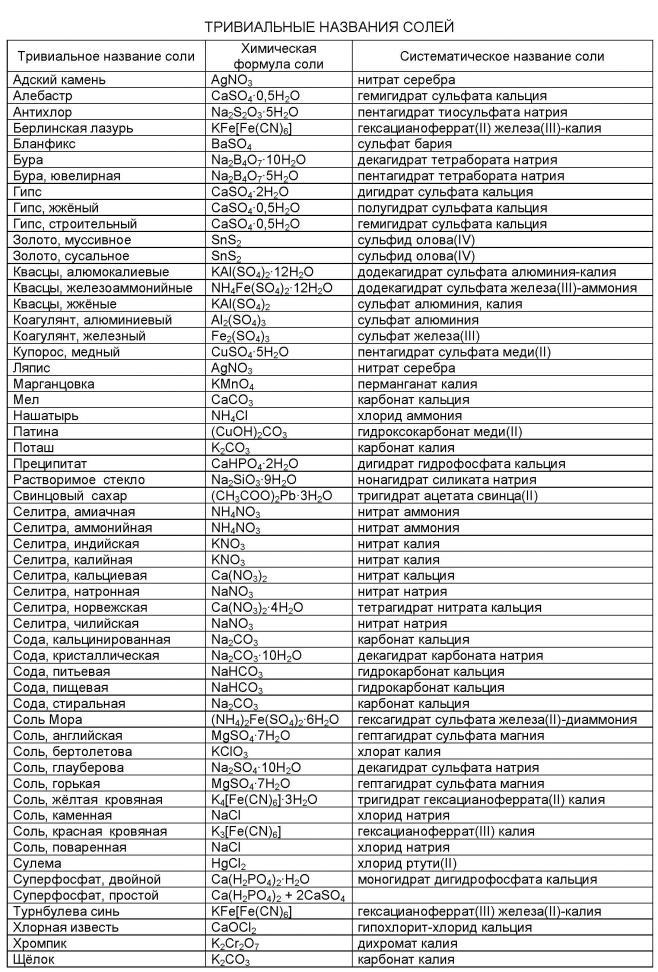
Помимо номенклатуры ИЮПАК, соли имеют тривиальные названия. В таблице представлены некоторые соли, их название по ИЮПАК и тривиальные названия:
Получение.
Для солей характерны десять общих способов их получения.
1. Кислотный оксид + основный оксид = соль
Na2O + SO3= Na2SO4
2. Щелочь + кислота = соль + вода
2КОН + H2SO4 = K2SO4 + 2H2O
3. Кислота + основный/амфотерный оксид = соль + вода
Li2O + 2HCl =2LiCl + H2O
Al2O3 + 6HCl = 2AlCl3 + 3H2O
4. Щелочь + кислотный оксид = соль
6NaOH + P2O5 = 2Na3PO4 + 3H2O
5. Соль + кислота = соль
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
6. Кислота + металл, расположенный в ряду активности левее водорода = соль + водород
2HBr + K2 = 2KBr + H2
7. Металл + раствор/расплав щелочи = соль
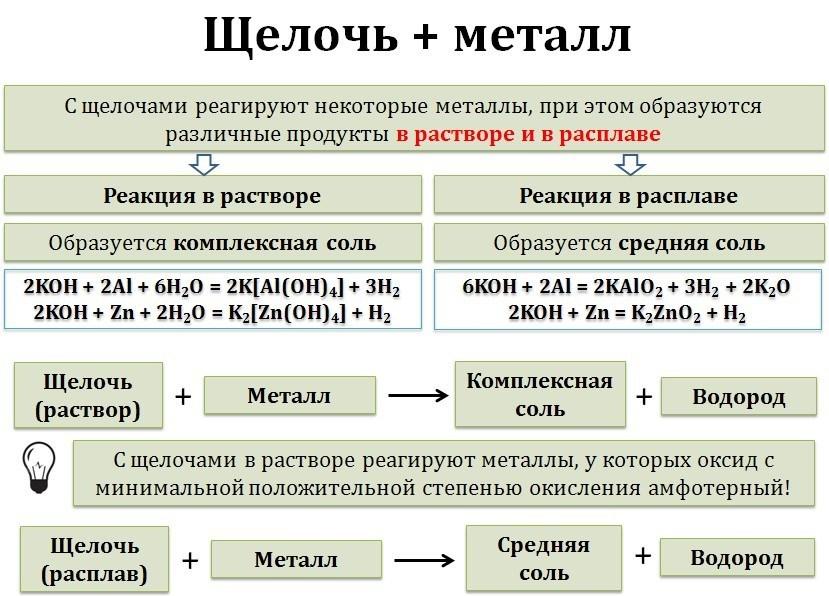 8. Щелочь + неметалл = соль
8. Щелочь + неметалл = соль

9. Соль + галоген = соль
Помня ряд активности галогенов F2Cl2Br2I2 можно составить реакцию, где более активный галоген вытесняет более слабый из соли.
2NaBr + Cl2 = 2NaCl + Br2
Опираясь на это, более слабый галоген не может вытеснить из соли более сильный
2KCl + I2≠
10. Металл + неметалл = соль
Cu + Cl2 = CuCl2
Химические свойства солей.
1. Взаимодействие растворов солей с металлами.
Взаимодействуя с более активным металлом, менее активный вытесняется из соли.
2Na + ZnCl2 = Zn + 2NaCl
2. Соли вступают в реакцию ионного обмена с щелочами.
Оба реагента должны быть растворимы, в конце должен выделиться либо газ, либо осадок, или слабый электролит.
2KOH + Cu(NO3)2 = 2KNO3 + Cu(OH)2
3. Соли вступают в реакции ионного обмена с кислотами.
При этом должны образоваться осадок, газ, или более слабая кислота.
2NaF + H2SO4 = Na2SO4 + 2HF
4. Соли вступают в реакцию с другими солями.
При этом должна образовываться нерастворимая соль.
CuSO4 + Na2CO3 = CuCO3 + Na2SO4
4. Характеристика различных солей и сфера их применения.
Соли разделяют на средние, кислые, двойные, основные, комплексные и кристаллогидраты солей:

СОЛИ






КОМПЛЕКСНЫЕ
СРЕДНИЕ

КИСЛЫЕ


ДВОЙНЫЕ
ОСНОВНЫЕ

КРИСТАЛЛОГИДРАТЫ
СОЛЕЙ
4.1 Средние соли - соли, у которых все атомы водорода изначально взятой кислоты замещены металлом. Например, K2SO4, Na3PO4, FeCl3, NaCl. С этими солями мы познакомились из курсов общей химии 8 класса.
Применение:
Эти соли мы можем встретить в неорганических удобрениях (калийное удобрение - хлорид калия), а также в поваренной соли (хлорид натрия). Натриевые соли угольной кислоты используются в изготовлении стекла и варке мыла. Также кальцевые соли ортофосорной кислоты используют для протравки тканей и кож.
4.2 Кислые соли - соли, в которых металл заменяет один атом водорода изначально взятой кислоты. Для наглядности возьмем серную кислоту. К примеру, соль серной кислоты будет иметь вид MeHSO4 и будет называться «гидрофосфат». А соль ортофосфорной кислоты будет иметь вид MeH2PO4 и будет называться «дигидрофосфат». Кислые соли бывают только двухосновными или многоосновными. Одноосновных кислых солей не бывает.
Применение:
Наиболее известный представитель - NaHCO3 - пищевая или питьевая сода, используется для приготовления пищи.
4.3 Двойные соли - соли, в которых атомы водорода замены двумя разными металлами. Иногда, их называют квасцами.
Например, NaFe(SO4)2. Читается эта соль начиная традиционно с кислотного остатка, далее идет металл, находящийся в альфа-положении со степенью окисления, далее идет через тире второй металл. То есть, название этой соли будет звучать так: «сульфат железа (III) — натрия».
Применение:
Многие соли данной разновидности используются в производстве удобрений, сырья, необходимого в химической промышленности; кроме того, они востребованы в медицине.
4.4 Основные соли - соль в которой помимо металла присутствует гидроксильная группа. Рассмотрим на примере (CuOH)2CO3. Сначала читается кислотный остаток с приставкой «гидроксо» или «дигидроксо» (в зависимости от количества гидроксогрупп), затем называется металл с его степенью окисления. То есть, данная соль называется «гидроксокарбонат меди II».
Применение: большинство солей малорастворимы. Но (CuOH)2CO3, так же известный, как малахит, используется для декорации украшений, а также для получения химического сырья.
4.5 Комплексные соли - соли, содержащие комплексный анион (реже встречается катион), состоящий из металла - комплексообразователя и соединенных с ним отрицательно заряженных частиц - лигандов. Рассмотрим на примере вещества [Ag(NH3)2]Cl. Исходя из специфических названий лигандов, NH3 будет называться «аммин», то есть, данное вещество называется хлорид диамминсеребра.
Применение:
Соли используются для очистки металлов, в том числе и ценных; в процессах разделения редкоземельных элементов, щелочных металлов; используются в химическом анализе для качественного обнаружения и количественного определения многих химических элементов.
Также в таблице представлены некоторые другие названия лигандов:

4.6 Кристаллогидраты солей - твердые соли, в состав которых входит кристаллизационная вода. Попадая в воду, заключенная в решетке вода освобождается, образуя обычный раствор соли. Этот процесс называется выветриванием. Рассмотрим на примере кристаллогидрата медного купороса - CuSO4*5H2O. Знак «*» показывает, что вода в виде кристаллов связана с веществом. Также, как пример можно назвать кристаллогидраты карбоната натрия – Na2CO3*10H2O, железного купороса – FeSO4*7H2O, сульфата алюминия (III) - калия – KalSO4*12H2O
Применение: Поскольку при растворении кристаллогидраты образуют такие же растворы, что и другие соли, то их можно применять в тех же сферах.
Существуют соли, которые не относятся ни к одной группе - перманганат калия и дихромат калия. Они являются сильными окислителями и применяются в производстве красителей, оксицеллюлоз (памперсов), лекарственных препаратов, а также они используются для дезинфекции и очистке сточных вод.
Практическая часть.
Опыт №1. «Золотой дождь».
Используемый материал: ацетат свинца, иодид калия.


Ход опыта: в горячую воду наливаем раствор иодида калия и начинаем приливать раствор ацетата свинца, ждем, когда горячая вода начнет остывать.
Выводы: иодид меди при остывании воды будет выпадать в осадок, в виде блестящих золотых гранул. Этот опыт доказал один из признаков реакции – выпадение осадка, помимо этого, мы доказали 4 химическое свойство солей – способность взаимодействовать между собой.
Опыт №2 «Вулкан»


Используемый материал: дихромат аммония.
Ход опыта: небольшое количество дихромата амония поджигаем при помощи спички или зажигалки.
Выводы: в результате разложения дихромата амония выделяется твердый оксид хрома (III) и смесь азота с водяными парами. Реакция не прекратилась до тех пор, пока не прореагировал весь дихромат амония, а в центре образовалась лунка, что напоминает кратер вулкана. В результате этой реакции мы наблюдаем выделение газов – еще один признак реакции, к тому же, мы доказали, что соли подвергаются термическому разложению.
Опыт №3 «Дым без огня»

Используемый материал: раствор аммиака, соляная кислота.
Ход опыта: к раствору аммиака добавляем соляную кислоту.
Выводы: в ходе реакции обильно выделяется дым, при этом отсуствет пламя. Соединясь с соляной кислотой, растор аммиака образует катион аммония, который образует с хлорид-анионом ионную связь, ту же, которой связаны ионы всех солей.
Опыт №4 «насыщение водой кристаллогидрата медного купороса»


Используемы материал: сульфат меди (II), пятиводный кристаллогидрат медного купороса (CuSO4*5H2O), семиводный кристаллогидрат медного купороса (CuSO4*7H2O)
Ход опыта: к безводному сульфату меди (II) постепенно добавлять небольшое количество воды, оставить на некоторое время. После чего сравнить окраску исходно взятой соли и полученной.
Выводы: окарска безводного сульфата меди стала темнее, чем была раньше, засчет смешивания с водой и проникновением ее молекул сковзь кристалическую решетку соли. В зависимости от количества заклченной в соли воды, интенсивность окраски соли усиливается. Этому подтверждение окраска пятиводного кристаллогидрата сульфата меди (II), и семиводного кристаллогидрата сульфата меди (II). Однако, пятиводная структура самая устойчивая, потому спустя какое-то время семиводный кристаллогидрат будет выцветать, приобретая более светлую окраску, т.е. теряя кристаллизационную воду, и становясь более стабильным пятиводным кристаллогидратом. По этому поводу некогда спорили Арениус и Менделеев. Дмитрий Иванович смог доказать, что растворение – химический процесс, а не физичсекий, подтвержадая свою правоту опытом с кристаллогидратами.
5. Вывод и рекомендации.
Подводя итог, все соли играют огромную роль в жизни человека. Сферы их применения совершенно различны, и в каждой из них они - незаменимые компоненты.
В жизни человека соли находятся повсеместно: от солей, содержащихся в крови, до удобрений и солей-очистителей металлов. Многие даже не задумываются, как много этих химических веществ мы используем в нашей вполне рутиной жизни. Поваренная соль на протяжении всей истории была настолько востребованной, что сейчас даже нет точных данных о ее мировых запасах, так как это одна из самых распространенных солей, а число ее добычи постоянно меняется. Но не стоит забывать, что в больших количествах она губительна для организма человека, так как вызывает обезвоживание. Смертельной дозой является примерно 3 грамма на килограмм массы тела. Вследствие чрезмерного употребления поваренной соли в пищу, повышается кровяное давление, что может привести к смерти от инсульта. В США и Европе даже существуют группы по разъяснению губительного злоупотребления соли.
Также не стоит забывать о технике безопасности при работе с химическими соединениями. Прежде, чем приступать к работе с солями, стоит знать их физиологическое воздействие: одни соли могут быть безопасны, как поваренная соль или пищевая сода, а другие могут быть очень токсичными, как соли таллия и ртути. Зная это, стоит предпринять меры безопасности при работе с ними – использовать специальное оборудование и одежду, во время опытов быть максимально осторожным, лучше выполняя их под присмотром педагога или научного руководителя, после окончания опытов провести обработку одежды, оборудования, кожи.
Список литературы:
Wikipedia// соли
hemi.nsu.ru// соли, названия и классификация солей
hemege.ru// химические свойства и способы получения солей
CHEM-MIND.сom// тема №12 «Соли»
pcpgroup.ru// соли: виды, свойства и применение
nauka.club// соли в химии - общая характеристика, классификация и примеры соединений с названиями








 8. Щелочь + неметалл = соль
8. Щелочь + неметалл = соль