
СЛАЙД 3.

Задание1
На какие группы и по каким признакам можно разделить вещества , формулы которых приведены ниже ?
Na 2 O ; H 2 CO 3 ; ; H 2 SiO 3
Ca (NO 3 ) 2 Ca CO 3 Na Cl Cr 2 S 3
Na OH ; О 2 ; Al 2 O 3 ; Ca (OH) 2 ; С
Са O ; А l; N 2 ; Al (OH) 3 ; S ; С О 2 ;
H 2 SO 3 ; SO 2 ; Ca; Na
формулы запишите в схему:

О каком веществе идёт речь?
У травоядных животных потребность в этом веществе велика. В тех странах, где этого вещества мало, люди прибегали к различным способам чтобы добывать это... ? Меланезийцы каждое утро пили морскую воду, в Новой Зеландии пищу запивали морской водой, в Северной Америке индейские племена высушивали морскую капусту и добавляли её в пищу.


Цель урока: Изучить состав, названия солей, классификацию, получение и применение.
План
- 1.Соли. Их состав и номенклатура ( название).
- 2. Составление формул солей по их названиям.
- 3. Классификация.
- 4. Представители данного класса.
- 5.Способы получения
- 6. Проверка знаний.
- 7. Подведение итогов урока.
- 8. Домашнее задание.

1 . Соли. Их состав, номенклатура (название).

- Соли - это сложные вещества, которые состоят из ионов металла и кислотного остатка

2. Составление формул солей по их названиям.

- Алгоритм составления формул солей : Составить химическую формулу
- сульфата железа ( III ) (первый способ)
Первый пункт выполнили переходим ко второму
Соли - это сложные вещества, которые состоят из ионов металла и кислотного остатка
Fe
SO 4
1. Запиши рядом знаки химических элементов, которые входят в состав вещества.

Второй пункт выполнили переходим к третьему
+3
-2
Fe
SO 4
2 . Над знаками химических элементов поставь их степень окисления.

- Пример: Составить химическую формулу сульфата железа ( III ).
Третий пункт выполнили переходим ко четвертому
Н.О.К. (наименьшее общее кратное) – это число, которое делится на исходные числа без остатка.
Таблица для определения Н.О.К.
+3
-2
2
1
5
7
6
4
3
1
1
2
3
4
5
6
7
Fe
SO 4
2
2
2
6
4
10
6
14
6
12
6
15
21
3
6
3
3
4
4
4
12
4
20
24
28
5
35
30
10
20
5
15
5
30
6
42
12
6
6
6
6
7
7
14
21
28
7
35
42
3 . Определи Н.О.К. чисел выражающих степень окисления этих элементов. Запиши Н.О.К. в квадратике над формулой.

- Пример: Составить химическую формулу сульфата железа ( III )..
Формула составлена
6
+3
-2
Fe
( SO 4 )
2
3
6
6
2
=
:
:
=
3
3
2
4. Раздели Н.О.К. на степень окисления каждого элемента. Запиши полученный индекс.

9
Составить формулу сульфата алюминия: (второй способ)

3 задание.
Определить : почему у солей разное количество кислотных остатков Дайте обоснованный ответ.
NaNO 3 Ca (NO 3 ) 2 Al (NO 3 ) 3

3 задание.
Na +1 Ca +2 Al +3
Имеют разную степень окисления.
(см. таблицу растворимости)
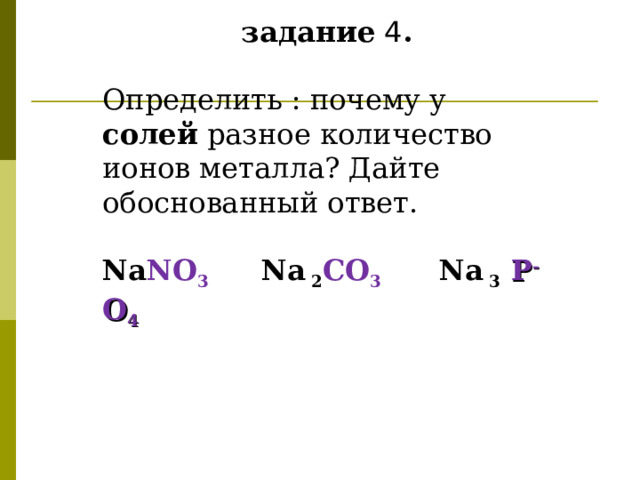
задание 4 .
Определить : почему у солей разное количество ионов металла? Дайте обоснованный ответ.
Na NO 3 Na 2 С O 3 Na 3 Р - O 4

Так как кислотные остатки имеют свою степень окисления:
(см. таблицу растворимости)
NO 2 -1 - нитрит
NO 3 -1 - нитрат
SO 3 -2 - сульфит
SO 4 -2 - сульфат
С O 3 -2 - карбонат
Р O 4 -3 - фосфат
Cl -1 - хлорид
SiO 3 -2 -силикат

Выведем общую формулу солей ?
Ме + n (К. О. - m ) n
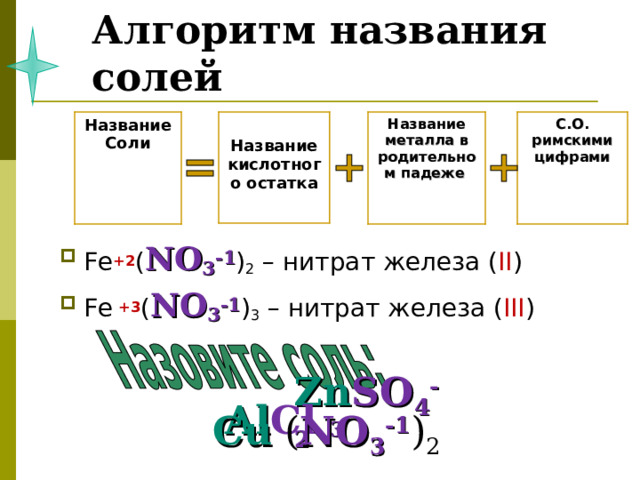
Алгоритм названия солей
Название металла в родительном падеже
С.О. римскими цифрами
Название
Соли
Название кислотного остатка
- Fe +2 ( NO 3 -1 ) 2 – нитрат железа ( II )
- Fe +3 ( NO 3 -1 ) 3 – нитрат железа ( III )
Zn SO 4 -2
Al Cl 3
Cu ( NO 3 -1 ) 2

задание 5 . НАЗОВИТЕ СОЛИ
Na Cl
Fe +2 SO 4
Al 3 ( PO 4 ) 3
Ca (NO 3 ) 2
Cu +2 CO 3
Cr 2 +3 S 3
Na 2 SO 4
Ba (NO 3 ) 2

задание 5 . НАЗОВИТЕ СОЛИ
Na Cl - хлорид натрия
Fe +2 SO 4 - сульфат железа ( II )
Al 3 ( PO 4 ) 3 – фосфат алюминия
Ca (NO 3 ) 2 - нитрат кальция
Cu +2 CO 3 – карбонат меди ( II )
Cr 2 +3 S 3 – сульфид хрома ( III )
Na 2 SO 4 – сульфат натрия
Ba (NO 3 ) 2 - нитрат бария
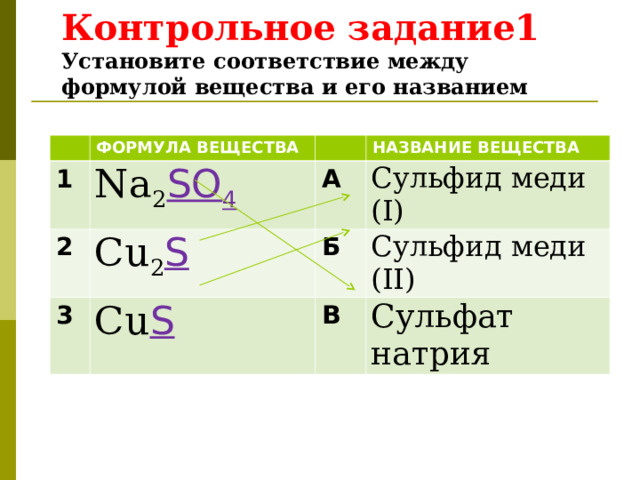
Контрольное задание1 Установите соответствие между формулой вещества и его названием
ФОРМУЛА ВЕЩЕСТВА
1
Na 2 SO 4
2
А
Cu 2 S
3
НАЗВАНИЕ ВЕЩЕСТВА
Сульфид меди ( I)
Cu S
Б
Сульфид меди ( II )
В
Сульфат натрия

Контрольное задание 2
Составьте формулу
хлорида кальция
Са Cl 2
Na NO 3
Составьте формулу
нитрата натрия
Zn( SO 4 ) 2
Составьте формулу
сульфата цинка
Cu NO 3
Составьте формулу
нитрата меди ( I )
Составьте формулу
хлорида свинца ( II )
Pb Cl 2

Классификация солей
Растворимые Нерастворимые
Малорастворимые
Аммиачная селитра
NH 4 NO 3 Сульфат кальция
Фосфат железа
FePO 4
CaSO 4

Лабораторный опыт. №1
Определите растворимость солей
Для этого:
-прибавьте в первую пробирку к хлориду
натрия 5-10 мл воды ;
- прибавьте во вторую пробирку к карбонату кальция
5-10 мл воды
Вывод:
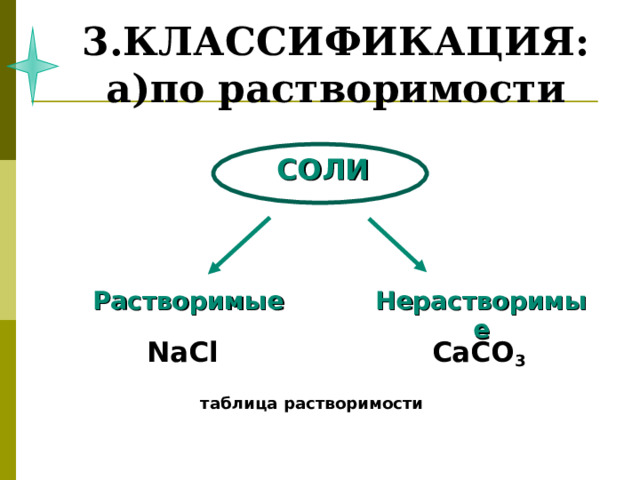
3.КЛАССИФИКАЦИЯ: а)по растворимости
СОЛИ
Растворимые
Нерастворимые
NaCl CaCO 3
таблица растворимости
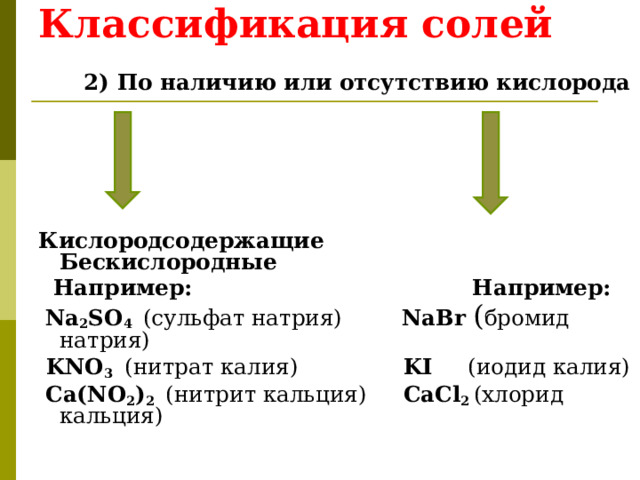
Классификация солей
2) По наличию или отсутствию кислорода
Кислородсодержащие Бескислородные
Например: Например:
Na 2 SO 4 (сульфат натрия) NaBr ( бромид натрия)
KNO 3 (нитрат калия) KI (иодид калия)
Ca(NO 2 ) 2 (нитрит кальция) CaCl 2 (хлорид кальция)
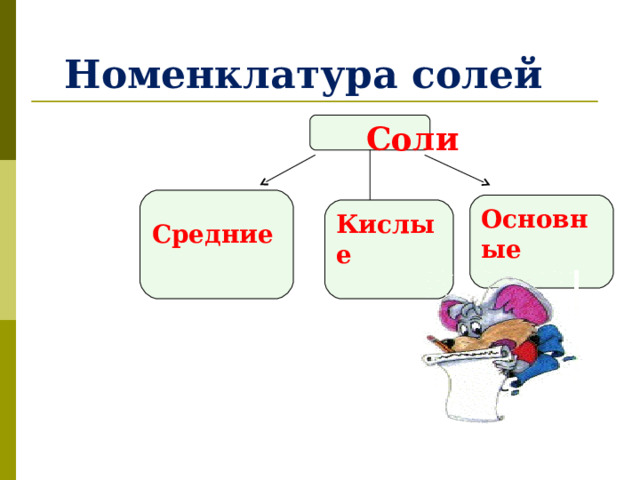
Номенклатура солей
Соли
Средние
Основные
Кислые

Номенклатура средних солей
- Средние соли – это продукты полного замещения атомов водорода в кислоте на металл.
- Название кислотного остатка
- Наименование металла в родительном падеже
М g С L 2
магния
хлорид

Номенклатура кислых солей
2) Кислые соли – это продукты неполного замещения атомов водорода в кислоте на металл.
- Указать название кислотного остатка
- К названию кислотного остатка прибавить «гидро-»
- Наименование металла в родительном падеже
NaHSO 4
сульфат
гидро
натрия

Номенклатура основных солей
3) Основные соли – это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
- Указать название кислотного остатка
- К названию кислотного остатка прибавить «основной-»
- Наименование металла в родительном падеже
MgOHCl
хлорид
основной
магния

Лабораторный опыт. №2
Определите в какой из трех пробирок находятся кислота, в какой щелочь, в какой соль, хлорид натрия.
- прибавьте в пробирку№2
- лакмус
- прибавьте в пробирку №3
Что произошло?

Контрольное задание3
Ответе на вопросы:
1.Какая окраска индикатора в растворе хлорида натрия. Почему?
2.Раствор хлорида натрия. является : кислым, щелочным или нейтральным?
3. Следовательно соль хлорид натрия какая?
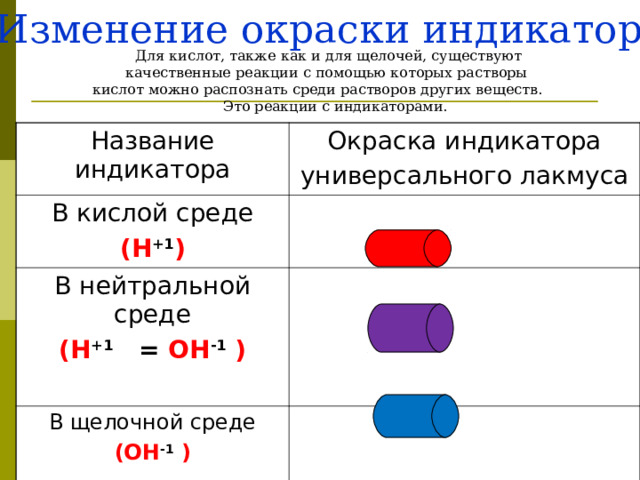
Изменение окраски индикатора
Для кислот, также как и для щелочей, существуют
качественные реакции с помощью которых растворы
кислот можно распознать среди растворов других веществ.
Это реакции с индикаторами.
Название индикатора
Окраска индикатора
универсального лакмуса
В кислой среде
( H +1 )
В нейтральной среде
( H +1 = О H -1 )
В щелочной среде
(О H -1 )
Реакция нейтрализации
Слайд 7.

Способы получения
- 2. Основание + соль = новое основание + новая соль
2 КОН + Са SO 4 = Са(ОН) 2 + К 2 SO 4
- 3. Основание + кислотный оксид + = соль + вода
2NaOH + SO 3 = Na 2 SO 4 + H 2 O
- 4. Кислотный оксид + основный оксид = соль
СО 2 + СаО = СаСО 3
- 5. Соль + соль = новая соль + новая соль
Ba С l 2 + (NH 4 ) 2 S O 4 → Ba SO 4 + NH 4 С l
- 6. Соль + металл = новая соль + металл
CuSO 4 + Fe = FeSO 4 + Cu
- 7. Металл + неметалл = соль
Fe + S = FeS

Подведем итоги?

Контрольное задание - итоговое
Часть В
Выбери лишнее вещество и объясни почему?
Игра « Третий лишний»
1. Ba SO 4 ; Ca CO 3 ; NaCl .
2. NaCl, Na 2 SO 4 , NaOH
3 . Al 2 (SO 4 ) 3 , H 2 SO 4 , CaSO 4
4. Cu(NO 3 ) 2 , CuO, CuCl 2
5. CaCl 2 , PbS, Ba SO 4 .

Контрольное задание – итоговое
1. NaCl . т.к…
2. NaOH т.к... 3 H 2 SO 4 , т.к…
4. CuO, т.к…
5. CaCl 2 т.к…

Сиквейн
1. В первой строчке тема называется одним словом (обычно существительным). 2. Вторая строчка — это описание темы в двух словах (двумя прилагательными). 3. Третья строчка — это описание действия в рамках этой темы тремя словами (глаголами). 4. Четвертая строка — это фраза из четырех слов, показывающая отношение к теме. 5. Последняя строка — это синоним из одного слова, который повторяет суть темы.

Сиквейн
1 . Соль
2. Белая, кристаллическая
3. Солит, удобряет, растворяется
4. Соль наносит вред здоровью
5. Селитра

Тест «Как я запомнил тему»:
1) Выберите формулу соли:
а) HCl б) Ca(OH) 2
в) Na 2 SO 4 г) Mg О
2) Какая из приведенных солей растворима в воде:
а) AgCl б) MgS
в) FePO 4 г) CuSO 4
3 ) Какая из приведенных солей бескислородная:
а) C а SO 4 б) KBr
в) NH 4 NO 3 г) Na 2 CO 3

За 4 года человек съедает пуд соли
(в год человек с пищей потребляет 3-5,5 кг соли)
"Среди всех природных минеральных солей, самая главная та, которую мы называем просто “соль” А.Е.Ферсман

На озере Баскунчак ежегодно добывается около 5 млн. тонн соли (Астраханская область)

Добыча соли
из соляных шахт
из соленых озер

Моллюски, раки, радиолярии, кораллы – все имеют известковый скелет

Меловые горы

Применение солей
- Соли угольной кислоты . Карбонат кальция используют в качестве сырья для получения извести. Карбонат натрия (соду) применяют в производстве стекла и при варке мыла. Карбонат кальция в природе встречается и в виде известняка, мела и мрамора.

Д/З: CaCO 3
Презентацию подготовит Новикова.

Д/З: Фосфат кальция
- основа минералов
фосфоритов и апатитов
Презентацию подготовит Горенкова

Домашнее задание
- §, 33 упр.3 стр. 112
- Составить презентацию для фосфата кальция и карбоната кальция или опорный конспект в форме таблицы
Рефлексия
Знания/умения
Да
+
1)Я знаю
нет
-
Что такое соли
Состав солей
2)Я умею
Выбирать из предложенных веществ соли
Выводить формулы солей
Составлять название солей
Классифицировать соли по растворимости.





































































